
胰腺导管内乳头状黏液瘤(IPMN)是一种起源于胰腺导管上皮、呈乳头状生长、分泌过多黏液的胰腺囊性肿瘤,具有恶变潜能,可引起胰管进行性扩张或囊变。黏液造成的囊内高压以及炎症递质、胰酶的作用,可造成恶变的瘤体发生自发性破裂出血,患者预后极差。本文报道1例IPMN恶变伴自发性破裂出血的诊治经验,以供临床参考。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者男性,54岁。因"左上腹持续性疼痛伴腹胀10余天"入院。患者10 d前无明显诱因出现左上腹间断性胀痛,经当地医院对症处理后症状未见好转,为求进一步治疗来我院就诊。入院体检:体温36.2℃、脉搏108次/min,血压130/82 mmHg(1 mmHg=0.133 kPa)。一般状态良好,皮肤巩膜无黄染,左上腹压痛,无反跳痛及肌紧张,未触及包块,移动性浊音阴性。实验室检查:白细胞9.73×109/L,血小板309×109/L,血红蛋白130 g/L,空腹血糖5.43 mmol/L,CA19-9 231.2 U/ml,CEA 2.59 ng/ml,血淀粉酶58.5 U/L,尿淀粉酶620.3 U/L。胰腺增强CT示胰腺尾部囊性低密度结节影,约8.6 cm×6.6 cm,伴出血,胰管未见扩张(图1)。EUS示胰腺尾部7.45 cm×4.65 cm无回声区,内部见点状沉积回声;无回声区后方见4.5 cm×4.5 cm大小混合回声团块,以偏强为主,胰管及胆总管无扩张。完善术前检查后行剖腹探查术。术中见腹腔内有陈旧性积血约300 ml,胰体尾部可触及大小约10 cm×6 cm×5 cm囊实性肿物,侵及部分胃壁及横结肠,遂行胰体尾脾切除、胃部分切除、结肠部分切除术,并放置腹腔引流管。切除标本病理学诊断:胰腺高分化腺癌,胰腺导管内乳头状黏液肿瘤恶变(图2)。术后第5天腹水淀粉酶21986.0 U/L,给予持续腹腔负压冲洗。术后第10天复查腹水淀粉酶<30.0 U/L,拔除腹腔引流管,术后21 d顺利出院。术后1个月给予患者吉西他滨+替吉奥化疗,持续4周期。复查CA19-9 297.2 U/ml,腹腔彩超检查考虑肿瘤复发可能,改用结合型白蛋白紫杉醇+吉西他滨化疗。患者出现恶心、呕吐及骨髓抑制等化疗不良反应,给予相应的对症处理。持续2周期后患者及家属放弃治疗,并未复查CA19-9及相关影像学检查。术后10个月患者因多器官功能衰竭死亡。
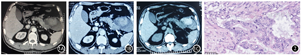

胰腺导管内乳头状黏液瘤(intraductal papillary mucinous neoplasm, IPMN)是一种相对少见的胰腺囊性肿瘤,起源于胰腺导管上皮,呈乳头状生长,分泌过多的黏液,可引起主胰管和(或)分支胰管进行性扩张或囊变[1]。病变多见于胰头,常侵及邻近器官,肿瘤大小依据导管扩张程度而异,最大径多为1~8 cm。IPMN被公认是胰腺癌的一种癌前病变,囊壁局部增厚,或形成凝胶样肿块,组织学和免疫组织化学研究已证实肿瘤发展至腺癌的连续性。在IPMN病变基础上发生的浸润性癌被称为IPMN相关浸润性癌,它有4种浸润方式:浸润性生长、黏液破裂、膨胀性生长及囊肿破裂黏液进入腹腔。该肿瘤在生长过程中常可伴发急性胰腺炎、肿瘤内出血、胰管穿孔和胰瘘等并发症,这是由于肿瘤内囊液的高压和囊液对基质细胞的破坏所致。本病例肿瘤位于胰尾,侵及胃和结肠,呈膨胀性生长,腹腔有陈旧性积血,无囊液渗出腹腔。患者既往无急性胰腺炎、外伤史及无服用抗凝药物史,考虑为IPMN恶变伴自发性破裂出血。肿瘤破裂出血是极少见的并发症,可能的机制包括(1)肿瘤细胞侵袭瘤体囊壁,肿瘤囊壁反复出血坏死,形成的新生毛细血管易发生破裂出血;(2)过多的黏液造成囊内高压,又有炎症递质和胰酶自身消化的作用,瘤体可发生自发性破裂出血[2,3]。研究表明,瘤体最大径>20 mm,或者导管扩张>10 mm,破裂出血风险显著增加。本例患者术前症状、体征及辅助检查等均诊断倾向于胃肠间质瘤,且术前无相关影像学资料提示胰管扩张,但术前未行MRCP进一步检查,这是本病例的不足之处。
IPMN患者若出现心率加快、血压下降等失血性休克早期表现或合并腹痛、腹胀、腹部包块时,要考虑肿瘤恶变伴自发性破裂出血可能,可通过血红蛋白的变化、影像学检查及诊断性腹腔穿刺明确诊断。增强CT是最佳的检查方法,快速、无创,既能判断腹腔内出血情况,同时能够评估肿瘤大小、周围浸润程度及可切除性等。MRI能够更好地评估肿瘤出血,同时能更清晰地判断肿瘤与主胰管的关系,肿瘤周围浸润程度及淋巴结转移情况,有助于明确术前临床分期。ERCP能直接观察到是否存在肿瘤内出血,同时可植入支架进行引流。EUS借助其高分辨探头和近距离探查的优势,可观察到肿瘤内部结构,确定出血部位,同时结合细针穿刺活检,为肿瘤的鉴别诊断提供有力证据。
IPMN相关浸润癌的治疗以外科手术治疗为主。术中根据胰腺切缘冷冻切片确定手术方式及切除范围,避免黏液播散及肿瘤破裂出血,并用生理盐水冲洗保留侧主胰管,以清除胰管内残留的黏液和血液。根治性切除肿瘤结合术中放疗,利用射线对肿瘤病灶进行较大剂量的照射治疗,具有精确、表面剂量高、毗邻脏器组织损伤小等优点,可有效抑制肿瘤的生长、延长患者生存时间,而且止痛效果明显,能显著改善患者生活质量[4]。术中腹腔内可注入5-氟尿嘧啶等化疗药物,将微转移灶杀死,达到区域性化疗的效果,预防病灶在腹腔内发生复发和转移[5]。也可术中置管腹腔热灌注化疗,通过热化疗和大容量灌注冲刷作用,有效杀死和清除腹腔内游离的癌细胞和微小转移灶[6]。近年来,放射性粒子植入、射频消融、介入下动脉灌注化疗等治疗方法也让失去根治性手术机会的患者得到一定的改善。对于高龄、合并其他严重基础疾病、不能耐受手术者或拒绝手术的患者可考虑行十二指肠镜介入治疗,包括胰管支架植入、胰管括约肌切开+胰管内引流术、胰管内栓子取出术、局部烧灼等方式,降低囊内高压,防止瘤体进一步破裂出血,同时能显著改善患者生活质量,延长生存时间,缓解相应症状。
所有作者均声明不存在利益冲突



























