
研究一组金黄色葡萄球菌临床分离株毒力基因和耐药基因的存在状况。
连续收集浙江省宁波市第一医院2013年7至9月临床分离的金黄色葡萄球菌共40株,采用聚合酶链反应(PCR)的方法分析42种毒力基因和11种耐药基因,再以10类毒力基因和1种耐药基因mecA检测结果作二元分型。
40株金黄色葡萄球对青霉素的敏感率为12.5%(5/40),对红霉素的敏感率为42.5%(17/40),对其余15种抗菌药物的敏感率均大于65.0%。除了人主要组织相容性复合体(MHC)类似蛋白编码基因map未检出,其他几类毒力基因:黏附素、细胞毒素、荚膜抗原、超抗原、丝氨酸蛋白酶均有检出,检出率为2.5%~100.0%。耐β-内酰胺类、氨基糖苷类、红霉素类、四环素类、季铵盐消毒剂、抗菌肽的耐药基因均有检出,检出率为2.5%~37.5%。40株菌株经二元分型可分为16种阳性基因检出模式,每株菌最少检出3类毒力基因,最多检出7类毒力基因和1类耐药基因mecA。
本组菌株耐药表型和耐药基因型符合率较高,菌株携带多种毒力基因和耐药基因。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
金黄色葡萄球菌是人类的重要病原菌。金黄色葡萄球菌菌株因携带各种毒力基因可致感染者各类疾病,从轻度的皮肤、软组织炎症感染,到严重的致死性肺炎、败血症和骨髓炎等。随着抗生素的广泛应用,金黄色葡萄球菌对抗菌药物的耐药性也越来越强。2002年7月,美国就报道了第1株耐万古霉素的金黄色葡萄球菌[1]。在国内,糜祖煌和秦玲[2]较早地调查了100株金黄色葡萄球菌1种毒力基因与8种耐药基因的存在情况并作了分析。为了解金黄色葡萄球菌临床分离株更详尽的毒力基因和耐药基因的存在状况,本研究采用聚合酶链反应(PCR)的方法,对浙江省临床样本中分离的40株金黄色葡萄球菌检测了42种毒力基因和11种耐药基因,并作检测结果的二元分型,现报道如下。
40株金黄色葡萄球菌均分离自浙江省宁波市第一医院2013年7至9月门诊和住院患者的样本,其中18株来源于呼吸道,4株来源于血液,6株来源于皮肤,5株来源于骨髓,4株来源于泌尿道,1株来源于眼部,2株来源于耳部。全部菌株均使用Vitek-2细菌鉴定仪及配套革兰阳性菌鉴定卡GP鉴定菌种,质控菌株为金黄色葡萄球菌ATCC 29213。
全部菌株均使用Vitek-2细菌鉴定仪配套革兰阳性菌药敏卡GP67检测对16种抗菌药物(青霉素、苯唑西林、庆大霉素、环丙沙星、左氧氟沙星、莫西沙星、红霉素、氯洁霉素、利福平、复方磺胺甲噁唑、四环素、万古霉素、利奈唑胺、替加环素、呋喃妥因、奎奴普汀)的敏感性。替考拉宁的敏感性用纸片法检测,MH琼脂和药敏纸片均为英国Oxoid公司产品,质控菌株为金黄色葡萄球菌ATCC 29213。根据美国临床和实验室标准协会(Clinical and Laboratory Standards Institute, CLSI)2013年版[3]要求进行抗菌药物敏感性判断。
挑取纯培养菌落置入0.5 mL离心管内(内预置200 ng/mL蛋白酶K溶液200 μL),56 ℃水浴2 h,改95℃水浴10 min,离心(24 400 ×g)30 s。上清液即为基因检测的模板液,-20℃冰箱保存备用。
42种毒力基因和11种耐药基因检测采用PCR法。靶基因引物识别序列和目的产物长度见表1。各种靶基因PCR扩增体系均为:每反应体系P1引物1 μL(1.0 μmol/L),P2引物1 μL(1.0 μmol/L),dNTPs 2 μL(2 mmol/L),10×缓冲液2 μL[KCl 10 mmol/L,(NH4)2SO4 8 mmol/L,MgCl2 2 mmol/L,Tris-HCl(pH 9.0)10 mmol/L,NP40 0.5%,BSA 0.02%(wt/vol)],Taq DNA pol 1 U(不计体积),超纯水9 μL,模板液5 μL,总反应体积20 μL。PCR扩增热循环参数为:93℃预变性2 min,然后93℃ 30 s,55℃ 30 s,72℃ 60 s,循环35周期,最后一个72℃延长至5 min。产物经2%琼脂糖凝胶电泳,出现与阳性对照分子相当的目的条带为阳性。检测试剂盒和阳性对照DNA由无锡市克隆遗传技术研究所提供。

金黄色葡萄球菌42种毒力基因与11种耐药基因引物序列、产物长度和参考文献
金黄色葡萄球菌42种毒力基因与11种耐药基因引物序列、产物长度和参考文献
| 靶基因 | 引物序列(5'→3') | 产物长度(bp) | 文献 | ||
|---|---|---|---|---|---|
| 黏附素 | |||||
| sasX | P1:AGAATTAGAAGTACGTCTAAATGC | P2:GCTGATTATGTAAATGACTCAAATG | 615 | [4] | |
| fnbA | P1:CACAACCAGCAAATATAG | P2:CTGTGTGGTAATCAATGTC | 1 362 | [5] | |
| clfA | P1:GTAGGTACGTTAATCGGTT | P2:CTCATCAGGTTGTTCAGG | 1 584 | [5] | |
| clfB | P1:TGCAAGATCAAACTGTTCCT | P2:TCGGTCTGTAAATAAAGGTA | 596 | [5] | |
| icaA | P1:GATTATGTAATGTGCTTGGA | P2:ACTACTGCTGCGTTAATAA | 770 | [5] | |
| cna | P1:AGTGGTTACTAATACTG | P2:CAGGATAGATTGGTTTA | 可变 | [5] | |
| bbp | P1:CAGTAAATGTGTCAAAAGA | P2:TACACCCTGTTGAACTG | 1 055 | [5] | |
| ebpS | P1:CAATCGATAGACACAAATTC | P2:CAGTTACATCATCATGTTTA | 526 | [5] | |
| efb/fib | P1:AACATTAGCGGCAATAGG | P2:ATTCGCTCTTGTAAGACC | 432 | [6] | |
| 细胞毒素:溶血素 | |||||
| hla | P1:CTGATTACTATCCAAGAAATTCGATTG | P2:CTTTCCAGCCTACTTTTTTATCAGT | 209 | [7] | |
| hlb | P1:GTGCACTTACTGACAATAGTGC | P2:GTTGATGAGTAGCTACCTTCAGT | 309 | [7] | |
| hld | P1:AAGAATTTTTATCTTAATTAAGGAAGGAGTG | P2:TTAGTGAATTTGTTCACTGTGTCGA | 111 | [7] | |
| hlg | P1:GTCAYAGAGTCCATAATGCATTTAA | P2:CACCAAATGTATAGCCTAAAGTG | 535 | [7] | |
| Hlg-2 | P1:GACATAGAGTCCATAATGCATTYGT | P2:ATAGTCATTAGGATTAGGTTTCACAAAG | 390 | [7] | |
| 细胞毒素:杀白细胞素 | |||||
| pvl | P1:GTGCCAGACAATGAATTACCC | P2:TTCATGAGTTTTCCAGTTCACTTC | 256 | [8] | |
| lukE | P1:TGAAAAAGGTTCAAAGTTGATACGAG | P2:TGTATTCGATAGCAAAAGCAGTGCA | 可变 | [7] | |
| lukM | P1:TGGATGTTACCTATGCAACCTAC | P2:GTTCGTTTCCATATAATGAATCACTAC | 780 | [7] | |
| 细胞毒素:酚溶调制肽 | |||||
| psm-mec | P1:GAAGATCTATCACAAGATGAAATA | P2:ATGGATTTCACTGGTGTTATTACA | 210 | 本研究 | |
| 超抗原:剥脱毒素 | |||||
| eta | P1:ACTGTAGGAGCTAGAGCATTTGT | P2:TGGATACTTTTGTCTATCTTTTTCATCAAC | 190 | [7] | |
| etb | P1:CAGATAAAGAGCTTTATACACACATTAC | P2:AGTGAACTTATCTTTCTATTGAAAAACACTC | 612 | [7] | |
| etd | P1:CGCAAATACATATGAAGAATCTGA | P2:TGTCACCTTGTTGCAAATCTATAG | 452 | [9] | |
| 超抗原:中毒性休克毒素 | |||||
| tst | P1:TTCACTATTTGTAAAAGTGTCAGACCCACT | P2:TACTAATGAATTTTTTTATCGTAAGCCCTT | 180 | [7] | |
| 超抗原:肠毒素 | |||||
| sea | P1:GCAGGGAACAGCTTTAGGC | P2:GTTCTGTAGAAGTATGAAACACG | 520 | [10] | |
| seb | P1:ATGTAATTTTGATATTCGCAGTG | P2:TGCAGGCATCATATCATACCA | 643 | [10] | |
| sec | P1:CCTTGTATGTATGGAGGAATAACAA | P2:TGCAGGCATCATATCATACCA | 283 | [10] | |
| sed | P1:GTGGTGAAATAGATAGGACTGC | P2:ATATGAAGGTGCTCTGTGG | 384 | [10] | |
| see | P1:TACCAATTAACTTGTGGATAGAC | P2:CTCTTTGCACCTTACCGC | 170 | [10] | |
| seg | P1:CGTCTCCACCTGTTGAAGG | P2:CCAAGTGATTGTCTATTGTCG | 327 | [10] | |
| seh | P1:CAACTGCTGATTTAGCTCAG | P2:GTCGAATGAGTAATCTCTAGG | 360 | [10] | |
| sei | P1:CAACTCGAATTTTCAACAGGTAC | P2:CAGGCAGTCCATCTCCTG | 465 | [10] | |
| sej | P1:CATCAGAACTGTTGTTCCGCTAG | P2:CTGAATTTTACCATCAAAGGTAC | 142 | [10] | |
| sek | P1:GGTGTCTCTAATAGTGCCAG | P2:TCGTTAGTAGCTGTGACTCC | 244 | [11] | |
| sel | P1:ATCAATGGCAAGCATCAAACAG | P2:TGGAAGACCGTATCCTGTG | 264 | [11] | |
| sem | P1:CTATTAATCTTTGGGTTAATGGAGAAC | P2:TTCAGTTTCGACAGTTTTGTTGTCAT | 300 | [7] | |
| sen | P1:ATGAGATTGTTCTACATAGCTGCAAT | P2:AACTCTGCTCCCACTGAAC | 680 | [7] | |
| seo | P1:AGTTTGTGTAAGAAGTCAAGTGTAGA | P2:ATCTTTAAATTCAGCAGATATTCCATCTAAC | 180 | [7] | |
| sep | P1:GACCTTGGTTCAAAAGACACC | P2:TGTCTTGACTGAAGGTCTAGC | 275 | [11] | |
| seq | P1:TCTAGCATATGCTGATGTAGG | P2:CAATCTCTTGAGCAGTTACYTC | 383 | [11] | |
| 丝氨酸蛋白酶 | |||||
| ssp | P1:TTGTTCTTCGAAACTT | P2:GGCTTTGGCTTTATTG | 1 550 | [5] | |
| 人MHC类似蛋白 | |||||
| map | P1:TAACATTTAATAAGAATCAA | P2:CCATTTACTGCAATTGT | 可变 | [5] | |
| 荚膜抗原(血清型) | |||||
| cap5 | P1:ATGACGATGAGGATAGCG | P2:CTCGGATAACACCTGTTGC | 881 | [6] | |
| cap8 | P1:ATGACGATGAGGATAGCG | P2:CACCTAACATAAGGCAAG | 1 148 | [6] | |
| 耐药基因 | |||||
| blaZ | P1:AGGAAGAGTATGATTCAACA | P2:CTCGTCGTTTGGTATGGC | 535 | 本研究 | |
| mecA | P1:AAAATCGATGGTAAAGGTTGGC | P2:AGTTCTGCAGTACCGGATTTGC | 535 | [8] | |
| aac6'/aph2″ | P1:CCAAGAGCAATAAGGGCATA | P2:CACTATCATAACCACTACCG | 220 | [8] | |
| aph 3'-Ⅲ | P1:GCCGATGTGGATTGCGAAAA | P2:GCTTGATCCCCAGTAAGTCA | 292 | [8] | |
| ant4' | P1:GCAAGGACCGACAACATTTC | P2:TGGCACAGATGGTCATAACC | 165 | [8] | |
| ermA | P1:AGCGGTAAACCCCTCTGAG | P2:TAGTGACATTTGCATGCTTCAA | 457 | [9] | |
| ermB | P1: GAAAAGGTACTAAACCAAATA | P2:AGTAACGGTACTTAAATTGTTTAC | 616 | [12] | |
| ermC | P1:ACTTGTTGATCACGATAATTTCCA | P2:TCTACTTAATCTGATAAGTGAGCTATTCAC | 321 | [9] | |
| tetM | P1:GTGTGACGAACTTTACCGAA | P2:GCTTTGTATCTCCAAGAACAC | 501 | [8] | |
| qacA | P1:GCTGCATTTATGACATGTTTG | P2:AATCCCACCTACTAAAGCAG | 629 | 本研究 | |
| bsa | P1:ACAGAAGCTGTTAAAACTACCC | P2:GATTAATATGACAATTGAAGTGGGTC | 197 | [11] | |
注:MHC.主要组织相容性复合体
基因检测结果可分为阴性与阳性,为二元数据。本研究对40株菌作42种毒力基因和11种耐药基因检测结果的二元分型。
40株金黄色葡萄球菌对青霉素的敏感率为12.5%,对红霉素的敏感率为42.5%,对其余15种抗菌药物的敏感率均大于65.0%,其中对万古霉素、替考拉宁、利奈唑胺、替加环素、奎奴普汀这5种抗菌药物的敏感率均为100%(表2)。
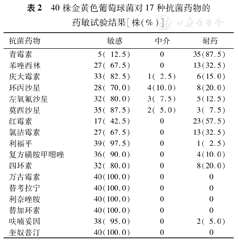
40株金黄色葡萄球菌对17种抗菌药物的药敏试验结果[株(%)]
40株金黄色葡萄球菌对17种抗菌药物的药敏试验结果[株(%)]
| 抗菌药物 | 敏感 | 中介 | 耐药 |
|---|---|---|---|
| 青霉素 | 5( 12.5) | 0 | 35(87.5) |
| 苯唑西林 | 27( 67.5) | 0 | 13(32.5) |
| 庆大霉素 | 33( 82.5) | 1( 2.5) | 6(15.0) |
| 环丙沙星 | 28( 70.0) | 4(10.0) | 8(20.0) |
| 左氧氟沙星 | 32( 80.0) | 3( 7.5) | 5(12.5) |
| 莫西沙星 | 35( 87.5) | 2( 5.0) | 3( 7.5) |
| 红霉素 | 17( 42.5) | 0 | 23(57.5) |
| 氯洁霉素 | 27( 67.5) | 0 | 13(32.5) |
| 利福平 | 39( 97.5) | 0 | 1( 2.5) |
| 复方磺胺甲噁唑 | 36( 90.0) | 0 | 4(10.0) |
| 四环素 | 32( 80.0) | 0 | 8(20.0) |
| 万古霉素 | 40(100.0) | 0 | 0 |
| 替考拉宁 | 40(100.0) | 0 | 0 |
| 利奈唑胺 | 40(100.0) | 0 | 0 |
| 替加环素 | 40(100.0) | 0 | 0 |
| 呋喃妥因 | 38( 95.0) | 0 | 2( 5.0) |
| 奎奴普汀 | 40(100.0) | 0 | 0 |
本组40株金黄色葡萄球菌中,除了人主要组织相容性复合体(MHC)类似蛋白编码基因map未检出,其他几类毒力基因:黏附素、细胞毒素、荚膜抗原、超抗原、丝氨酸蛋白酶均有检出,且检出率大都较高(表3)。耐β-内酰胺类、氨基糖苷类、红霉素类、四环素类、季铵盐消毒剂、抗菌肽的耐药基因均有检出(表4)。
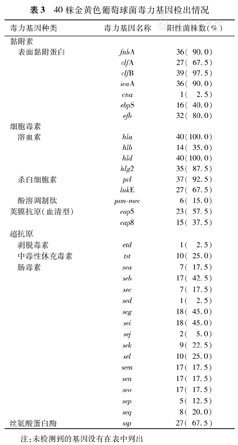
40株金黄色葡萄球菌毒力基因检出情况
40株金黄色葡萄球菌毒力基因检出情况
| 毒力基因种类 | 毒力基因名称 | 阳性菌株数(%) | |
|---|---|---|---|
| 黏附素 | |||
| 表面黏附蛋白 | fnbA | 36( 90.0) | |
| clfA | 27( 67.5) | ||
| clfB | 39( 97.5) | ||
| icaA | 36( 90.0) | ||
| cna | 1( 2.5) | ||
| ebpS | 16( 40.0) | ||
| efb | 32( 80.0) | ||
| 细胞毒素 | |||
| 溶血素 | hla | 40(100.0) | |
| hlb | 14( 35.0) | ||
| hld | 40(100.0) | ||
| hlg2 | 35( 87.5) | ||
| 杀白细胞素 | pvl | 37( 92.5) | |
| lukE | 27( 67.5) | ||
| 酚溶调制肽 | psm-mec | 6( 15.0) | |
| 荚膜抗原(血清型) | cap5 | 23( 57.5) | |
| cap8 | 15( 37.5) | ||
| 超抗原 | |||
| 剥脱毒素 | etd | 1( 2.5) | |
| 中毒性休克毒素 | tst | 10( 25.0) | |
| 肠毒素 | sea | 7( 17.5) | |
| seb | 17( 42.5) | ||
| sec | 7( 17.5) | ||
| sed | 1( 2.5) | ||
| seg | 18( 45.0) | ||
| sei | 18( 45.0) | ||
| sej | 2( 5.0) | ||
| sek | 9( 22.5) | ||
| sel | 10( 25.0) | ||
| sem | 17( 17.5) | ||
| sen | 17( 17.5) | ||
| seo | 17( 17.5) | ||
| sep | 5( 12.5) | ||
| seq | 8( 20.0) | ||
| 丝氨酸蛋白酶 | ssp | 27( 67.5) | |
注:未检测到的基因没有在表中列出

40株金黄色葡萄球菌耐药基因检出情况
40株金黄色葡萄球菌耐药基因检出情况
| 耐药基因种类 | 耐药基因名称 | 阳性菌株数(%) |
|---|---|---|
| 耐β-内酰胺类 | mecA | 13(32.5) |
| 耐氨基糖苷类 | aac(6')/aph(2″) | 6(15.0) |
| aph(3')-Ⅲ | 1( 2.5) | |
| ant(4',4″) | 2( 5.0) | |
| 耐红霉素类 | ermB | 4(10.0) |
| ermC | 15(37.5) | |
| 耐四环素类 | tetM | 1( 2.5) |
| 耐季铵盐消毒剂 | qacA | 1( 2.5) |
| 耐抗菌肽 | bsa | 3( 7.5) |
注:未检测到的基因没有在表中列出
本组菌株共检出33种毒力基因和9种耐药基因。为了避免分型种类的离散度过大,因此简化为:10类毒力基因中每类毒力基因有1种以上阳性则计该类毒力基因阳性;耐药基因只含mecA基因。经基因检测结果的二元分型,40株菌可分为16种阳性基因检出模式,其中9号和39号株检出的毒力基因最少:黏附素+溶血素+杀白细胞素;36号株菌最多检出7类毒力基因和1类耐药基因mecA:黏附素+溶血素+杀白细胞素+酚溶调制肽+cap5+中毒性休克毒素+肠毒素+mecA,见表5。

40株金黄色葡萄球菌毒力基因和耐药基因阳性模式
40株金黄色葡萄球菌毒力基因和耐药基因阳性模式
| 菌株编号 | 阳性基因检出模式 | 株数(%) |
|---|---|---|
| 3,6,7,13,28,29 | 黏附素+溶血素+杀白细胞素+cap8+肠毒素+丝氨酸蛋白酶+mecA | 6(15.0) |
| 1,2,10,23,32 | 黏附素+溶血素+杀白细胞素+酚溶调制肽+cap5+中毒性休克毒素+肠毒素+丝氨酸蛋白酶+mecA | 5(12.5) |
| 12,18,26,34 | 黏附素+溶血素+杀白细胞素+cap5+丝氨酸蛋白酶 | 4(10.0) |
| 21,25,31,38 | 黏附素+溶血素+杀白细胞素+cap8+肠毒素+丝氨酸蛋白酶 | 4(10.0) |
| 33,40,22,27 | 黏附素+溶血素+杀白细胞素+cap5+肠毒素+丝氨酸蛋白酶 | 4(10.0) |
| 11,17,20 | 黏附素+溶血素+杀白细胞素+cap5+肠毒素 | 3(7.5) |
| 8,37 | 黏附素+溶血素+杀白细胞素+cap8 | 2(5.0) |
| 14,16 | 黏附素+溶血素+杀白细胞素+cap8+肠毒素 | 2(5.0) |
| 9,39 | 黏附素+溶血素+杀白细胞素 | 2(5.0) |
| 15,24 | 黏附素+溶血素+杀白细胞素+cap5+中毒性休克毒素+肠毒素+丝氨酸蛋白酶 | 2(5.0) |
| 4 | 黏附素+溶血素+杀白细胞素+cap8+中毒性休克毒素+肠毒素+丝氨酸蛋白酶+mecA | 1(2.5) |
| 5 | 黏附素+溶血素+杀白细胞素+cap5+中毒性休克毒素+肠毒素 | 1(2.5) |
| 19 | 黏附素+溶血素+杀白细胞素+cap5+剥脱毒素+肠毒素 | 1(2.5) |
| 30 | 黏附素+溶血素+cap5+丝氨酸蛋白酶 | 1(2.5) |
| 35 | 黏附素+溶血素+杀白细胞素+cap5 | 1(2.5) |
| 36 | 黏附素+溶血素+杀白细胞素+酚溶调制肽+cap5+中毒性休克毒素+肠毒素+mecA | 1(2.5) |
毒力因子指能帮助病原体侵入并抵抗宿主防御机制,增强病原体引起疾病的物质。目前已在金黄色葡萄球菌中发现了6大类毒力因子:即黏附素,细胞毒素(含溶血素、杀白细胞素、酚溶调制肽),丝氨酸蛋白酶,荚膜抗原,超抗原(含剥脱毒素、中毒性休克毒素、肠毒素),以及人MHC类似蛋白。虽然毒力因子已超过100种,但除了极个别毒力因子有免疫检测方法外,其余均无法用免疫法检测。每种毒力因子均由毒力基因编码。同时,细菌携带各种耐药基因,可对抗菌药物(β-内酰胺类、氨基糖苷类、大环内酯类、喹诺酮类、四环素类、氯霉素、磺胺类、利福平类、糖肽类等)产生耐药性,因而用PCR法检测毒力基因和耐药基因可获得特异、灵敏的结果。
本研究检测了6大类42种毒力基因。黏附素中的表面黏附蛋白是一族细胞表面葡萄球菌黏附素,主要在细菌的定植和侵袭宿主组织的过程中起关键作用[12]。本组细菌毒力基因除了sasX和bbp未检出外,其他7种表面黏附蛋白毒力基因均有检出,且检出率大都较高。细胞毒素可分溶血素、杀白细胞素、酚溶调制肽3种。国外报道α溶血素可导致重症肺炎[13],本研究中hla和hld的检出率为100%。pvl基因表达细胞坏死性毒素,pvl基因阳性的金黄色葡萄球菌可致患者皮肤、软组织炎症、肺炎,甚至致死性肺炎[14]。酚溶调制肽psm-mec最早从医院获得性耐甲氧西林金黄色葡萄球菌(MRSA)中分离到[15],由可移动遗传元件SCCmec携带的psm-mec基因编码。因此本组菌检出psm-mec基因的6株菌株均是mecA阳性,其中5株分离自痰液样本,另1株分离自血液样本。金黄色葡萄球菌荚膜抗原血清型大多为cap5或cap8,本组菌有23株cap5阳性和15株cap8阳性,但有两株菌不携带cap5或cap8,是少见的荚膜抗原血清型。超抗原可分为剥脱毒素、中毒性休克毒素、肠毒素3种。剥脱毒素分为A~D 4个亚型,其中A、B亚型与人类葡萄球菌性烫伤样皮肤综合征发病有关,D亚型与皮肤的深部感染及皮肤脓肿的发生有关[16,17]。19号菌检出剥脱毒素etd,分离自一个昏迷待查的81岁老年女性痰液样本,该患者入院情况危急,治疗2 d后死亡。中毒性休克毒素(toxic shock syndrome toxin 1, TSST-1)可引起机体发热、多器官功能紊乱或中毒性休克综合征,病死率高。本组菌株中携带编码TSST-1的tst基因的10例患者病情都较危重。因此,剥脱毒素和中毒性休克毒素可作为病情危重的指标。金黄色葡萄球菌肠毒素多见于食物中毒和食品污染的报道[18],本研究在多株菌株中都检出肠毒素,其中一株菌最多能检出8种。丝氨酸蛋白酶,又称V8蛋白酶,具有蛋白水解活性,能断裂大分子蛋白质中的肽键,使之成为小分子蛋白质,导致表皮渗透屏障功能障碍[19]。本组金黄色葡萄球菌中,27株ssp基因阳性,阳性率较高。在以上毒力基因中,本组菌株除30号菌株没有检出杀白细胞素,其他菌株都检测到了黏附素、溶血素和杀白细胞素,表明这3大类毒力基因在多种感染性疾病中都存在,无论是轻度的皮肤、软组织炎症感染,还是严重的致死性肺炎、败血症和骨髓炎等。
耐药基因检测中,本组菌株耐β-内酰胺类、氨基糖苷类、红霉素类、四环素类、季铵盐消毒剂、抗菌肽的耐药基因均有检出,其耐药表型和耐药基因型符合率较高。红霉素和四环素的耐药基因检出率略低,可能存在其他耐药机制,如主动外排功能增加、细胞膜通过率下降等。
国内外金黄色葡萄球菌菌株分型的常见方法有脉冲电场凝胶电泳(pulsed field gel electrophoresis, PFGE)、多位点测序分型(multilocus squence typing, MLST)、SCCmec和A蛋白(spa)分型等方法。但PFGE分辨力低,不能区分相似长度的片段,因此只能用于特定医院内短期的流行病学调查,而不能用于地区性、甚至全球性的长期调查[20]。MLST只选用管家基因作为分析的靶基因,没有考虑基因的水平转移,而管家基因过于保守(进化慢),导致MLST分辨率低。SCCmec分型因SCCmec可移动遗传元件不断重组,常出现无法分型[21]。spa分型以单个基因代表整个菌株生物学特征显然不妥。Li等[22]对8家儿童医院2005至2011年分离的299株MRSA进行了PFGE、MLST、SCCmec和spa等分型,但这4种分型方法的结果并不能互为印证。此外,PFGE、MLST、SCCmec和spa等分型方法所检测与分析的基因不是毒力与耐药相关的功能基因,不能为临床医师提供毒力与耐药信息。最近,澳大利亚学者对MRSA菌的分型作了新的尝试,分别提出了毒力基因轮廓法(TGP)、49种探针检测SCCmec部件、噬菌体介导开放读码框(PDORF)等三种多重PCR加反向线性斑点杂交法(mPCR/RLB)分型,其中涉及部分毒力与耐药基因等功能基因[23],与本研究中的二元分型法有"异曲同工"之妙。采用与毒力和耐药相关的功能基因作二元分型可以让临床医师直观地了解从患者样本中分离到菌株的功能基因,以便采取进一步的治疗措施。如本组菌株中5号株(7月30日)和24号株(8月20日)是从同一个骨髓炎患者样本中分离到。经过21 d的治疗,从表5可见,菌株虽然未获得mecA基因,仍为甲氧西林敏感金黄色葡萄球菌(MSSA),但获得了丝氨酸蛋白酶基因ssp。把毒力基因从大类细分到种,24号株还多获得了黏附素clfA、icaA,肠毒素sec,菌株毒力增强。另一个例子是本组菌株中的25号株(8月21日)和31号株(8月31日)。它们是从另一例骨髓炎患者样本中分离到的。经过10 d的治疗,虽然两株菌的基因型均为:黏附素+溶血素+杀白细胞素+cap8+肠毒素+丝氨酸蛋白酶,但把毒力基因从大类细分到种,两株菌的功能基因存在差异:25号菌株携带黏附素ebpS,6种肠毒素sea+seg+sei+sem+sen+seo,以及耐红霉素类基因ermC,而31号菌株携带黏附素efb、肠毒素sep、耐氨基糖苷类基因aac6'/aph2″,提示该例患者可能感染了2种不同的菌株。这二个典型案例体现了功能基因二元分型的优势。
对金黄色葡萄球菌临床分离株同时检测42种毒力基因和11种耐药基因是国内首次报道。尽管只检测了40株菌株,却是国内对金黄色葡萄球菌临床分离株进行毒力与耐药功能基因研究的起步。日后的研究可进一步扩大菌株数,并仔细分析各种毒力基因与各类疾病的关系。



























