近期国内学者对H7N9禽流感病毒的特性,包括病毒起源及多样性、血凝素蛋白及其突变体等进行了深入的研究。该病毒在家禽中为低致病性,但基因突变后不仅易感染人类,且出现高致病性。H7N9禽流感病毒是一种新型基因重配病毒,在家禽中以鹌鹑与鸡体内病毒复制最强。H7N9禽流感病毒对人类的致病机制主要是病毒感染后激发免疫应答,血液中产生过量的细胞因子和趋化因子,出现继发性噬血细胞综合征、多器官功能损害等。此外,H7N9禽流感病毒感染者的预后还与血管紧张素Ⅱ持续升高及与个体遗传(携带rs12252-C/C IFITM3基因型)等因素相关。此文对H7N9禽流感病毒相关研究结果进行了综述,为H7N9禽流感疫情的防控及危重症患者的救治提供参考。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
流感病毒曾在世界各地发生过多次大流行,造成人类或动物的死亡。根据流感病毒感染对象及流感病毒核蛋白的抗原性,可以将其分为甲型(A型)、乙型(B型)与丙型(C型)三类。感染禽类、猪等其他动物的流感病毒,其核蛋白的抗原性与人甲型流感病毒相同,因此将其归入甲型类。流感病毒还可根据血凝素(Hemagglutinin,HA或H)和神经氨酸酶(Neuraminidase,NA或N)的抗原性将其分为多种亚型(H1~18,N1~11),其中H17于2012年从果蝠体内分离到,H18于2013年从秘鲁蝠中发现[1]。
一般而言,不是所有的禽流感病毒都可以引起人类流感。已发现曾感染人类的禽流感病毒有H5N1、H7N2、H9N2、H7N7、H7N3、H5N2及H7N9等。高致病性禽流感病毒H5N1于2003年以来在亚洲地区持续暴发,病死率高达59.7%[2]。2013年初以来,中国上海、安徽、浙江等地首次发现人感染H7N9禽流感散发病例,病死率也相当高(>31%),引起医学界震惊与关注[3,4]。2013年12月初又报道有H10N8亚型病毒从江西一例73岁因呼吸衰竭死亡病例中分离出[A/Jiangxi-Donghu/346/2013(H10N8)][5],提示这种原为低致病性的H10N8禽流感病毒开始感染人类。本文根据近期发表的相关文献,对禽流感H7N9病毒的特性及其对人类致病机制的研究综述如下。
1878年意大利首次报道暴发禽流感,1901年才证实其病原体为RNA病毒,1955年经血清学鉴定为甲型流感病毒,即禽流感病毒。禽流感病毒与人流感病毒在基因上有所区别[1,6]:(1)RNA聚合酶(PB2),禽流感病毒编码的PB2蛋白627位的氨基酸(或残基)为Glu(谷氨酸),而人流感病毒则为Lys(赖氨酸);(2) HA在禽类和人类所识别受体糖蛋白唾液酸类型不同,禽流感病毒为α2-3交联唾液酸受体(禽类肠道及生殖道),而人流感病毒为α2-6交联唾液酸受体(人类呼吸道),猪流感病毒可能对二者都能识别。HA是产生中和抗体的主要抗原,因其抗原结构的改变而出现流行。
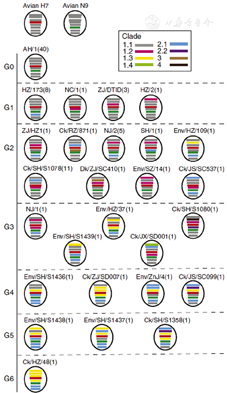
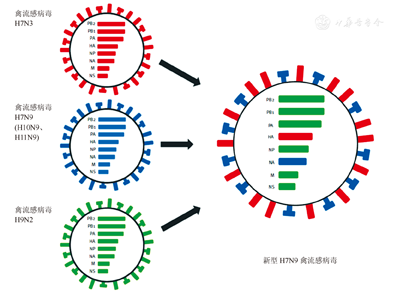
由于种属屏障的存在,大多数禽流感病毒仅在禽类中感染流行并不感染人类,但有些禽流感病毒是人畜共患病毒,在多种不同宿主感染过程中,病毒基因变异或重配产生新亚型而导致人类感染或增强其致病性。H7N9禽流感病毒是2008年从西班牙东北部(泰罗尼亚)的水鸭中首次分离出(A/Anas crecca/Spain/1460/2008)[7,8],后来相继在中欧、北美等地发现,一直以来被认为是低致病性禽流感病毒而未加重视。2013年3至4月初在我国上海、安徽等地区首次发现的人感染H7N9禽流感病毒是一种新型的重配病毒[上海株(A/Shanghai/1/2013)、安徽株(A/Anhui/1/2013)]。我国研究者Liu等[8]使用贝叶斯(Bayesian)进化分析,构建了该病毒基因系统进化树,认为新型H7N9禽流感病毒起源于野鸟和鸡群的多个基因重配(gene reassortment),其中HA基因片段可能源于长江三角鸭群的H7亚型禽流感病毒(ZJ12-H7N3),而NA基因可能源于某些迁徙候鸟(野鸟中KO14-H7N9)。另外6个内部基因与北京一带燕雀所携带的BJ12-H9N2病毒基因高度同源,经分析其基因片段可能来源于两组当地鸡群分离的不同H9N2禽流感病毒,其中1组非结构蛋白(NP)基因来自江苏周边的鸡群,而其他5个片段来自上海、浙江附近的鸡群(图1)[9]。此后,又有研究进一步表明,H7N9病毒NA基因也可能来源于华东地区野鸭中的H11N9病毒,以及鸡群中的H10N9病毒[10,11]。Shi等[12]发现安徽株(AH-H7N9,流行毒株)及上海株(SH-H7N9,个例株)在一级序列上具有各自的独特性,通过固相结合实验和表面等离子共振技术发现二株受体结合特性稍有不同,安徽株既能结合禽源受体,又能结合人源受体,而上海株却偏重于结合禽源受体,提示安徽株可能较易在人群中流行。研究者又解析了二株血凝素蛋白及其突变体与受体类似物的复合体结构(图2)[12],从而阐明了受体结合特性发生改变的结构基础。
在人间流行的禽流感病毒一般认为来自甲型禽流感基因库(Avian influenza A gene pool),库中病毒的8个基因通过相互基因募集(gene recruitment)或发生突变,重配成新的病毒,多数新病毒因其基因不完整(缺失)或不协调存在时间短暂,也有少数以稳定形式长期存在于各种禽类中。其中极少数尚未知的机制突破种属屏障而传播至人类,决定跨种传播的主要是病毒的HA与NA,但病毒的聚合酶上的氨基酸突变也可能起一定作用。真正适应于人类并能在人间传播的新型病毒8个基因必须全部适应人体环境。为达到这一目的,新型病毒必须与真正人类流感病毒(H1N1、H2N2和H3N2)基因交换重配,但这是相当困难的。Cui等[13]对100多株H7N9禽流感病毒的基因信息进行了遗传谱系的分析,并对目前出现的27种病毒基因型绘制出了病毒动态重配(dynamic reassortment)模式(图3)。浙江大学医学院附属第一医院传染病诊治国家重点实验室李兰娟研究团队通过全序列分析发现,H7中的Gln226Leu(谷氨酸→亮氨酸)和Gly186Val(甘氨酸→缬氨酸)发生变异,聚合酶碱性蛋白PB2的Asp701Asn(天冬氨酸→天冬酰胺)也出现变异,使H7N9禽流感病毒容易感染人类,并指出如果又有PB2基因的627和701氨基酸位点同时发生变异,将会发生人际传播的可能,需提高警惕[3]。
新型H7N9禽流感病毒已证明在家禽中携带,Pantin-Jackwood等[14]将A/Anhui/1/2013株病毒106/EID50(半数致死量)量接种于7种家禽(鸡、日本鹌鹑、鸽子、北京鸭、绿头野鸭、疣鼻栖鸭及爱姆登鹅)鼻腔中,结果发现病毒在鹌鹑与鸡体内复制最良好,在其他家禽品种很少复制。实验中又发现鹌鹑更容易传播病毒,但未能证明病毒在鸽子及北京鸭中传播。全部接种禽类均无症状出现,从禽类口咽部样本检出的病毒滴度高于泄殖腔所取样本。此实验研究结果提示,鹌鹑与鸡可能是人感染新型H7N9禽流感病毒的主要来源。
H7N9亚型在家禽中只是一种低致病性禽流感病毒,并不会导致家禽出现症状或死亡。基因测序结果提示,人类家禽或活禽市场环境样品中所分离出的H7N9病毒株相同[15]。但是这种基因重配病毒感染人体后却呈现高致病性。为什么大多数患者肺组织的损害特别迅速且严重,这个问题值得深思。目前研究认为可能有以下几方面原因。
禽流感病毒的致病性主要通过两种表面糖蛋白,即HA与NA,HA的作用是通过与宿主细胞上的唾液酸受体结合而进入细胞,在细胞内复制成病毒颗粒后在NA作用下释出细胞,形成新的感染周期。Gu等[16]已证明H5N1禽流感病毒HA发生Q226L置换(Gln226→Leu)导致了人类高致病性,而新型H7N9病毒在226位点又如何呢?研究证明上海株仍保留了谷氨酰胺,而大多数安徽株均存在着Q226L置换,因此,安徽株可能对人类受体亲和力更强[12]。对这二株病毒的NA进行比较后,发现在其N9关键位点(294氨基酸)上存在差异,即安徽株为精氨酸(R),而上海株为赖氨酸(K),带有K294的N9蛋白病毒复制活性低于带有R294的N9蛋白者,对抗病毒药物(包括oseltamivir、zanamivir、peramivir及laninamivir)更容易产生耐药性[17]。上述研究结果提示新型禽流感病毒具有多态性,感染不同株的病毒其致病力也有所差异。
中国香港研究者利用体外培植的人类呼吸道组织进行研究,认为H7N9病毒比其他禽流感病毒更易感染人体呼吸道,并发现尤其对肺部的Ⅱ型肺泡上皮细胞的损害最为严重,因而造成肺组织再生和修复发生障碍[18]。
一般而言,病毒感染后靶器官的组织损害,往往由于病毒诱导机体免疫应答加重所致。研究者认为禽流感病毒能使感染者血液中浆细胞样的树突细胞(DC)、组织中血管内皮细胞,增殖的上皮细胞、单核细胞、巨噬细胞和CD8+T淋巴细胞等释放出大量的细胞因子,对抗病毒感染起到相应的调节作用。但值得注意的是,过量表达的细胞因子,即所谓"细胞因子风暴"也会介导机体产生严重的免疫病理损伤[17],造成肺部间质炎症和(或)急性呼吸窘迫综合征(ARDS)以及继发性噬血细胞综合征(Secondary hemophagocytic syndrome,sHPS)和(或)多器官功能损害的后果。禽流感病毒可以引发人类致死性的免疫病理损害,这已在H5N1亚型感染发病机制研究中得到证实,也见于H7N9禽流感病毒感染的肺炎患者。
Ng等[19,20]于1993年在阐述"移植物抗宿主病(GVHD)"发生机制一文中首次提出"细胞因子风暴"的概念,直至2005年H5N1禽流感病毒感染人类,造成高病死率才引起医学界对这一发病机制的关注。在人感染H7N9禽流感重症患者发病机制方面,李兰娟研究团队在2013年疫情初期,通过对多例重症H7N9病毒感染病例的监测,发现患者在急性期均存在多种细胞因子显著升高,出现了类似当年SARS患者中存在的"细胞因子风暴"现象,因而首次证实了H7N9病毒感染重症患者的发病机制与细胞因子介导的严重炎性反应有关,并应用人工肝支持系统技术清除细胞因子的抢救措施[14]。研究者发现禽流感病毒能致肺炎患者促炎细胞因子的过度或失控,从而引起患者体液中多种细胞因子如TNF-α、IL-6、IL-8、IL-12,IFN-α、β、γ,干扰素诱导蛋白10(IP-10),单核细胞趋化蛋白-1(MCP-1)等释放显著增加[21,22]。Chi等[23]应用多重微珠免疫试验(Multiplex-microbead immunoassays)检测了H7N9禽流感患者血清样本细胞因子及趋化因子,结果显示IP-10、IL-6、IL-17及IL-2均增加,尤其IL-6与IP-10危重患者比非危重患者增加更为显著。研究认为IP-10是CXC型趋化因子,其水平高低与禽流感病毒性肺炎严重程度的相关性意义更大。动物实验证明:甲型流感病毒感染能激发单核细胞或巨噬细胞分泌IP-10,当IP-10与其受体(CXCR3)相结合,就可诱导T淋巴细胞,NK细胞和血中单核细胞产生各种细胞因子而造成肺部损害[24]。Shen等[25]对比观察了18例H7N9禽流感患者血浆中各种细胞因子,认为IL-6>97 pg/mL和IL-8>40 pg/mL者,其临床结局较差。据Wang等[26]报道,H7N9禽流感病毒感染患者血液中IL-6、IL-8水平比健康人高10倍,IL-10和巨噬细胞炎性蛋白-1β(MIP-1β)水平也增高,在支气管肺泡灌洗样本中细胞因子IL-1β、IL-6和IL-8的浓度也比正常人群高1 000倍,体液中MIP-1α和MIP-β比正常人群高100倍。
Wu等[27]应用流式细胞术对27例H7N9禽流感患者的血清样本进行细胞因子检测,结果显示IL-6、IL-8、IL-10显著增加(与健康对照组比较),而IL-2并无差别。同时发现CD38+或者Tim-3+T淋巴细胞比例明显增加,而HLA-DR+ CD14+与Tim-3+ CD14+单核细胞比例明显减少。大量细胞因子作用在抗原(病毒)载量最高的肺组织上,会引发呼吸窘迫综合征或肺功能衰竭,并浸润各器官而发展为多器官衰竭,而免疫细胞的紊乱与疾病后期继发细菌感染并导致疾病进一步恶化有关。
在一项最新研究中[28],研究者根据临床急性生理、年龄和慢性健康(APACHE)Ⅱ评分将23例H7N9患者分成重症组与轻症组。与轻症组患者相比,重症组患者外周血淋巴细胞减少并伴随T淋巴细胞和单核细胞减少更为常见,重症组患者外周血中HLA-DR在CD14+T淋巴细胞的表达比轻症组患者也明显降低。更为重要的是,HLA-DR在CD14+T淋巴细胞的表达水平与H7N9感染后患者疾病的严重程度呈负相关。此外,虽然轻症组和重症组患者外周血中单核细胞的吞噬能力相似,但重症组患者的单核细胞的抗原提呈能力较低,提示H7N9禽流感患者病情的严重程度可能与抗原提呈能力密切相关。
人感染H7N9病毒后,多数患者可产生特异性的血凝抑制抗体,少部分呈现隐性感染状态。李兰娟研究团队在疫情早期对45例H7N9病毒感染的确诊病例的血凝抑制抗体进行检测,发现H7N9病毒感染的确诊病例具有较高的抗体阳性率(60%)和抗体滴度,且存活病例组的抗体滴度显著高于死亡病例组,提示较高的抗体滴度可能改善H7N9禽流感患者的临床结局。该研究团队还对H7N9禽流感暴发地区的普通人群、职业暴露人群(活禽宰杀人员)进行了流行病学调查,发现在发生疫情附近的活禽市场,活禽宰杀人员的H7N9禽流感病毒血清抗体阳性率高达6.3%,但该类人群咽拭子核酸检测均为阴性,而普通人群中H7N9禽流感病毒的血清抗体均为阴性,提示H7N9病毒感染来源主要是活禽市场,且H7N9病毒在职业暴露人群中有较高的隐性感染率[29]。
众所周知肾素-血管紧张素系统(RAS)在调节血压、水盐平衡及细胞增殖等方面起着极其重要的作用,其中血管紧张素Ⅱ是RAS的主要调节肽,主要功能是通过调节血管紧张度来调节血压和血流量。曾有报道脓毒血症、肺炎、SARS冠状病毒及禽流感病毒感染等引发ARDS的发病机制中存在着RAS的参与。通过实验动物模型研究发现,在急性肺损伤中血管紧张素转化酶(ACE)、血管紧张素Ⅱ(AngⅡ)和血管紧张素Ⅱ1a型受体(AT1aR)会加重肺损伤,而血管紧张素转化酶2(ACE2)和血管紧张素Ⅱ2型受体(AT2R)能保护小鼠免于ARDS的发生[34,35]。
李兰娟研究团队通过检测H7N9禽流感患者外周血血管紧张素Ⅱ的水平发现H7N9禽流感患者中血管紧张素Ⅱ水平显著升高,且血管紧张素Ⅱ的水平与患者的预后密切相关,持续升高的血管紧张素Ⅱ与患者死亡相关[36]。血管紧张素Ⅱ比C-反应蛋白、氧合指数(PaO2/FiO2)更能预测患者的预后。研究表明血管紧张素Ⅱ是H7N9禽流感的生物标志物,对H7N9禽流感患者血管紧张素Ⅱ的检测有助于了解患者的预后[36]。然而,RAS在H7N9禽流感发病机制中的作用仍有待于进一步阐明。
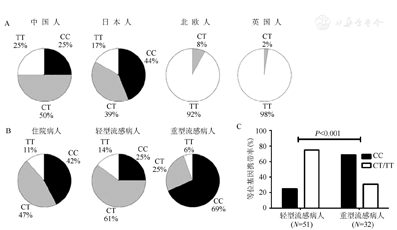
禽流感病毒感染后部分患者临床表现特别严重,迅速进展为中重度ARDS。研究发现发生中重度ARDS的危险因素包括年龄≥65岁,至少存在一种基础疾病,淋巴细胞计数低于1×109/L,天冬氨酸转氨酶水平高于40 U/L,肌酸激酶水平高于200 U/L,以及患者疾病发作到接受奥司他韦或者帕拉米韦治疗的时间大于3 d[37]。研究者尚发现人类对抗甲型流感病毒与个体遗传因素及携带一种特殊蛋白基因IFITM3(IFN-induced transmembrane protein 3,干扰素诱导跨膜蛋白3)表型差异有关,Quiñones-Parra等[38]通过对动物和人类研究提示,具有H7N9禽流感病毒肽呈现的人类白细胞抗原(HLAs)等位基因(占16%~57%),其交叉反应性CD8+T淋巴细胞对再感染会发生强烈应答,且与种族相关。又有Everitt等[39]研究发现少数人群携带一种"IFITM3基因",这种基因具有阻止禽流感病毒体进入到细胞质中,从而抑制病毒复制,当这种基因发生变异(SNP rs12252-C等位基因),可造成严重的病毒性疾病发生。据Zhang等[40]对国内甲型流感(H1N1/09)患者检测结果,发现重型患者中C/C占69%,轻型患者C/C只占25%(图4b,图4c),提示带有IFITM3 C/C变异者比带有T/C、T/T变异者临床症状严重得多,血浆中细胞因子(IL-6、IL-8、MIP-1β等)水平也高,但这种基因变异很少出现在白种人身上,但可频繁地出现在中国汉族人中(图4a)。因此,研究者认为IFITM3表型可作为"基因标志物",建议对禽流感病毒感染者筛查IFITM3表型,可预测其预后,有助于接受更合适治疗。
在动物实验报道中,Zhu等[41]将H7N9病毒株(SH2)感染雪貂和家猪,结果发现病毒可在上、下呼吸道复制。雪貂的气管、肺泡、淋巴结与大脑均能检出病毒RNA,并可在雪貂间接触传播。猪体内病毒复制后可引起轻度炎性症状,但不能在猪间传播。Yu等[42]对6例H7N9病毒感染的死亡患者进行病理学研究,结果提示人感染H7N9禽流感病毒的病理改变在疾病不同时期存在差异,早期患者(起病时间在10 d内)肺部病理学改变为弥漫性肺泡细胞损害基础上合并明显的渗出以及肺泡腔内出血,后期(起病时间大于10 d)则出现明显的肺纤维组织增生;肺外表现则主要是反应性嗜血细胞综合征的表现,包括脾淋巴组织萎缩,骨髓嗜血细胞现象,以及长期缺血缺氧造成的肝脏脂肪变性、肾小管萎缩等非特异性表现。与H5N1感染不同,H7N9病毒感染的死亡患者的肺组织病理学研究中未发现明显的肺部血栓形成,这可能与病理采样的局限性有关,除此之外,所有病理学发现均与H5N1感染高度一致。从临床表现看,Gao等[37]对111例H7N9禽流感住院患者临床分析发现,大多出现较严重的呼吸道症状进而发展为肺炎或重症肺炎,出现ARDS、感染性休克、多脏器功能障碍综合征、心脏横纹肌溶解和脑病变等。种种迹象表明,H7N9感染临床特征与以往H5N1禽流感和甲型H1N1流感有类似之处。重型禽流感患者,除了引起原发性肺部感染外,还可间接累及或直接侵犯心脏、血管、骨骼肌、肝脏和肾脏等多个脏器组织。双肺组织弥漫性充血和水肿,透明膜形成,切面暗红色、坚实,呈囊性、灶性和出血性实变,肺泡腔内充满淡红粉染物(即水肿液)和不等量的各种炎性细胞,以淋巴细胞、单核细胞、浆细胞和少许中性粒细胞以及吞噬细胞为主,并伴有间质纤维化[22,43,44]。我国香港2例尸检显示呈反应性(继发性)噬血细胞综合征主要征象[30],即体内多处淋巴结髓腔扩大、灶性坏死并伴噬红细胞现象,脾肿大伴白髓萎缩。各组织细胞可见大量铁颗粒沉织。另外还有广泛肝小叶中心坏死及急性肾小管坏死。
H7N9病毒亚型在家禽中只是一种低致病性禽流感病毒,但发生病毒基因突变后而感染人类,却出现高致病性,其机制目前尚未完全阐明。我国科学家对H7N9禽流感病毒的溯源、跨宿主传播、家禽物种中的传染源、免疫病理及临床救治等方面都有了新的突破,尤其对以肺部为主的多系统损害的发病机制正逐渐被认识[3]。我国科学家也第一次尝试在疾病快速进展,并且检测到细胞因子风暴的H7N9禽流感重症患者中,使用人工肝支持系统清除细胞因子[3]。但由于禽流感病毒在不断变异,其致病性、感染能力、与受体结合能力、对靶器官破坏能力及与免疫系统的互动等方面可能处于动态演变过程中,因此,加强对这类新发传染病的病原学特性及对人类致病性的研究仍至关重要,这将会对疾病的防治有重要指导意义。