
对临床分离的耐碳青霉烯类肺炎克雷伯菌(Carbapenem resistant Klebsiella pneumoniae, CRKP)的耐药机制及毒力特点进行分析。
连续收集2014年5月至2015年5月天津医科大学总医院临床分离的非重复CRKP 20株,采用Vitek 2 Compact系统对菌株进行鉴定及药敏试验,采用改良Hodge试验、乙二胺四乙酸(EDTA)双纸片试验进行耐药表型筛查,采用PCR方法、基因测序检测耐药基因、荚膜血清型及毒力基因。
20株CRKP对头孢菌素类、碳青霉烯类等β-内酰胺类抗菌药物耐药率较高,均≥80.0%,对替加环素、阿米卡星及左氧氟沙星敏感,敏感率≥70.0%。检出碳青霉烯酶KPC和NDM基因,分别为7株(35.0%)和8株(40.0%),超广谱β-内酰胺酶(ESBLs)以SHV基因检出率最高,为16株(80.0%),DHA质粒介导的产AmpC酶基因检出2株(10.0%)。8株(40.0%)和13株(65.0%)分别存在膜孔蛋白编码基因OmpK35和OmpK36缺失。耐药基因组合方式以携带碳青霉烯酶,同时携带ESBLs和/或合并膜孔蛋白变异为主,占70%(14/20);其次是携带ESBLs和/或合并膜孔蛋白变异,占30.0%(4/20)。检出荚膜血清K1型3株、K57型1株,4株均为产KPC基因菌株。rmpA基因阳性8株(40.0%),均产碳青霉烯酶,其中5株产KPC,2株产NDM,1株同时产KPC和NDM基因。aerobactin基因阳性6株(30.0%),4株产KPC基因。FimH-1基因20株(100.0%)均阳性。
天津医科大学总医院临床分离的CRKP主要耐药机制是携带KPC和NDM基因,ESBLs合并膜孔蛋白缺失也是导致耐药的重要原因,且产KPC基因的荚膜血清型菌株分离率较高,应引起临床重视。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肺炎克雷伯菌是引起医院和社区感染的重要条件致病菌,近年来随着碳青霉烯类抗菌药物的广泛使用,碳青霉烯类耐药肺炎克雷伯菌(Carbapenem resistant Klebsiella pneumoniae,CRKP)逐渐增多,并出现播散现象,给临床治疗和感染控制带来极大挑战。20世纪80年代,中国台湾学者首次报道了无肝胆病史患者发生了肺炎克雷伯菌性肝脓肿,并出现转移感染,由于这种肺炎克雷伯菌的生物学特征及临床致病能力与普通肺炎克雷伯菌相比具有某些差异,因此定义为高毒力肺炎克雷伯菌(Hypervirulent klebsiella pneumoniae,hvKP)[1]。hvKP毒力的增强主要与荚膜多糖、铁摄取系统及重要的毒力基因有关,肺炎克雷伯菌至少有78个荚膜血清型,其中K1、K2型被认为是毒力最强的荚膜血清型,是毒力的决定元素[2]。
CRKP菌株主要见于医院获得性感染,hvKP菌株主要见于社区获得性感染,两者以较快的速度增长,是严重威胁患者健康的两大发展趋势[3]。hvKP耐药情况较好,绝大多数只对氨苄西林天然耐药,但获得性耐药比例呈增长趋势[4]。目前对多重耐药的hvKP研究有限,尤其是碳青霉烯耐药的hvKP。有研究显示,碳青霉烯酶KPC基因可转入K2荚膜型肺炎克雷伯菌中,转入后的菌株对碳青霉烯类药物耐药[5],KPC基因位于质粒上,若发生播散,高耐药且高毒力的菌株可能又是一种难治的新型超级细菌。目前治疗CRKP感染的抗菌药物选择有限,多黏菌素具有肾毒性,替加环素目前没有被推荐用于血流感染,寻找抗荚膜的抗体治疗方式可能是一个新出路[6]。因此为了解天津医科大学总医院临床分离的20株CRKP菌株耐药机制和毒力情况,我们进行如下研究。
分离自2014年5月至2015年5月天津医科大学总医院碳青霉烯类抗菌药物(亚胺培南、美罗培南、厄他培南其中之一)耐药的肺炎克雷伯菌20株,剔除同一患者同一部位重复样本。男性12例(其中2例分别从2个和3个不同部位分离到菌株)、女性5例。3例为新生儿,14例为中老年人。样本类型:痰液9份,血液2份,导管2份,中段尿2份,肺泡灌洗液1份,伤口分泌物1份,胆汁1份,咽拭子和肛周拭子各1份。质控菌株:肺炎克雷伯菌ATCC BAA 1705(产KPC基因),肺炎克雷伯菌ATCC BAA 1706(不产KPC基因)。产IMP-1型金属酶的肺炎克雷伯菌为本实验室保存菌株。
Vitek 2 Compact全自动细菌鉴定仪、配套药敏卡AST-GN16及细菌浊度仪为法国生物梅里埃公司产品,美罗培南纸片(10 μg)、亚胺培南纸片(10 μg)、头孢哌酮/舒巴坦纸片(75/30 μg)购于英国Oxoid公司,替加环素最低抑菌浓度(MIC)Test Strip试条为意大利Liofilchem公司产品;Easy Taq酶、10×Buffer、dNTP、DNA Marker为北京全式金生物技术有限公司产品,引物购于上海生工生物工程技术服务有限公司,9700型PCR仪为美国Perkin Elmer公司产品,水平电泳仪购自北京六一仪器厂,Gel Doc XR+凝胶成像仪购自美国Bio Rad公司。
Vitek 2 Compact系统及配套药敏卡AST-GN16及对细菌鉴定及药敏试验,仪器自动回报MIC结果,结果判读参照美国临床实验室标准化协会(CLSI)2014年标准[7]。替加环素采用MIC Test Strip(MTS)法复核,美罗培南、头孢哌酮/舒巴坦药敏采用纸片法检测,碳青霉烯类药物的敏感性采用纸片法复核。目前CLSI尚无肠杆菌科细菌对头孢哌酮/舒巴坦及替加环素判读标准,故头孢哌酮/舒巴坦采用头孢哌酮折点,替加环素参照美国食品药品监督局(FDA)判定折点[8]。
参照CLSI 2014版[7]相关方法进行。配制0.5麦氏浊度大肠埃希菌ATCC 25922菌悬液,1∶10稀释后,均匀涂布于MH平板上。平板干燥3~5 min后,于平板中央贴美罗培南纸片,10 μL接种环挑取血琼脂平板上过夜生长的3~5个纯菌落,从纸片外缘向平板外缘垂直画线。35℃孵育16~18 h后观察结果,若待测菌株与大肠埃希菌株ATCC 25922抑菌圈交界处出现向内的增强性生长,则为产碳青霉烯酶菌株。ATCC BAA 1705为阳性对照,ATCC BAA 1706为阴性对照。
配制0.5麦氏浊度的待测菌株,均匀涂布于M-H平板,平板上贴两张亚胺培南纸片,两张纸片相距30~40 mm,其中一张加0.5 mol/L EDTA溶液5 μL,35℃孵育18~24 h后观察结果。当两张纸片的抑菌环大小相差≥5 mm时,结果为阳性。
检测常见的碳青霉烯酶基因:KPC、IMP、VIM、NDM、SIM和OXA-48;超广谱β-内酰胺酶(EBSLs)基因:TEM、SHV和CTX-M;质粒介导的AmpC酶基因:DHA;2种膜孔蛋白编码基因:OmpK35和OmpK36;6种荚膜血清型:K1、K2、K5、K20、K54和K57;3种毒力基因:rmpA、aerobaction和FimH-1。细菌总DNA模板制备采用煮沸法。25 μL反应体系:10×buffer 2.5 μL,200 μmol/L dNTP 2 μL,Taq DNA聚合酶2.5U,模板0.5 μL,10 μmol/L的上下游引物各0.5μL,灭菌双蒸水补足体积。KPC、VIM、NDM、SIM、TEM、SHV、DHA、OmpK35和OmpK36引物序列合成及扩增条件参照文献[9]。IMP、CTX-M、OXA-48引物序列合成及扩增条件参照文献[10, 11]。K1、K2、K5、K20、K54、K57、rmpA、aerobactin和FimH-1引物合成及扩增条件参照文献[12, 13, 14]。扩增完毕后,取5 μL PCR产物与1 μL上样缓冲液混匀后于含溴化乙锭的1.5%琼脂糖上电泳,电泳参数:电压100 V,电流20 mA,电泳时间30 min。电泳结束后凝胶置于Gel Doc XR+凝胶成像仪中进行摄像,并保存图片。与标准条带相比,在预期位置出现的条带为阳性条带。每种基因阳性条带挑取1株菌株,将PCR扩增产物委托上海生工生物工程技术服务有限公司进行纯化并测序,测序结果提交到GenBank在线数据库比对工具BLASTn进行比对。
20株CRKP对头孢菌素类、碳青霉烯类、氨曲南及阿莫西林/克拉维酸等含酶抑制剂耐药率较高,均≥80.0%,对庆大霉素和复方磺胺甲噁唑的耐药率也较高,为65.0%,对替加环素、阿米卡星、左氧氟沙星和环丙沙星敏感率较好,分别为90.0%、85.0%、70.0%和65.0%(表1)。
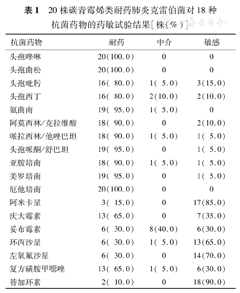
20株碳青霉烯类耐药肺炎克雷伯菌对18种抗菌药物的药敏试验结果[株(%)]
20株碳青霉烯类耐药肺炎克雷伯菌对18种抗菌药物的药敏试验结果[株(%)]
| 抗菌药物 | 耐药 | 中介 | 敏感 |
|---|---|---|---|
| 头孢唑啉 | 20(100.0) | 0 | 0 |
| 头孢曲松 | 20(100.0) | 0 | 0 |
| 头孢吡肟 | 16( 80.0) | 1( 5.0) | 3(15.0) |
| 头孢西丁 | 16( 80.0) | 2(10.0) | 2(10.0) |
| 氨曲南 | 19( 95.0) | 1( 5.0) | 0 |
| 阿莫西林/克拉维酸 | 18( 90.0) | 0 | 2(10.0) |
| 哌拉西林/他唑巴坦 | 18( 90.0) | 1( 5.0) | 1( 5.0) |
| 头孢哌酮/舒巴坦 | 19( 95.0) | 0 | 1( 5.0) |
| 亚胺培南 | 18( 90.0) | 1( 5.0) | 1( 5.0) |
| 美罗培南 | 19( 95.0) | 0 | 1( 5.0) |
| 厄他培南 | 20(100.0) | 0 | 0 |
| 阿米卡星 | 3( 15.0) | 0 | 17(85.0) |
| 庆大霉素 | 13( 65.0) | 0 | 7(35.0) |
| 妥布霉素 | 6( 30.0) | 8(40.0) | 6(30.0) |
| 环丙沙星 | 6( 30.0) | 1( 5.0) | 13(65.0) |
| 左氧氟沙星 | 6( 30.0) | 0 | 14(70.0) |
| 复方磺胺甲噁唑 | 13( 65.0) | 1( 5.0) | 6(30.0) |
| 替加环素 | 2( 10.0) | 0 | 18(90.0) |
改良Hodge试验检测到产碳青霉烯酶菌株11株(55.0%);EDTA双纸片试验检测到产金属酶表型13株(65.0%)。Hodge试验和EDTA试验同时阳性9株(45.0%)。
PCR产物电泳结果见图1。测序比对结果为:KPC-2、NDM-1、SHV-12、TEM-1、CTX-M-15、DHA-1、OmpK35、OmpK36比对同源性均≥99.0%,登录号分别为KR108243.1、CP009115.1、KF585138.1、KM052218.1、KP317182.1、AY635140.1、GU945359.1和JX310551.1。
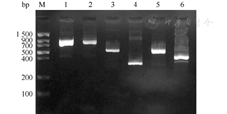

注:M.标准带;1.KPC(882 bp) ;2.NDM(813 bp);3.TEM(536 bp);4.SHV(305 bp);5.CTX-M(544 bp);6.DHA(405 bp)
20株碳青霉烯类耐药肺炎克雷伯菌常见耐药基因及膜孔蛋白编码基因缺失情况见表2。20株CRKP中14株(70.0%)携带碳青霉烯酶基因(序号1~10),其中7株菌同时携带ESBLs基因合并膜孔蛋白编码基因缺失,2株携带ESBLs基因及AmpC酶,3株合并膜孔蛋白编码基因缺失,2株携带ESBLs基因;不产碳青霉烯酶的CRKP 6株(序号11~14),2株携带ESBLs基因合并膜孔蛋白缺失;4株仅携带ESBLs基因。同时发现,当OmpK35膜孔蛋白编码基因缺失时,则OmpK36编码基因也缺失。耐药基因组合方式见表3。
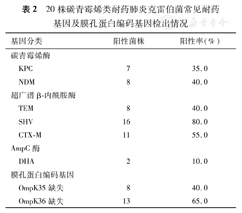
20株碳青霉烯类耐药肺炎克雷伯菌常见耐药基因及膜孔蛋白编码基因检出情况
20株碳青霉烯类耐药肺炎克雷伯菌常见耐药基因及膜孔蛋白编码基因检出情况
| 基因分类 | 阳性菌株 | 阳性率(%) | |
|---|---|---|---|
| 碳青霉烯酶 | |||
| KPC | 7 | 35.0 | |
| NDM | 8 | 40.0 | |
| 超广谱β-内酰胺酶 | |||
| TEM | 8 | 40.0 | |
| SHV | 16 | 80.0 | |
| CTX-M | 11 | 55.0 | |
| AmpC酶 | |||
| DHA | 2 | 10.0 | |
| 膜孔蛋白编码基因 | |||
| OmpK35缺失 | 8 | 40.0 | |
| OmpK36缺失 | 13 | 65.0 | |
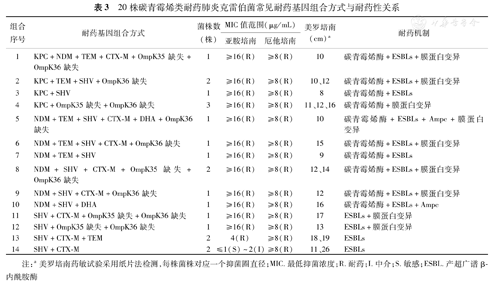
20株碳青霉烯类耐药肺炎克雷伯菌常见耐药基因组合方式与耐药性关系
20株碳青霉烯类耐药肺炎克雷伯菌常见耐药基因组合方式与耐药性关系
| 组合序号 | 耐药基因组合方式 | 菌株数(株) | MIC值范围(μg/mL) | 美罗培南(cm)a | 耐药机制 | |
|---|---|---|---|---|---|---|
| 亚胺培南 | 厄他培南 | |||||
| 1 | KPC+NDM+TEM+CTX-M+OmpK35缺失+OmpK36缺失 | 1 | ≥16(R) | ≥8(R) | 10 | 碳青霉烯酶+ESBLs+膜蛋白变异 |
| 2 | KPC+TEM+SHV+OmpK36缺失 | 2 | ≥16(R) | ≥8(R) | 10、12 | 碳青霉烯酶+ESBLs+膜蛋白变异 |
| 3 | KPC+SHV | 1 | ≥16(R) | ≥8(R) | 8 | 碳青霉烯酶+ESBLs |
| 4 | KPC+OmpK35缺失+OmpK36缺失 | 3 | ≥16(R) | ≥8(R) | 11、12、16 | 碳青霉烯酶+膜蛋白变异 |
| 5 | NDM+TEM+SHV+CTX-M+DHA+OmpK36缺失 | 1 | ≥16(R) | ≥8(R) | 10 | 碳青霉烯酶+ESBLs+Ampc+膜蛋白变异 |
| 6 | NDM+TEM+SHV+CTX-M+OmpK36缺失 | 1 | ≥16(R) | ≥8(R) | 15 | 碳青霉烯酶+ESBLs+膜蛋白变异 |
| 7 | NDM+TEM+SHV | 1 | ≥16(R) | ≥8(R) | 9 | 碳青霉烯酶+ESBLs |
| 8 | NDM+SHV+CTX-M+OmpK35缺失+OmpK36缺失 | 2 | ≥16(R) | ≥8(R) | 12、14 | 碳青霉烯酶+ESBLs+膜蛋白变异 |
| 9 | NDM+SHV+CTX-M+OmpK36缺失 | 1 | ≥16(R) | ≥8(R) | 12 | 碳青霉烯酶+ESBLs+膜蛋白变异 |
| 10 | NDM+SHV+DHA | 1 | ≥16(R) | ≥8(R) | 16 | 碳青霉烯酶+ESBLs+Ampc |
| 11 | SHV+CTX-M+OmpK35缺失+OmpK36缺失 | 1 | ≥16(R) | ≥8(R) | 17 | ESBLs+膜蛋白变异 |
| 12 | SHV+OmpK35缺失+OmpK36缺失 | 1 | ≥16(R) | ≥8(R) | 13 | ESBLs+膜蛋白变异 |
| 13 | SHV+CTX-M+TEM | 2 | 4(R) | ≥8(R) | 18、19 | ESBLs |
| 14 | SHV+CTX-M | 2 | ≤1(S)~2(I) | ≥8(R) | 11、26 | ESBLs |
注:a美罗培南药敏试验采用纸片法检测,每株菌株对应一个抑菌圈直径;MIC.最低抑菌浓度;R.耐药;I.中介;S.敏感;ESBL.产超广谱β-内酰胺酶
20株CRKP中,14株产碳青霉烯酶菌株对亚胺培南、美罗培南和厄他培南完全耐药;2株产EBSLs合并OmpK35/OmpK36外膜孔蛋白编码基因缺失时,对上述3种碳青霉烯类抗菌药物耐药;另有2株携带SHV、TEM和CTX-M基因,改良Hodge试验、EDTA双纸片试验均阴性,但对3种碳青霉烯类抗菌药物耐药;仅2株产SHV和CTX-M菌株,碳青霉烯酶表型试验均阴性,其中1株对亚胺培南中介,对美罗培南、厄他培南耐药,另1株对亚胺培南和美罗培南敏感,厄他培南耐药。
对20株CRKP进行荚膜分型显示,K1血清型3株、K57血清型1株,未检出K2、K5、K20和K54血清型,其他尚未分型16株。rmpA阳性8株(40.0%),aerobactin阳性6株(30.0%),且rmpA和aerobactin同时阳性5株(25.0%),FimH-1阳性20株(100.0%)。PCR产物电泳结果见图2。测序比对结果为:K1、K57血清型比对同源性及登录号分别为99.0%(ABB355924.1)和96.0%(AB334776.1),rmpA、aerobactin和FimH-1同源性及登录号分别为98.0%(KJ481794.1)、100.0%(KJ481793.1)和100.0%(FJ483594.1)。
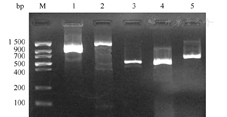

注:M.标准带;1.K57(1 037 bp); 2.K1(1 283 bp); 3.rmpA(536 bp); 4.aerobaction(556 bp); 5.FimH-1(688 bp)
本研究中检出K1荚膜型3株,均携带rmpA基因,2株携带aerobactin基因,其中2株产KPC基因合并膜孔蛋白编码基因缺失(序号4),另1株为携带产KPC基因、ESBLs基因合并OmpK36缺失(序号2)。K57荚膜型1株,携带KPC、NDM、ESBLs基因及OmpK35、OmpK36缺失(序号1)。8株携带rmpA基因的菌株均产碳青霉烯酶(5株产KPC、2株产NDM、1株同时产KPC和NDM基因)合并膜孔蛋白变异,其中5株同时携带ESBLs;6株携带aerobactin基因的菌株,5株产碳青霉烯酶(4株产KPC、1株产NDM基因)合并膜孔蛋白变异,其中2株同时携带ESBLs,另1株不产碳青霉烯酶仅携带ESBLs基因。
碳青霉烯类抗菌药物是治疗多重耐药菌的有效药物,然而近年来碳青霉烯类药物耐药肠杆菌科细菌逐年增多,尤以肺炎克雷伯菌为主,其传播速度较快,致死率较高,给全世界敲响警钟。大量研究表明[15,16,17],肺炎克雷伯菌对碳青霉烯类抗菌药物耐药的主要机制有:(1)携带各种碳青霉烯酶;(2)产ESBLs或AmpC酶合并外膜孔蛋白变异;(3)外排泵作用;(4)药物作用靶位改变。目前国内主要流行的碳青霉烯酶是KPC基因,NDM基因自2009年发现以来,已在短期内造成全世界范围流行传播[18],在我国多个地区也检出产NDM菌株,以大肠埃希菌和肺炎克雷伯菌为主。本研究中检出14株(70%)产碳青霉烯酶菌株,因此产碳青霉烯酶是本院肺炎克雷伯菌株耐药的重要原因。
肺炎克雷伯菌产ESBLs和(或)AmpC酶并伴随膜孔蛋白编码基因变异时,将导致对厄他培南耐药,并使美罗培南和亚胺培南的MIC值升高,是另一个重要耐药机制[19],这类菌株在某些地区出现了暴发流行[20],不可被忽视。本研究发现2株产ESBLs合并膜孔蛋白编码基因缺失的菌株(序号11、12)对碳青霉烯类药物耐药,同时发现OmpK36膜孔蛋白编码基因缺失率较OmpK35高,并且当OmpK35缺失时,OmpK36也缺失,推测OmpK36在菌株对碳青霉烯类药物耐药中可能具有更重要的作用[21]。另外检出4株产ESBLs但不伴有膜孔蛋白缺失菌株,碳青霉烯酶表型试验阴性,对亚胺培南的MIC值下降,厄他培南耐药,可能是ESBLs对碳青霉烯类抗菌药物的水解活性较弱,由于没有对OmpK35和OmpK36膜孔蛋白进行蛋白定量检测,也可能忽略了膜孔蛋白表达减少的菌株。
K1、K2和K5荚膜型及黏液调控因子rmpA、需氧菌素aerobactin等毒力基因的表达与肺炎克雷伯菌的毒力密切相关,特别是荚膜多糖被认为是最重要的毒力决定元素[22]。现在多重耐药肺炎克雷伯菌荚膜分布仍不太清楚,Ramos等[23]鼓励全球范围对产KPC基因菌株进行荚膜分型。Pan等[24]对85例CRKP荚膜分型,并未发现高毒力荚膜血清型K1。张嵘等[25]在2014年分离到1株携带KPC基因的K1荚膜血清型CRKP。本试验却分离到3株产KPC酶基因的K1型菌株,分离率较高,均携带rmpA基因,2株携带aerobactin基因。另外检出产KPC酶基因的K57型1株,rmpA阳性。rmpA与荚膜合成调控有关,普遍认为与化脓性肝脓肿的发生有一定关系,aerobactin是hvKP中最主要的铁载体细胞,它使hvKP较普通肺炎克雷伯菌的载铁活性强6~10倍[26]。本研究同时携带rmpA和aerobactin基因有5株,这两种基因是除荚膜型以外最常见的毒力决定元素[3]。FimH-1编码1型菌毛,存在于所有菌株中,与大多数的研究一致,是一种普遍存在的特性,有利于细菌粘附,与生物被膜相关的感染有一定关系[14]。
越来越多的研究在CRKP菌株中检出产KPC基因的高毒力荚膜血清型菌株[3,27,28]。本研究从20株CRKP中检出产KPC基因7株,产KPC基因的高毒力荚膜血清型菌株4株,3株K1型,1株K57型。高毒力菌株与抗菌药物耐药存在一定的关系[4],有研究表明[29],K1-hvKP能够获取携带KPC基因的质粒或者是携带KPC基因的可移动元件插入毒力质粒中,使其成为高毒力、高耐药、高传播的菌株。另外产碳青霉烯酶菌株毒力因子rmpA和aerobactin的检出率较非产碳青霉烯酶菌株高,8株携带rmpA基因菌株均伴有膜孔蛋白变异,膜孔蛋白是物质交换的通道,若发生变异是否可使高毒力菌株成为"感受态细胞",利于接纳外来DNA,如KPC基因,有待进一步证实。Fuursted等[30]对1株产NDM-1的肺炎克雷伯菌毒力进行研究,发现其在小鼠感染模型中毒力较其他菌株强,毒力与多重耐药共存可能是其导致流行传播的原因。本次研究中,未发现K1、K2型产NDM-1基因的肺炎克雷伯菌。
综上所述,碳青霉烯耐药肺炎克雷伯菌多种耐药机制并存是我院菌株耐药的特点。本研究中检出产KPC基因的K1荚膜型菌株3株,均携带毒力因子rmpA,2株携带aerobactin基因,目前从CRKP菌株中检出高毒力菌株的报道仍较少,但KPC基因较高的耐药性、传播性和高毒力菌株较强的毒力应引起感染控制的高度重视,以防此类菌株播散给治疗带来更大的困难。
利益冲突 无



























