寨卡病毒于1947年首次在乌干达森林中一只罗猴体内分离出而命名。1954年尼日利亚首先证实了人类感染寨卡病毒,但发病率很低。自2014年在西半球发现寨卡病毒感染病例后,2015年4月以来该病毒迅速扩散至美洲、加勒比地区及太平洋岛国共30多个国家,将近400万病例,引起全世界的不安。虽然寨卡病毒病的临床表现较轻,绝大多数为自限性,但是该病毒对宿主具有较强的嗜神经性。早期妊娠妇女感染后,病毒会通过胎盘传染给胎儿,造成胎儿大脑发育障碍,出现小头畸形症及眼底黄斑区视神经异常。少数感染者可能出现吉兰-巴雷综合征。寨卡病毒主要通过伊蚊叮咬传播,目前尚无该病毒疫苗,预防工作存在一定难度。该文对寨卡病毒感染人类的最近研究进展,包括病毒特性、流行概况及临床表现等作了重点阐述。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
据报道,全世界已发现534余种虫媒病毒,其中134余种可以引起人畜共患病[1]。目前,主要以蚊或蜱为传播媒介的病毒感染仍然在世界各地流行与散发。寨卡病毒于1947年首次在乌干达恩德培(Entebbe)附近森林的罗猴体内分离到。1948年初,研究人员又从当地非洲伊蚊体内分离出此病毒并证明伊蚊为其传播媒介。后调查发现,该病毒在非洲和亚洲南部的一些国家和地区的森林动物(特别是猴子)中广泛流行[2]。人感染寨卡病毒之前主要见于非洲和东南亚地区,但自2013年起,寨卡病毒感染在非洲和亚洲以外的多国开始流行,造成多起人类感染疫情,特别是有报道显示孕妇感染该病毒可导致新生儿小头畸形症,因此受到医学界的广泛关注。由于寨卡病毒感染人类的研究资料之前较少,本文对该病毒的结构与特性、流行概况及对人类的危害等方面进行重点综述,仅供参考。
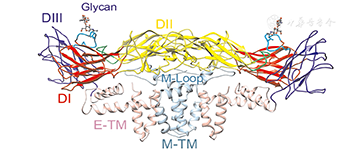
寨卡病毒属黄病毒科(Flavividae)家族,为斯庞德温尼病毒(Spondweni virus)分枝体的一种,与乙型脑炎病毒、登革病毒及西尼罗病毒等为近亲。寨卡病毒为有包膜病毒,呈球形,直径为40~70 nm,表面蛋白排列呈对称二十面体,内含单股正链RNA,长度约10.8 kb,包含10 794个核苷酸,编码3 419个氨基酸。寨卡病毒基因组含59与39未能翻译的片段,其侧面编码多聚蛋白(Polyprotein)的1个开放读码框(ORF),有3种结构蛋白,即衣壳蛋白(C)、前膜/膜蛋白(proM/M)和包膜蛋白(E)及7种非结构蛋白(NS1、NS2A、NS2B、NS3、NS4A、2K、NS4B和NS5)。其中,包膜蛋白是重要的抗原成分,含有中和抗原表位和型特异性抗原表位,决定了病毒对细胞亲嗜性和毒力,与病毒的吸附、穿入及致病等作用相关[2,3,4]。2016年3月31日Science报道,美国研究者通过3.8Å分辨率冷冻电镜(Cryo-EM)技术鉴定出寨卡病毒的结构(图1、图2)[5],并发现其外壳E蛋白中只有一个糖基化位点(Asn154)而登革病毒有二个糖基化位点(Asn67与Asn153);而且观察到与其他黄病毒存在结构区的差异,即寨卡病毒糖基化位点(Asn154)从病毒表面上延伸出来,使病毒更容易被人类细胞受体识别并与其结合。这一独特结构的发现,对解释寨卡病毒病的传播方式,提供诊断、治疗药物靶向及疫苗研制等均有一定的帮助。
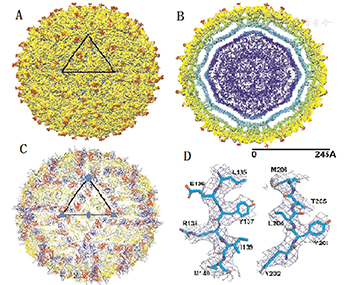

注:A.二十面体二重对称轴视图下呈现出表面阴影立体感的寨卡病毒,黑三角标记为不对称区;B.病毒体横切面显示放射状密度分布;C.病毒表面二十面体E蛋白和M蛋白的α-碳原子骨架显示出人字形的结构;D.典型的E蛋白的若干氨基酸在冷冻电镜下电子密度
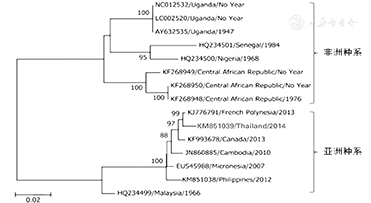
目前在基因库中登记的病毒株(非洲8株,亚洲7株)的亲缘关系见图3[2],最近巴西流行的毒株为亚洲种系。
动物实验提示[6],2周龄以下小鼠对腹腔接种寨卡病毒敏感,并证明其高度嗜神经性,可使脑组织广泛出现病变,细胞浸润和软化,并可发现Cowdry A型包涵体。棉鼠、豚鼠和家兔脑内接种小鼠病毒后,不出现症状。猴子皮下接种小鼠脑组织病毒,多数为隐性感染,接种1周后出现病毒血症,2周后出现抗体。病毒的致病机制为,病毒首先侵入宿主树突状细胞,随后蔓延到淋巴结和血液。病毒复制通常在细胞质中,但病毒抗原常在感染细胞的细胞核中发现。
寨卡病毒可在50%的甘油中保存6个多月,在干燥环境中最多可保存30个月,能被高锰酸钾、乙醚和58℃ 30 min灭活[6]。可将样本接种于蚊源细胞(C6/3b)或Vero细胞等分离培养。
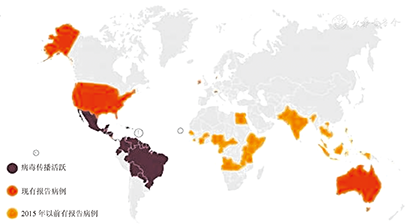
1954年尼日利亚的3例患者是最早被证实的寨卡病毒感染病例。血清学调查显示,在中非和部分亚洲地区(印度尼西亚),人群中寨卡病毒的感染率达50%,但发病者很少[7]。2007年4至7月,位于西太平洋密克罗尼西亚的雅浦(Yap)岛上185例患者出现发热、头痛、皮疹、结膜炎和关节痛,其中49例经实验室确诊为寨卡病毒感染,成为有史以来最大的一次寨卡病毒人类感染暴发事件,岛上约70%的3岁以上人群被感染,但没有导致住院或死亡的重症病例[7]。2013至2014年,法属波利尼西亚发生人感染寨卡病毒暴发流行,约32 000人被感染,占当地居民人数的11%[8]。此后,寨卡病毒感染开始在非洲和亚洲以外的多国流行,造成多起人类感染流行疫情。2014年2月智利复活节岛发现寨卡病毒感染病例。2015年4月起,寨卡病毒感染迅速扩散至南美洲、中美洲和加勒比地区,至今已有30多个国家报告了感染病例,病例数约400万,其中巴西与哥伦比亚最为严重[8,9,10](图4)。巴西卫生部公布的数据显示,巴西现有寨卡病毒感染者150万,新生儿小头畸形症疑似病例增至3 783例,已确诊404例,其中76例死亡。美国疾病控制与预防中心于2016年2月10日称,其境内寨卡病毒感染病例已上升至66例,多为旅游感染。
与我国毗邻的东南亚国家和几个太平洋国家自2007年以来常出现寨卡病毒感染散发病例,对我国威胁很大。2016年2月9日,我国江西省发现大陆首例寨卡病毒病输入性病例,截至2016年3月11日,我国共发现13例输入性寨卡病毒感染病例。
1956年,动物试验证明寨卡病毒可通过伊蚊叮咬在人和动物间传播,属于虫媒病毒性传染病[11]。后来,研究人员又发现,寨卡病毒还可以通过输血、性接触和母婴传播等方式实现人-人间传播。巴西曾确诊2例经输血感染寨卡病毒的病例[12]。另有资料显示,寨卡病毒也存在于感染者的精液中,可从感染者发热开始持续存在62 d[13]。目前已证实3例通过性传播感染寨卡病毒的病例,其中1例为美国科罗拉多州大学的一位生物学家,他在塞内加尔研究蚊子,回美国后出现寨卡病毒感染症状,并传染给了他的妻子[14]。2015年,研究人员在羊水中检出寨卡病毒RNA,证实寨卡病毒可以通过胎盘感染新生儿[15]。此外,研究人员曾在唾液、母乳中检出寨卡病毒,因而亲吻或哺乳也可能会成为寨卡病毒的传播途径[16]。
寨卡病毒感染的潜伏期为3~12 d,通常仅1/5的感染者会发病,其他为隐性感染。寨卡病毒病的临床症状通常比较温和,多为轻微发热、皮疹(开始于面部,后发展至全身)、关节痛(主要是手和足)、肌肉痛、头痛、结膜炎、眼后痛和呕吐等,手掌和足底红肿,口唇干裂,舌红如草莓,一般持续4~7 d,为自限性疾病[8]。重症病例多为有基础疾病或并发症的患者,如巴西3例寨卡病毒感染死亡病例均有呼吸道感染或其他并发症。需要注意的是,寨卡病毒病的临床表现与登革热和基孔肯雅热十分相似,容易误诊,应加以鉴别(表1[17])。
2014年,巴西仅有147例婴儿患小头畸形症病例,而2015年已增至2 700例疑似病例,增长了近20倍[7,18],与寨卡病毒感染在人类的流行呈现同步。在巴西寨卡病毒疫情最严重的伯南布哥州(Pernambuco state),婴儿先天性小头畸形症病例数占巴西全国病例数的一半以上。在哥伦比亚,2015年共有5 000多名孕妇感染寨卡病毒,小头畸形症有500例[19]。关于寨卡病毒感染与婴儿先天性小头畸形症之间的关系,2015年11月28日巴西卫生部宣布,在尸检中发现一个先天性小头畸形的婴儿携带有寨卡病毒,两者之间的关联得到确认[20]。
另有研究发现,29例小头畸形婴儿眼底黄斑与视神经有异常,早期3例观察结果:包括黄斑色素斑、黄斑区脉络膜视网膜萎缩、视神经发育不全、增加杯/盘比值(cup to disc ratio)、虹膜缺损及晶体半脱位等变化[21,22]。
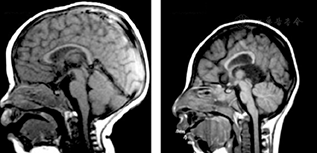
胎儿小头畸形症在孕妇妊娠24周左右即可应用超声、磁共振等技术发现患儿头围测值及脑容量低于正常同龄胎,临床上常用正常同龄儿头围3个标准差作为诊断小头畸形症的依据。一名在巴西工作的斯洛文尼亚妇女,妊振13周时受寨卡病毒感染,在妊娠14~20周时超声检查正常;返回欧洲后,在妊娠29周时作超声检查,提示胎儿出现畸形表现,胎动减少;妊娠32周时胎儿生长受限,胎盘厚度3.5 cm(正常范围),脑室中度扩大,小脑径低于标准,脑结构模糊,有多个钙化灶,胎儿其他结构无异常(图5[23])。应患者要求于妊娠32周终止妊娠,分娩出小头畸形婴儿。尸检脑组织样本RT-PCR检测寨卡病毒阳性,切片电镜检查发现黄病毒样微粒染色阳性,证实寨卡病毒可垂直传播致胎儿严重脑组织病变,除脑组织外胎儿其他器官无明显病变,提示寨卡病毒具有极强的嗜神经性[23]。
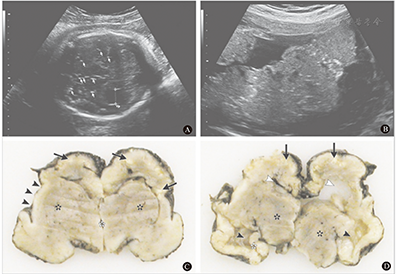

注:A.B超检查可见胎儿脑内多处钙化(箭头所示)及侧脑室枕角扩张(虚线标所示);B. B超检查可见多处胎盘钙化;C.胎儿脑皮质和皮质下白质多处钙化(长箭头所示),皮质完全无脑回,基底节已发育但不清晰(黑色星号所示),两侧大脑侧裂全开放(短箭头所示),第三脑室未扩张(白色星号所示);D.侧脑室体部扩张(白色箭头所示),左侧已塌陷,侧脑室颞角亦扩张(短箭头所示),丘脑(黑色星号所示)和左侧海马(白色星号所示)发育良好,对侧因尸检原因未观察到
巴西学者又对35例小头畸形症的新生儿头颅作超声、CT及X线检查发现[24,25]:(1)存在弥漫的脑组织钙化,主要发生在侧脑室旁、薄壁组织旁和丘脑区域、基底节区域;(2)皮质和皮质下萎缩造成脑室缩小也很常见,少数婴儿同时出现关节挛缩,提示周围和中枢神经系统受累(图6[24])。
在法属波利尼西亚的27万寨卡病毒感染病例中,有73例患者出现吉兰-巴雷综合征或其他神经系统损害,且98%的吉兰-巴雷综合征病例可以检出寨卡病毒抗体,其中88%的病例在1周前出现过典型寨卡病毒病症状,因此,欧洲CDC认为吉兰-巴雷综合征是寨卡病毒感染的并发症[26]。2015年巴西寨卡病毒病流行期间,吉兰-巴雷综合征的发生率也有所上升,截至2015年7月13日,共监测到76例脊神经系统并发症患者,其中42例(55%)被诊断为吉兰-巴雷综合征,而62%(26/42)的患者曾出现寨卡病毒病症状[8,18]。
据报道一例54岁荷兰妇女,在苏里南被蚊虫叮咬而感染寨卡病毒,出现发热、血小板减少、皮下出血与血肿[27]。该患者经血液样本RT-PCR检测证实为急性寨卡病毒病。起病第2天实验室检查血小板为20×109/L,12 d后血小板减少明显(10×109/L),并出现齿龈出血。遂给予免疫球蛋白静脉输入等治疗,数天后血小板上升至80×109/L。
寨卡病毒病的诊断需结合流行病学史、临床表现和实验室检查。一般患者血白细胞稍增加,中性粒细胞、血小板数及肝功能多正常。确诊须依赖特异性实验室检测:(1)用RT-PCR方法检测寨卡病毒RNA或取血液样本分离病毒,但病毒血症比较短(即阳性窗短),仅3~7 d。据Gourinat等[28]报道,寨卡病毒病患者的尿液中可以检到病毒,发病10 d后病毒仍能检出,比血清样本保持更久。(2)血清特异性抗体检测,发热第5天后用酶联免疫吸附法或荧光免疫法测抗-寨卡病毒IgM阳性,可以诊断,但与其他黄病毒属疾病,如登革热、黄热病、西方马脑炎等疾病有一定交叉。如1~2周后抗体滴度有4倍增加者也有诊断意义。
寨卡病毒病为自限性疾病,目前尚无具体的抗病毒药物可用,疫苗尚在研制中。治疗措施主要是对症治疗,即补充液体、退热、止痛、卧床休息。症状一般持续2~7 d自行好转,症状重者或伴有吉兰-巴雷综合征并发症者,需采用血浆置换、大剂量丙种球蛋白静脉应用等治疗。本病病死率低,人感染后可获得终身免疫,目前没有感染后再次感染的报道。
近20年来,全世界发现的30余种新现或再现的传染病病原,许多属于吸血昆虫传播的虫媒病毒(Arbovirus)。目前,主要以蚊虫为传播媒介的病毒性传染病,如登革热、基孔肯雅热及寨卡病毒病等均在人群中扩大流行。虽然寨卡病毒病的临床表现较轻,绝大多数为自限性,但是该病毒对宿主具有较强的嗜神经性,并可通过胎盘传染给胎儿,造成胎儿大脑发育障碍,出现小头畸形症或脑干功能受损等。我国幅原辽阔,地理景观复杂,地跨寒、温、热三带,存在多种媒介昆虫,适宜多种虫媒病毒的生存。寨卡病毒病的扩大流行对我国威胁很大,必须加强研究与预防。
利益冲突 无