
目前,我国临床细菌耐药状况十分严峻,各种常见多重耐药菌和泛耐药菌的检出率比较高。就革兰阳性菌而言,主要的耐药细菌包括甲氧西林耐药金黄色葡萄球菌(MRSA)、大环内酯耐药链球菌;对糖肽类耐药肠球菌尚处于较低水平。我国MRSA分子型别和链球菌的耐药机制与欧美国家有所不同。肠杆菌科细菌主要对头孢菌素和喹诺酮类耐药突出,耐药率超过60%,且近年来对碳青霉烯类耐药的肺炎克雷伯菌呈较快上升态势,耐药的主要机制是细菌产生KPC-2型碳青霉烯酶,给临床治疗带来了重大挑战。铜绿假单胞菌的耐药情况相对比较稳定,耐药率大多在20%~30%;多重耐药鲍曼不动杆菌是临床面临的重大难题,该菌对碳青霉烯类、头孢菌素等的耐药率超过50%,对替加环素耐药的菌株也日益多见。该文结合细菌耐药监测数据和细菌耐药机制研究结果,系统阐述了近五年我国细菌耐药的现状与特征。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
细菌耐药已经成为全球面临的严重公共卫生挑战,WHO要求各成员国积极采取行动,制定国家行动计划,从动物-环境-人类的视角,以"大健康(One Health)"为原则开展耐药控制工作,具体措施包括:提高全民对耐药的认识、增加政府对耐药控制工作投入和基础建设、人类和动物抗菌药物合理使用、新型诊断治疗手段的研究与开发、广泛的国际合作等。在耐药基础建设中,建立细菌耐药监测网络最为重要。细菌耐药检测结果不仅可以掌握耐药发展趋势,提供药物使用的基础,还可为管理部门提供制订管理策略的基础数据。耐药监测在全球主要国家和地区已经广泛建立,如美国(NISS)、欧盟(EARS-net)、加拿大(CARSS)等都拥有各自的检测系统,这些系统基于各自目的,在数据采集和分析等方面有所差异。为了保证获得准确可靠的检测结果,需要在检测质量保证方面痛下功夫。我国也有各类监测网络,从医疗机构自身监测到各地区和全国监测,但大多为被动监测,数据取舍较为宽松,所得结果尚不能完全满足需要。本期杂志,就有关我国近年来细菌耐药的发展态势与分子特点进行了简要综述,以期为读者全面了解相关情况提供参考;同时还就有关耐药监测质量保证进行了介绍,要获得高质量的检测结果,临床微生物实验室条件、从业人员能力以及标准化操作规程等至关重要,同时临床配合也必不可少;李兰娟院士还从感染微生态的角度对耐药发生与控制提出了新的思路,不失为临床耐药控制的重要策略。
我国细菌耐药比较严重,各种临床常见细菌对抗菌药物表现出不同的耐药水平,耐药机制也各有特点,且与国外有所差异。本文就我国近年来主要细菌耐药现状以及主要耐药机制进行介绍(图1)。
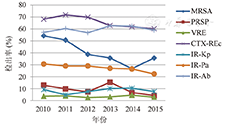

注:MRSA.耐甲氧西林金黄色葡萄球菌;PRSP.耐青霉素肺炎链球菌(非脑膜炎);VRE.万古霉素耐药屎肠球菌;CTX-R Ec.头孢噻肟耐药大肠埃希菌;IR-Kp.亚胺培南耐药肺炎克雷伯菌;IR-Pa.亚胺培南耐药铜绿假单胞菌;IR-Ab.亚胺培南耐药鲍曼不动杆菌
甲氧西林耐药金黄色葡萄球菌(MRSA)为临床主要耐药现象。自20世纪70年代MRSA在中国被检出后,80年代MRSA在我国的检出率已增至20%左右,该流行水平一直持续到2000年,之后MRSA的检出率呈迅速上升态势,2008年医院获得性MRSA(HA-MRSA)的检出率已经超过60%[1,2]。2010年开始,MRSA的检出率出现了一定程度的下降,2014年CHINET监测数据显示我国MRSA的检出率为44.6%[3],全国耐药监测网(Mohnarin)的数据显示,2015年我国MRSA的检出率为35.8%[4]。目前,我国不同地区MRSA的检出率仍有较大差异,其中上海最高,为47.0%,山西省最低,为20.3%。
我国临床分离的MRSA菌株表现出耐药谱广、耐药率高的特点,除对β-内酰胺类药物外,对大环内酯类、喹诺酮类等药物的耐药率均在70%以上,2012年以来对克林霉素、氨基糖苷类药物的耐药率有下降趋势,对克林霉素和庆大霉素的耐药率分别由2010年的73.4%和77.3%下降到52.9%和62.3%,对利福平的耐药率在50%左右,对复方磺胺甲噁唑的耐药率由2010年的20.1%显著降低到2014年的7%;没有发现对万古霉素、替考拉宁耐药的菌株(表1)[3,5,6,7,8]。
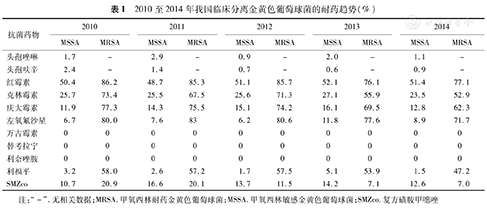
2010至2014年我国临床分离金黄色葡萄球菌的耐药趋势(%)
2010至2014年我国临床分离金黄色葡萄球菌的耐药趋势(%)
| 抗菌药物 | 2010 | 2011 | 2012 | 2013 | 2014 | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| MSSA | MRSA | MSSA | MRSA | MSSA | MRSA | MSSA | MRSA | MSSA | MRSA | |
| 头孢唑啉 | 1.7 | - | 2.9 | - | 0.9 | - | 2.0 | - | 1.1 | - |
| 头孢呋辛 | 2.4 | - | 1.4 | - | 0.7 | - | 0.6 | - | 0.9 | - |
| 红霉素 | 50.4 | 86.2 | 48.7 | 85.3 | 51.1 | 85.7 | 52.1 | 76.1 | 51.4 | 77.1 |
| 克林霉素 | 25.7 | 73.4 | 25.5 | 67.5 | 25.6 | 71.3 | 27.1 | 55.9 | 23.5 | 52.9 |
| 庆大霉素 | 11.9 | 77.3 | 14.3 | 75.5 | 15.1 | 74.2 | 16.1 | 69.5 | 12.8 | 62.3 |
| 左氧氟沙星 | 6.7 | 80.0 | 7.6 | 83 | 6.2 | 80.6 | 11.8 | 77.6 | 8.9 | 71.7 |
| 万古霉素 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 替考拉宁 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 利奈唑胺 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 利福平 | 3.2 | 58.0 | 2.6 | 57.2 | 1.7 | 57.5 | 5.1 | 53.9 | 1.5 | 47.2 |
| SMZco | 10.7 | 20.9 | 16.6 | 20.1 | 13.7 | 11.5 | 14.2 | 7.1 | 12.6 | 7.0 |
注:"-" .无相关数据;MRSA.甲氧西林耐药金黄色葡萄球菌;MSSA.甲氧西林敏感金黄色葡萄球菌;SMZco.复方磺胺甲噁唑
我国MRSA菌株的分子型别相对单一。一项全国多中心研究收集了2011年1至6月全国69家医院的1 141株HA-MRSA,结果显示ST239-Ⅲ-t030、ST239-Ⅲ-t037和ST5-Ⅱ-t002是最常见的克隆,分别占57.1%、12.9%和8.1%;ST59占6.6%,该型别菌株通常是SCCmec Ⅳ或Ⅴ型和pvl阳性,具有典型的社区获得性MRSA(CA-MRSA)菌株特点,比如耐药谱较窄[9]。
CA-MRSA在世界各国的流行情况有所不同,法国皮肤和软组织感染的患者中CA-MRSA的检出率为1%~3%,而美国CA-MRSA的检出率则高达50%[10]。有研究显示,北京儿童皮肤和软组织感染中CA-MRSA的检出率为1.1%~4%,这些细菌呈多重耐药,对大环内酯类、克林霉素、氨基糖苷类、磺胺、喹诺酮类、四环素等的耐药率为57.1%~85.7%,对利福平的耐药率为28.6%,耐药情况与HA-MRSA菌株差别不大;71.4%的菌株pvl阳性,ST59型占57.1%,ST59-Ⅳa-t437型占42.9%[11,12]。成人与儿童CA-MRSA情况基本相似。
目前,有关hVISA和VISA的研究较少。Liu等[13]对2011年6月至2012年5月我国6家教学医院无菌体液培养的金黄色葡萄球菌进行研究发现,77株(77/184,41.8%)MRSA中,17株为hVISA,占22.1%,主要属于ST239-SCCmecⅢ-t030-agr-Ⅰ型,这些hVISA菌株对庆大霉素、左氧氟沙星、妥布霉素、红霉素、四环素和复方磺胺甲噁唑的耐药率显著高于非hVISA菌株(P<0.05)。
与亚洲其他国家相比,我国肺炎链球菌对青霉素的耐药率稍低,具有以下特点:(1)青霉素不敏感肺炎链球菌(PNSP)从2000年开始逐渐上升,至2004年达到最高水平56.6%,之后缓慢下降,2008年仅为12.1%(可能还受CLSI折点改变影响),近5年基本维持在20%左右;(2)儿童PNSP远高于成人;(3)PNSP大多表现为多重耐药,如上海四家教学医院2013年分离的284株肺炎链球菌中有88%的菌株是多重耐药菌[14];(4)青霉素中介肺炎链球菌(PISP)所占的比例始终高于青霉素耐药(PRSP)菌株,但后者呈逐年上升趋势,最近的研究表明,上海地区PRSP比例已达11.3%[14]。
对大环内酯类耐药率高是中国肺炎链球菌的突出特点,全国整体耐药率在2009年后上升到90%以上[3,4,5,6,7,8,15],且耐药表型大多为大环内酯类-林可酰胺类-链阳菌素固有型耐药(MLSB),菌株同时对克林霉素耐药[15]。2013年上海地区儿童和成人中分离的肺炎链球菌对红霉素的耐药率为97.2%,对克林霉素的耐药率为96.5%[14]。肺炎链球菌对大环内酯类耐药主要由两种机制介导,第一种机制是由erm(B)编码的核糖体甲基化引起的靶位改变和导致的MLSB表型;第二种机制是mef编码的外排泵系统引起的仅对红霉素类的大环内酯类药物,而对林可酰胺类抗菌药物和链阳菌素B组敏感的M型耐药表型[15]。mef主要有两类,即mef(E)和mef(A)。mef(A)一般由有缺陷的转座子Tn1207.1或Tn1207.3携带,而mef(E)常在一类"大环内酯类外排泵基因岛"元件中。这两种元件的下游往往都携带一个与开放读码框msr(D)(链球菌属中编码ATP依赖的外排泵),msr(D)可以与mef共转录,介导肺炎链球菌可诱导性红霉素双外排泵系统[16]。有研究人员对全国县级医院门诊患者分离的288株肺炎链球菌研究发现,262株ermB和tet(M)均阳性,仅有5株ermB单一阳性,6株仅tet(M)单一阳性。262株ermB和tet(M)阳性菌株中133株同时携带msr(D)和mef(A),另外有3株仅有msr(D)和mef(A)(待发表结果)。
近十年来,随着肺炎链球菌耐药性的变迁,细菌血清型与基因型也发生了改变。我国儿童患者中分离的肺炎链球菌血清型14比例高于成人。2009至2012年深圳87株侵袭性感染肺炎链球菌中,19F(25株,28.7%),14(22株,25.3%),23F(10株,11.5%),19A(8.9株.2%)和6B(6株,6.9%)为主要血清型[17]。2013年上海地区四家教学医院分离的284株肺炎链球菌中,19F(33.5%)、19A(14.1%)、23F(12.0%)和6A(8.8%)为主要血清型,PCV7、PCV10和PCV13疫苗对血清型的覆盖率分别为58.6%、59.4%和85.1%[14]。主要的克隆为ST271(24.7%)、ST320(11.2%)、ST81(9.7%)和ST3173(5.2%)。绝大多数ST271克隆菌株的血清型为19F、ST320和ST81,ST3173菌株的血清型为19A、23F和6A。
肠球菌为我国临床分离第二位的革兰阳性球菌,近五年的分离率维持在8%左右。我国临床分离的肠球菌对糖肽类药物始终保持较高的敏感性,对万古霉素的耐药率仍处于较低水平,但其对高浓度氨基糖苷类、喹诺酮类以及青霉素类耐药较普遍(表2)[3,4,5,6,7,8]。
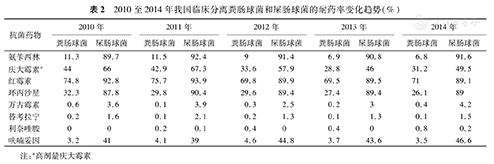
2010至2014年我国临床分离粪肠球菌和屎肠球菌的耐药率变化趋势(%)
2010至2014年我国临床分离粪肠球菌和屎肠球菌的耐药率变化趋势(%)
| 抗菌药物 | 2010年 | 2011年 | 2012年 | 2013年 | 2014年 | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| 粪肠球菌 | 屎肠球菌 | 粪肠球菌 | 屎肠球菌 | 粪肠球菌 | 屎肠球菌 | 粪肠球菌 | 屎肠球菌 | 粪肠球菌 | 屎肠球菌 | |
| 氨苄西林 | 11.3 | 89.7 | 11.5 | 92.4 | 9 | 91.4 | 6.9 | 90.8 | 6.8 | 91.6 |
| 庆大霉素a | 44 | 66 | 42.9 | 67.3 | 33.6 | 57.9 | 28.8 | 46 | 31.2 | 49.5 |
| 红霉素 | 74.8 | 92.8 | 75.7 | 93.9 | 69.8 | 89.9 | 69.5 | 89.5 | 71 | 89.1 |
| 环丙沙星 | 32.3 | 87.8 | 29.8 | 90.4 | 29.6 | 89.4 | 27.4 | 89.4 | 26.1 | 89 |
| 万古霉素 | 0.6 | 3.6 | 0.1 | 3.9 | 0.3 | 2.5 | 0.2 | 3 | 0.4 | 4.2 |
| 替考拉宁 | 0.2 | 1.6 | 0.1 | 2.1 | 0.2 | 1.3 | 0.1 | 1.3 | 0.1 | 1.5 |
| 利奈唑胺 | 0 | 0 | 0.2 | 0.1 | 0.4 | 0 | 0.4 | 0 | 0.8 | 0.2 |
| 呋喃妥因 | 3.2 | 41 | 4.1 | 39 | 4.6 | 44.8 | 3.7 | 43.6 | 3.5 | 46.6 |
注:a高剂量庆大霉素
2010年CHINET和Mohnarin两个全国性细菌耐药监测网均发现有4%左右的屎肠球菌是万古霉素耐药菌株[5,18],近五年这个比例一直维持在4%左右,同期粪肠球菌对万古霉素的耐药率为0.1%~0.4%,对替考拉宁的耐药率为0.1%。我国临床分离的万古霉素耐药肠球菌(VRE)的分子型以vanA为主,vanB和vanM型也有少量被检出,耐药基因簇存在于质粒之Tn1546样转座子结构中,分子流行病学调查表明多以散发为主[19,20,21]。对全国12家医院2005至2011年分离的101株VRE(96株屎肠球菌,5株粪肠球菌)研究发现:4株粪肠球菌对万古霉素和替考拉宁的MIC≥256 μg/mL,属于vanA阳性,1株为vanB阳性(万古霉素和替考拉宁MIC分别为32和1 μg/mL),均为克隆复合体CC4(3株ST471,2株ST471);屎肠球菌对万古霉素的MIC≥256 μg/mL,对替考拉宁的MIC值为1~256 μg/mL,除了1株为ST362外,所有屎肠球菌均为克隆复合体CC17;所有粪肠球菌均对氨苄西林敏感,所有的VRE对达托霉素、利奈唑胺和替加环素均敏感;分别有77.2%和29.7%的菌株为esp和hyl阳性[22]。上海华山医院发现13株VRE中11株属于克隆复合型CC17[23]。vanM型VRE首先在上海发现,该型菌株对万古霉素和替考拉宁都耐药,耐药菌肽聚糖前体为UDP-MurNAc-tetrapeptide-D-Lac,表现出与vanA相同的耐药基础,但不同于vanA基因簇含有7个基因,vanM基因簇仅包括6个基因,分别为vanRM、vanSM、vanYM、vanHM、vanM和vanXM,且vanYM位于vanSM之后,整个基因簇有1 032个碱基,编码343个氨基酸,氨基酸序列和vanA、vanB、vanD和vanF分别有79.9%、70.8%、66.3%和78.8%相同[23,24]。
肠球菌对高剂量的庆大霉素耐药明显,但近三年粪肠球菌的耐药率有所下降(表3)。肠球菌对高剂量庆大霉素耐药主要由产生氨基糖苷类钝化酶所致。杭州68株对高浓度庆大霉素耐药肠球菌(HLGR)中,63株(92.6%)含有aac(6')-Ⅰe-aph(2″)-Ⅰa双功能酶基因,3株(4.4%)aph(2″)-Ⅰb基因阳性[25];北京HLGR中95%以上的菌株aac(6')-Ⅰe-aph(2″)-Ⅰa阳性,2.4%的屎肠球菌aph(2″)-Ⅰd阳性,99%以上的链霉素高水平耐药(HLSR)肠球菌ant(6')-Ⅰa阳性[26]。Chen等[27]在屎肠球菌、铅黄肠球菌和鹑鸡肠球菌(各1株)中发现aph(2″)-Ⅰe,这是一种新型磷酸转移酶,主要修饰庆大霉素,导致对该药高度耐药,其存在于16 kb质粒,该质粒同时携带链霉素腺苷转移酶基因(str);aph(2″)-Ⅰe推测的氨基酸序列与APH(2″)-Ⅰa、Ⅰb、Ⅰc和Ⅰd有29.2%、31.1%、27.8%和93.7%相同。
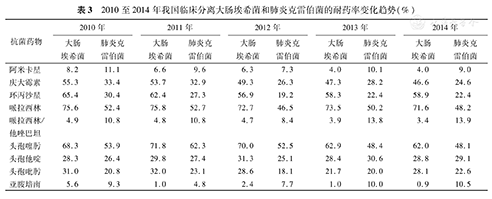
2010至2014年我国临床分离大肠埃希菌和肺炎克雷伯菌的耐药率变化趋势(%)
2010至2014年我国临床分离大肠埃希菌和肺炎克雷伯菌的耐药率变化趋势(%)
| 抗菌药物 | 2010年 | 2011年 | 2012年 | 2013年 | 2014年 | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| 大肠埃希菌 | 肺炎克雷伯菌 | 大肠埃希菌 | 肺炎克雷伯菌 | 大肠埃希菌 | 肺炎克雷伯菌 | 大肠埃希菌 | 肺炎克雷伯菌 | 大肠埃希菌 | 肺炎克雷伯菌 | |
| 阿米卡星 | 8.2 | 11.1 | 6.6 | 9.6 | 6.3 | 7.3 | 4.0 | 10.1 | 4.0 | 9.0 |
| 庆大霉素 | 55.3 | 33.4 | 53.7 | 32.9 | 49.3 | 26.3 | 47.3 | 28.2 | 46.6 | 24.6 |
| 环丙沙星 | 65.4 | 30.4 | 62.4 | 27.3 | 56.9 | 19.2 | 58.3 | 22.4 | 58.9 | 22.4 |
| 哌拉西林 | 75.6 | 52.4 | 75.8 | 52.7 | 72.7 | 46.5 | 73.5 | 50.2 | 71.6 | 48.2 |
| 哌拉西林/ | 4.9 | 10.8 | 4.8 | 10.8 | 4.7 | 8.4 | 3.9 | 13.8 | 3.4 | 13.9 |
| 他唑巴坦 | ||||||||||
| 头孢噻肟 | 68.3 | 53.9 | 71.8 | 62.3 | 70.0 | 52.5 | 62.9 | 48.4 | 62.0 | 48.1 |
| 头孢他啶 | 28.3 | 26.4 | 29.8 | 27.4 | 31.3 | 25.1 | 28.4 | 30.6 | 28.8 | 29.1 |
| 头孢吡肟 | 31.0 | 20.8 | 32.0 | 23.1 | 28.6 | 18.1 | 21.7 | 20.0 | 28.1 | 22.6 |
| 亚胺培南 | 5.6 | 9.3 | 1.0 | 4.8 | 2.4 | 7.7 | 1.0 | 10.0 | 0.9 | 10.5 |
粪肠球菌和屎肠球菌对氨苄西林的耐药率差异较大。从2009至2014年,粪肠球菌的耐药率从15.8%降低到6.8%,近三年其耐药率一直在7%左右;屎肠球菌对氨苄西林的耐药率一直维持在90%左右,但其耐药机制研究不多,个别研究报道与肠球菌青霉素结合蛋白5的变异有关。童乐艳等[28]分析了57株氨苄西林耐药屎肠球菌β-内酰胺酶均为阴性,大多细菌存在pbp5基因3~6个位点突变和碱基插入。肠球菌对喹诺酮类耐药突出,2008年监测结果,粪肠球菌和屎肠球菌对环丙沙星的耐药率分别为42.8%和91.9%,耐药机制在于DNA旋转酶gyrA和拓扑异构酶ⅣparC喹诺酮耐药决定区突变[29]。粪肠球菌对呋喃妥因的耐药率低于5%,但屎肠球菌对呋喃妥因的耐药率在50%左右。2011年开始CHINET和Mohnarin均监测到利奈唑胺耐药的肠球菌。
大肠埃希菌对头孢菌素类和氟喹诺酮类的耐药形势严峻,肺炎克雷伯菌对头孢菌素的耐药率虽低于大肠埃希菌,但对碳青霉烯酶类的耐药率却是肠杆菌科中最高,产碳青霉烯酶的比率也是最高的,尤其是KPC-2。近年还出现了多类耐药基因同时存在,同一菌株检出两类碳青霉烯酶的现象,这类泛耐药菌株增多,给临床治疗带来极大困难(表3)。
2010至2014年我国三级医院肠杆菌科细菌对头孢菌素类药物的耐药率仍呈上升趋势,大肠埃希菌和肺炎克雷伯菌(克雷伯菌属)对头孢噻肟的耐药率分别为62.0%~71.8%和48.1%~62.3%,对头孢他啶的耐药率分别为28.3%~31.3%和25.1%~30.6%,对头孢吡肟的耐药率分别为21.7%~32.0%和18.1%~23.1%。其他肠杆菌如弗氏柠檬酸杆菌对头孢噻肟、头孢他啶和头孢吡肟的耐药率分别为64.5%~70.8%、36.7%~37.5%和19.7%~21.7%。奇异变形杆菌的耐药率较低,对头孢噻肟、头孢他啶和头孢吡肟耐药率分别为33.8%~48.3%、8.7%~10.4%和10.4%~13.7%。阴沟肠杆菌、产气肠杆菌对头孢噻肟和头孢他啶的耐药率与大肠埃希菌相近,对头孢吡肟的耐药率小于20%[3,7,8,30,31]。
2013和2014年,我国三级医院大肠埃希菌产ESBLs的检出率分别为54.0%和55.8%,克雷伯菌属为31.8%和29.9%,奇异变形杆菌为16.5%和24.0%[3,8],与2009年的产ESBLs检出率相比变化不大。其中,blaCTX-M仍是世界及中国主要流行的ESBLs型。近年,我国不论三级医院还是社区感染都出现blaCTX-M-55检出率超过blaCTX-M-15的现象,如我国三级医院大肠埃希菌中,产ESBLs型blaCTX-M-14菌株的阳性率为46.8%,blaCTX-M-55为24.8%,blaCTX-M-15为18.2%,全国县级医院社区感染大肠埃希菌中,产ESBLs型blaCTX-M-14菌株的阳性率为64.5%,blaCTX-M-55为18.4%,blaCTX-M-15为12.1%[32]。据文献报道,blaCTX-M-55多来源于动物[32,33,34],质粒传播在CTX-M型ESBLs的广泛流行中起关键作用[35]。
2010至2014年,我国三级医院临床分离的大肠埃希菌对亚胺培南的耐药率为0.95%~5.6%,对美罗培南的耐药率为1.0%~3.0%;肺炎克雷伯菌(克雷伯菌属)对亚胺培南的耐药率为4.8%~10.5%,对美罗培南的耐药率为4.1%~13.5%。其他肠杆菌科细菌,如弗氏柠檬酸杆菌、奇异变形杆菌、阴沟肠杆菌和产气肠杆菌对亚胺培南的耐药率分别为6.8%~10.7%、4.7%~5.4%、3.5%~8.4%和6.1%~10.0%,对美罗培南的耐药率除奇异变形杆菌不超过3%之外,其余均已超过5%,其中产气肠杆菌2012年对美罗培南的耐药率已达到10.3%[3,7,8,30,31]。产气肠杆菌和克雷伯菌属对碳青霉烯类药物的耐药率高于其他肠杆菌科细菌。
产碳青霉烯酶是肠杆菌科细菌对碳青霉烯类药物耐药的主要机制。其中,KPC-2为国内主要流行的碳青霉烯酶,而IMP酶流行率呈下降趋势。blaKPC-2一般位于可转移质粒上,上下游常存在转座子和插入序列,可解释其在国内碳青霉烯耐药肠杆菌(CRE)中流行的原因。近年陆续有同时携带两类碳青霉烯酶的CRE菌株报道,如武汉3株肺炎克雷伯菌同时携带碳青霉烯酶KPC-2和IMP-4(2008至2009年,3~12个月儿童)[36],福建1株产酸克雷伯菌同时携带KPC-2和IMP-8(2009年,5岁儿童)[37],苏州2株产酸克雷伯菌同时携带KPC-3和NDM-1(2012年,63岁和57岁女性)[38],广州1株弗氏柠檬酸杆菌同时携带KPC-2和NDM-1(2013年,56岁男性)[39],浙江1株解鸟氨酸拉乌尔菌同时携带KPC-2和IMP-4(2014年,13岁儿童)[40]。由此可见,CRE耐药形势越来越严峻,且在儿童中发现多例同时携带两类碳青霉烯酶的肠杆菌科菌株。
2011年我国三级医院临床分离的大肠埃希菌对环丙沙星的耐药率已超过60%,肺炎克雷伯菌对环丙沙星的耐药率接近30%,其他肠杆菌科细菌如奇异变形杆菌、弗氏柠檬酸杆菌的耐药率接近40%,阴沟肠杆菌的耐药率为20%左右,产气肠杆菌和沙雷菌属的耐药率为15%左右[30,31]。由此可见,大肠埃希菌对喹诺酮类药物的高耐药率问题仍然非常突出。对氟喹诺酮类耐药大肠埃希菌的遗传型别及分布特征进行分析显示,我国氟喹诺酮类耐药大肠埃希菌的ST型达60种,其中最常见的ST131占14.6%[41]。ST型多样,散在分布于各地区,可排除某类或某几类优势克隆株广泛传播导致的高耐药率,与长期环境积累有关。
质粒介导的喹诺酮类耐药(PMQR)基因在环境中的检出率最高,其次为动物源,再次为人源细菌[42]。各类PMQR基因流行情况存在差异,总体以aac(6')-Ⅰb-cr和qnrS检出率较高,其中oqxAB的检出率和相关报道明显增多,可能与近年对oqxAB的关注增加有关。oqxAB在动物源尤其是猪源细菌的检出率最高,可能与喹乙醇可以在猪中使用,而禽类禁用相关[43,44]。需要注意的是,目前PMQR基因在对喹诺酮类药物敏感的菌株中分布越来越广泛,尤其是qnr类[45]。有报道显示,虽然肺炎克雷伯菌对喹诺酮类的耐药率较大肠埃希菌低,但PMQR基因的携带率却较大肠埃希菌高[41]。携带PMQR基因的细菌可在水、饲料、动物源食品、人-人之间流动,甚至可通过空气传播。对食品安全及人类健康构成重大威胁。
肠杆菌科细菌对阿米卡星具有较高的敏感性,耐药率多在10%以下,肺炎克雷伯菌、阴沟肠杆菌、弗氏柠檬酸杆菌耐药率为11%~12%。大肠埃希菌对庆大霉素的耐药率为46.6%~55.3%,肺炎克雷伯菌(克雷伯菌属)为24.6%~33.4%,其他肠杆菌科细菌如产气肠杆菌的耐药率低于20%,弗氏柠檬酸杆菌的耐药率高于奇异变形杆菌和阴沟肠杆菌,分别为<40%、32.8%和28.7%[3,7,8,30,31]。细菌产16S rRNA甲基化酶是肠杆菌科细菌对氨基糖苷类药物耐药的主要机制。肠杆菌科细菌16S rRNA甲基化酶以armA和rmtB为主,armA和rmtB基因阳性菌株对氨基糖苷类呈高度耐药。近年多重耐药大肠埃希菌和肺炎克雷伯菌16S rRNA甲基化酶检出率很高[46],常发现多种ESBLs(blaTEM-1、blaCTX-M-24、blaCTX-M-24)[47],PMQR(qnr、qepA)[48],以及fosA3与16s rRNA甲基化酶位于同一质粒上[49]。
近年来,铜绿假单胞菌已从临床分离革兰阴性菌的第二位降至第四位[3,5,6,7,8]。2014年,铜绿假单胞菌对亚胺培南和美罗培南的耐药率分别为26.6%和24.3%,且2012年CLSI降低了碳青霉烯类药物对铜绿假单胞菌的折点,因此耐药率较前次监测并无升高。铜绿假单胞菌对头孢哌酮/舒巴坦、哌拉西林/他唑巴坦、环丙沙星和阿米卡星的耐药率分别为15.5%、14.4%、15%和9.4%,对多黏菌素B的耐药率最低,但近四年,耐药率已从2011年的1%小幅上升至2014年的2.4%(表4)。广泛耐药铜绿假单胞菌的检出率近五年也趋向平稳,为1.5%~2.0%。
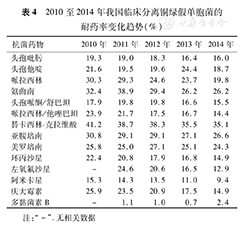
2010至2014年我国临床分离铜绿假单胞菌的耐药率变化趋势(%)
2010至2014年我国临床分离铜绿假单胞菌的耐药率变化趋势(%)
| 抗菌药物 | 2010年 | 2011年 | 2012年 | 2013年 | 2014年 |
|---|---|---|---|---|---|
| 头孢吡肟 | 19.3 | 19.0 | 18.3 | 16.4 | 16.0 |
| 头孢他啶 | 21.6 | 19.5 | 19.6 | 24.4 | 18.7 |
| 哌拉西林 | 30.3 | 29.3 | 24.6 | 23.7 | 19.8 |
| 氨曲南 | 32.4 | 38.9 | 29.4 | 26.2 | 26.2 |
| 头孢哌酮/舒巴坦 | 17.9 | 19.8 | 19.8 | 16.6 | 15.5 |
| 哌拉西林/他唑巴坦 | 23.9 | 21.7 | 17.5 | 16.7 | 14.4 |
| 替卡西林-克拉维酸 | 41.2 | 38.7 | 38.3 | 35.5 | 35.1 |
| 亚胺培南 | 30.8 | 29.1 | 29.1 | 27.1 | 26.6 |
| 美罗培南 | 25.8 | 25.0 | 27.1 | 25.1 | 24.3 |
| 环丙沙星 | 22.4 | 20.8 | 17.9 | 16.8 | 14.9 |
| 左氧氟沙星 | - | 24.6 | 20.6 | 16.5 | 12.9 |
| 阿米卡星 | 15.3 | 14.3 | 13.5 | 11.0 | 9.4 |
| 庆大霉素 | 25.9 | 23.5 | 20.9 | 17.5 | 14.9 |
| 多黏菌素B | - | 1.1 | 1.0 | 0.7 | 2.4 |
注:"-" .无相关数据
我国耐药铜绿假单胞菌克隆群整体呈现多样性遗传背景,但是在局部区域存在集中分布[50]。铜绿假单胞菌对头孢菌素耐药主要是它可以产生多种β-内酰胺酶,包括金属β-内酰胺酶(MBLs)、ESBLs、头孢菌素酶(AmpC酶)。浙江49株多重耐药铜绿假单胞菌检测发现了13种不同类型的β-内酰胺酶基因,其中A类有PER、TEM、SHV型等基因,分别占28.6%、32.7%和46.9%;D类主要为OXA-1O,约占24.5%[51];吉林240株多重耐药铜绿假单胞菌中,blaSHV-12、blaTEM-24、blaCTX-M-1、blaCTX-M-2、blaCTX-M-3、blaPER和blaVEB的检出率分别为17.6%、20.5%、14.3%、9.6%、12.9%、13.8%和11.4%[52]。金属酶基因目前有5大类,分别是IMP、VIM、SPM、SIM及GIM,其中最主要的IPM和VIM已发展到IMP-16和VIM-12。
铜绿假单胞菌对碳青霉烯类耐药的机制往往不是由单一因素造成的,不同耐药机制之间可相互影响。南京研究发现29株铜绿假单胞菌对碳青霉烯类耐药,但对头孢他啶(头孢吡肟)敏感,导致此种现象的主要机制为细胞膜上通道蛋白OprD的下调和mexXY-OprM和mexAB-OprM的过表达[53]。
我国铜绿假单胞菌对喹诺酮类的耐药率维持在较低水平,2014年对环丙沙星和左氧氟沙星的耐药率分别为14.9%和12.9%。铜绿假单胞菌氨基糖苷类修饰酶(AMEs)基因的检出率排序为aac(6')-Ⅰ>aac (3) -Ⅱ>ant (2″) -Ⅰ>aac(6') -Ⅱ,其中aac(6') -Ⅰ和aac(3) -Ⅱ是主要的修饰酶基因。我国淮河以北地区AMEs基因的检出率普遍高于淮南地区,淮河以北地区以ant(2″)-Ⅰ、aac(3')-Ⅱ、aac(6')-Ⅱ为主,淮河以南地区以aac(6')-Ⅱ、ant(2″)-Ⅰ、ant(3″)-Ⅰ等为主[54]。
在临床标本中,鲍曼不动杆菌为最常见的不动杆菌,占85%左右,该菌主要来自于重症监护病房,且呈多重耐药。监测数据显示,鲍曼不动杆菌对β-内酰胺类抗菌药物的耐药率呈现逐年上升的趋势,特别是对亚胺培南和美罗培南的耐药率在2014年分别达到62.4%和66.7%[3,5,6,7,8]。相比较而言,鲍曼不动杆菌对多黏菌素B、米诺环素的敏感率较高,而对第三、四代头孢菌素类、氨基糖苷类、喹诺酮类抗菌药物几乎都呈现高耐药性(表5)。
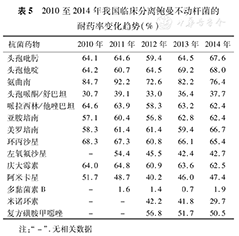
2010至2014年我国临床分离鲍曼不动杆菌的耐药率变化趋势(%)
2010至2014年我国临床分离鲍曼不动杆菌的耐药率变化趋势(%)
| 抗菌药物 | 2010年 | 2011年 | 2012年 | 2013年 | 2014年 |
|---|---|---|---|---|---|
| 头孢吡肟 | 64.1 | 64.6 | 59.4 | 64.5 | 67.6 |
| 头孢他啶 | 64.2 | 60.7 | 64.5 | 69.2 | 68.0 |
| 氨曲南 | 84.7 | 92.2 | 72.6 | 82.2 | 76.4 |
| 头孢哌酮/舒巴坦 | 30.7 | 39.1 | 33.0 | 36.4 | 37.7 |
| 哌拉西林/他唑巴坦 | 64.6 | 63.9 | 58.3 | 63.2 | 62.4 |
| 亚胺培南 | 57.1 | 60.4 | 56.8 | 62.8 | 62.4 |
| 美罗培南 | 58.3 | 61.4 | 61.4 | 59.4 | 66.7 |
| 环丙沙星 | 68.3 | 67.3 | 60.8 | 66.1 | 65.4 |
| 左氧氟沙星 | - | 54.4 | 45.5 | 42.4 | 42.7 |
| 庆大霉素 | 64.0 | 64.8 | 60.9 | 63.6 | 62.5 |
| 阿米卡星 | 51.7 | 48.7 | 40.2 | 46.0 | 47.4 |
| 多黏菌素B | - | 1.6 | 1.4 | 0.7 | 1.9 |
| 米诺环素 | - | - | 42.2 | 41.8 | 29.7 |
| 复方磺胺甲噁唑 | - | - | 56.8 | 51.7 | 50.5 |
注:"-" .无相关数据
鲍曼不动杆菌在我国主要以克隆播散传播,其中CC92克隆复合体在全球范围内流行,但我国不同地区的流行株仍有其特点,Zhong等[55]研究推测ST75可能主要流行于我国东部地区,而He等[56]研究指出我国西部可能以ST138为主。Ying等[57]对我国南方7个城市398株鲍曼不动杆菌进行MLST分析显示,ST208最多,ST191和ST729次之。
近五年来,鲍曼不动杆菌对大多数β-内酰胺类抗菌药物的耐药率均>60%,β-内酰胺酶的产生为其耐药的重要原因之一,国内多见TEM、SHV、PRE-1、CTX型ESBLs。各地产ESBLs菌株的耐药性表现出多样化,且同一菌株也可同时携带2种及2种以上ESBLs。AmpC酶是鲍曼不动杆菌对第三代头孢菌素耐药的主要原因,以染色体介导为主,质粒介导较少。常见ADC型AmpC酶,且其上游插入序列ISaba1自带启动子,可导致AmpC酶基因mRNA的表达量增高[58]。哈尔滨146株鲍曼不动杆菌的研究显示,ADC型基因的阳性率为91.7%(134/146),AmpC酶上游插入序列ISAba1的阳性率为73.2%(107/146)[59]。
产生β-内酰胺酶AmpC、OXA-51、OXA-23与主动外排系统AdeABC、AdeFGH过表达在鲍曼不动杆菌碳青霉烯类耐药中发挥重要作用。Omp34外膜蛋白低表达仅仅是引起碳青霉烯类耐药的辅助因素。
不动杆菌对氨基糖苷类药物的耐药性近五年趋于平稳,2014年对庆大霉素和阿米卡星的耐药率为62.5%和47.4%。鲍曼不动杆菌对于氨基糖苷类抗菌药物耐药的机制主要为产生氨基糖苷修饰酶和16S rRNA甲基化酶。编码氨基糖苷修饰酶的基因通常位于Ⅰ类整合子中[58]。102株高水平耐氨基糖苷类鲍曼不动杆菌中ant(3″)-Ⅰ、aac(3)-Ⅰ、aph(3')-Ⅰ、aac(6')-Ⅰb、aph(3')-Ⅱb和armA的基因阳性率分别为95.10%、65.69%、47.06%、45.10%、0.98%和98.04%。其中,aac(3)-Ⅰ+aac(6')-Ⅰb+ant(3″)-Ⅰ+armA、aac(3)-Ⅰ+aph(3')-Ⅰ+ant(3″)-Ⅰ+armA、ant (3″)-Ⅰ+armA为常见的基因表达谱,阳性率分别为25.49%、21.57%和12.75%[60]。
外排泵AdeABC、AdeIJK、AdeFGH和AbeM在鲍曼不动杆菌中广泛存在,其中AdeB和AdeJ外排泵基因的高表达在鲍曼不动杆菌替加环素耐药中起主要作用。温州在2013至2014年临床分离的120株耐碳青霉烯类鲍曼不动杆菌中发现5株耐替加环素菌株,进一步研究发现外排泵系统AdeABC和AdeIJK可能在替加环素敏感性下降机制中起重要作用,而外排泵系统AdeFGH和AbeM可能与鲍曼不动杆菌对替加环素耐药无关[61]。2014年,Deng等[62]报道了鲍曼不动杆菌对替加环素耐药的新机制——tetX1,它是tetX的同源基因,可编码黄素依赖性单氧化酶,以替加环素作为底物,影响其抗菌活性。
近五年,多重耐药与泛耐药不动杆菌的检出率显著上升,2014年泛耐药鲍曼不动杆菌的检出率为19.7%[4]。产生水解酶,膜通透性降低,外膜蛋白改变、缺失及主动外排系统过表达均在细菌多重耐药机制中发挥重要作用。
综上可见,我国临床细菌耐药状况十分严峻,各种常见多重耐药菌和泛耐药菌的检出率比较高。就革兰阳性菌而言,主要耐药细菌包括MRSA、大环内酯耐药链球菌;对糖肽类耐药肠球菌尚处于较低水平。中国MRSA分子型别和链球菌耐药机制与欧美国家不同。肠杆菌科细菌主要对头孢菌素和喹诺酮类耐药突出,耐药率超过60%,且近年来对碳青霉烯类耐药肺炎克雷伯菌呈较快上升态势,耐药主要源于细菌产生KPC-2型碳青霉烯酶,临床需要加以关注。铜绿假单胞菌耐药相对比较稳定,耐药率大多在20%~30%;多重耐药鲍曼不动杆菌是临床面临的重大难题,该菌对多碳青霉烯类、头孢菌素等的耐药率超过50%,对替加环素耐药菌株也日益多见,临床需要在抗感染治疗中区分感染和细菌定植状态,减少不必要的抗菌药物使用。
利益冲突 无































