
探讨Peg IFNα-2b(派格宾)治疗HBeAg阳性慢性乙型肝炎(CHB)的疗效和安全性。
选择2013年11月1日至2014年1月11日北京大学深圳医院门诊的HBeAg阳性CHB患者32例,所有患者按2∶1中央随机分为派格宾治疗组(22例)和派罗欣治疗组(10例),分别使用Peg IFNα-2b(派格宾)和Peg IFNα-2a(派罗欣)治疗(180 μg,每周1次,皮下注射),疗程48周,停药后观察24周,期间定期检测HBV标志物、HBV DNA载量和肝功能。根据是否发生HBeAg血清学转换和HBV DNA载量判断抗病毒疗效,并追踪临床试验期间观察到的不良事件和严重不良事件。采用Fisher确切概率法比较两组的疗效和不良反应发生率。
治疗结束时及随访24周,派格宾治疗组和派罗欣治疗组的ALT复常率、HBV DNA转阴率和HBeAg血清学转换率比较差异均无统计学意义(P值均>0.05)。两组不良反应发生率差异亦无统计学意义(P>0.05),但派格宾治疗组有7例患者发生视网膜病变,而派罗欣治疗组未发现类似不良反应。
对于HBeAg阳性的CHB患者,派格宾与派罗欣治疗的疗效及安全性相近。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
乙型肝炎病毒(Hepatitis B virus,HBV)是导致人类急性和慢性肝脏疾病的重要病原体。全球约20亿人曾感染HBV,其中3.5亿人为慢性HBV感染者,每年约有100万人死于HBV感染所致的肝衰竭、肝硬化和原发性肝癌(Hepatocellur carcinoma,HCC)[1]。干扰素α(IFNα)是IFN中最早运用于抗HBV感染的药物,具有抗病毒和免疫调节功能。IFN的抗病毒作用比较广泛,对于乙型肝炎病毒e抗原(HBeAg)阳性和阴性的患者都有一定的治疗效果,尤其对HBeAg阳性的慢性乙型肝炎(CHB)疗效明显[2]。聚乙二醇干扰素α-2b(Peg IFNα-2b,派格宾)是厦门特宝生物工程股份有限公司研发的长效IFN,在北京大学深圳医院已进行部分Ⅲ期临床观察。为了评估其有效性和安全性,现对在我院的入组病例进行总结分析。
选择2013年11月1日至2014年1月11日北京大学深圳医院门诊的HBeAg阳性CHB患者。纳入标准:(1)符合《慢性乙型肝炎防治指南》(2012年版)》中CHB的诊断标准[3];(2)自愿入组;(3)年龄18~65岁;(4)体重指数(BMI)为17~28;(5)HBV DNA≥2×104 IU/mL,筛选时停用护肝降酶药至少2周,且2×ULN≤ALT≤10×ULN;(6)受试者(包括男性受试者)自愿在未来18个月内无妊娠计划且采取有效避孕措施;(7)血常规正常。排除标准:(1)育龄妇女尿妊娠试验阳性;(2)合并其他类型病毒性肝炎或HIV感染;(3)妊娠、哺乳及其他系统疾病史;(4)筛选前6个月内未接受过核苷(酸)类药物治疗或曾有核苷(酸)类药物耐药史;(5)筛选前6个月内使用过强力免疫调节剂(如肾上腺皮质激素、胸腺肽α1、胸腺五肽等)超过2周;(6)筛选前6个月内服用过肝脏毒性药物(如氨苯砜、红霉素、氟康唑、酮康唑、利福平等)超过2周;(7)无神经、精神疾病。本研究是一个前瞻性、开放性的临床研究,遵循赫尔辛基宣言和中国有关临床试验相关法规,研究方案在试验开始前得到北京大学深圳医院伦理委员会审议及批准(北大深医伦审【2013】第(014)号)。每例患者在入选研究前均自愿签署知情同意书。
符合入选标准的患者,经中心实验室复核合格,采用中央随机(交互式网络响应系统,IWRS)按2∶1将患者随机分配至派格宾治疗组或Peg IFNα-2a(派罗欣)治疗组。派格宾治疗组使用Peg IFNα-2b注射液180 μg,派罗欣治疗组使用Peg IFNα-2a注射液180 μg,均为皮下注射,每周1次,治疗48周,停药后继续随访24周。
分别于筛选、基线、治疗12周、24周、48周和第72周(停药随访24周)时留取血液样本用于HBV DNA定量和HBV标志物检测。根据是否发生HBeAg血清学转换和HBV DNA载量判定抗病毒疗效。应答分为生化学应答、HBeAg转换率、病毒学应答。生化学应答:ALT复常。HBeAg转换率:HBeAg阳性患者发生HBeAg转阴,同时出现抗-HBe。病毒学应答:治疗过程中,血清HBV DNA低于检测下限(≤20 IU/mL,HBV DNA转阴)。
药物安全性监测包括临床试验期间观察到的不良事件和严重不良事件、实验室检查及生命体征在治疗前后的变化。
使用SPSS 16.0软件进行统计学分析。服从正态分布的计量资料用 ±s表示,采用t检验,偏态分布的资料用四分位数M(P25~P75)表示,用秩和检验;计数资料用例数和(或)百分比表示,用Fisher确切概率法检验;P<0.05为差异具有统计学意义。
±s表示,采用t检验,偏态分布的资料用四分位数M(P25~P75)表示,用秩和检验;计数资料用例数和(或)百分比表示,用Fisher确切概率法检验;P<0.05为差异具有统计学意义。
入组患者33例,脱落2例,脱落率为6.06%。脱落的原因是患者不愿意继续随访。33例患者中,1例用药前即脱落,最后32例纳入研究,其中派格宾治疗组22例,派罗欣治疗组10例。两组性别构成、年龄、基因型分布、肝功能、HBsAg、HBeAg、HBV DNA水平等指标差异均无统计学意义(表1)。
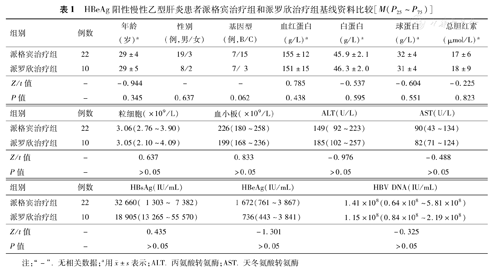
HBeAg阳性慢性乙型肝炎患者派格宾治疗组和派罗欣治疗组基线资料比较[M(P25~P75)]
HBeAg阳性慢性乙型肝炎患者派格宾治疗组和派罗欣治疗组基线资料比较[M(P25~P75)]
| 组别 | 例数 | 年龄(岁)a | 性别(例,男/女) | 基因型(例,B/C) | 血红蛋白(g/L)a | 白蛋白(g/L)a | 球蛋白(g/L)a | 总胆红素(μmol/L)a |
|---|---|---|---|---|---|---|---|---|
| 派格宾治疗组 | 22 | 29±4 | 19/3 | 7/15 | 155±12 | 45.9±2.1 | 32±4 | 17±6 |
| 派罗欣治疗组 | 10 | 29±5 | 8/2 | 7/ 3 | 151±15 | 46.3±2.0 | 31±4 | 18±9 |
| Z/t值 | - | -0.944 | - | - | 0.785 | -0.537 | -0.604 | -0.225 |
| P值 | - | 0.345 | 0.637 | 0.062 | 0.438 | 0.595 | 0.551 | 0.823 |
| 组别 | 例数 | 粒细胞(×109/L) | 血小板(×109/L) | ALT(U/L) | AST(U/L) |
|---|---|---|---|---|---|
| 派格宾治疗组 | 22 | 3.06(2.76~3.90) | 226(180~258) | 149( 92~223) | 90(43~134) |
| 派罗欣治疗组 | 10 | 3.05(2.10~4.09) | 199(168~236) | 185(102~257) | 82(71~124) |
| Z/t值 | - | 0.637 | 0.833 | -0.976 | -0.488 |
| P值 | - | >0.05 | >0.05 | >0.05 | >0.05 |
| 组别 | 例数 | HBsAg(IU/mL) | HBeAg(IU/mL) | HBV DNA(IU/mL) |
|---|---|---|---|---|
| 派格宾治疗组 | 22 | 32 660( 1 303~ 7 382) | 1 672(761~3 867) | 1.41×108(0.64×108~5.81×108) |
| 派罗欣治疗组 | 10 | 18 905(13 265~55 570) | 736(443~3 841) | 1.15×108(0.84×108~2.19×108) |
| Z/t值 | - | 0.435 | -1.301 | -0.325 |
| P值 | - | >0.05 | >0.05 | >0.05 |
注:"-" .无相关数据;a用 ±s表示;ALT.丙氨酸转氨酶;AST.天冬氨酸转氨酶
±s表示;ALT.丙氨酸转氨酶;AST.天冬氨酸转氨酶
派格宾治疗组与派罗欣治疗组治疗及随访期间的ALT复常情况见表2,两组各时间ALT复常率比较差异无统计学意义(P>0.05)。
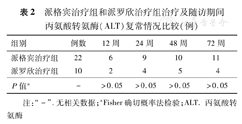
派格宾治疗组和派罗欣治疗组治疗及随访期间丙氨酸转氨酶(ALT)复常情况比较(例)
派格宾治疗组和派罗欣治疗组治疗及随访期间丙氨酸转氨酶(ALT)复常情况比较(例)
| 组别 | 例数 | 12周 | 24周 | 48周 | 72周 |
|---|---|---|---|---|---|
| 派格宾治疗组 | 22 | 6 | 9 | 10 | 11 |
| 派罗欣治疗组 | 10 | 2 | 4 | 5 | 4 |
| P值a | - | >0.05 | >0.05 | >0.05 | >0.05 |
注:"-" .无相关数据;aFisher确切概率法检验;ALT.丙氨酸转氨酶
派格宾治疗组与派罗欣治疗组治疗及随访期间的HBV DNA转阴情况见表3,两组各时间点HBV DNA转阴率比较差异无统计学意义(P>0.05)。
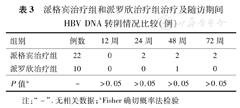
派格宾治疗组和派罗欣治疗组治疗及随访期间HBV DNA转阴情况比较(例)
派格宾治疗组和派罗欣治疗组治疗及随访期间HBV DNA转阴情况比较(例)
| 组别 | 例数 | 12周 | 24周 | 48周 | 72周 |
|---|---|---|---|---|---|
| 派格宾治疗组 | 22 | 0 | 2 | 2 | 2 |
| 派罗欣治疗组 | 10 | 0 | 0 | 1 | 0 |
| P值a | - | >0.05 | >0.05 | >0.05 | >0.05 |
注:"-" .无相关数据;aFisher确切概率法检验
派格宾治疗组与派罗欣治疗组治疗及随访期间的血清学应答情况见表4,两组各时间点HBeAg血清学转换率比较差异无统计学意义(P>0.05)。
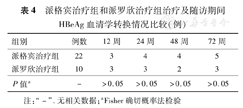
派格宾治疗组和派罗欣治疗组治疗及随访期间HBeAg血清学转换情况比较(例)
派格宾治疗组和派罗欣治疗组治疗及随访期间HBeAg血清学转换情况比较(例)
| 组别 | 例数 | 12周 | 24周 | 48周 | 72周 |
|---|---|---|---|---|---|
| 派格宾治疗组 | 22 | 3 | 4 | 4 | 5 |
| 派罗欣治疗组 | 10 | 3 | 3 | 2 | 3 |
| P值a | - | >0.05 | >0.05 | >0.05 | >0.05 |
注:"-" .无相关数据;aFisher确切概率法检验
两组治疗过程中最常见的不良反应有乏力、发热、脱发、肌肉酸痛等,派格宾组分别为16、18、8和7例,派罗欣组分别为7、7、4和5例,其中派格宾治疗组有7例患者发生视网膜病变,其中1例患者因症状严重停药1个月。两组患者各种不良反应的发生率比较差异无统计学意义(P>0.05),见表5。
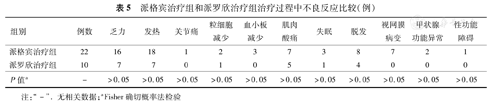
派格宾治疗组和派罗欣治疗组治疗过程中不良反应比较(例)
派格宾治疗组和派罗欣治疗组治疗过程中不良反应比较(例)
| 组别 | 例数 | 乏力 | 发热 | 关节痛 | 粒细胞减少 | 血小板减少 | 肌肉酸痛 | 失眠 | 脱发 | 视网膜病变 | 甲状腺功能异常 | 性功能障碍 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 派格宾治疗组 | 22 | 16 | 18 | 1 | 2 | 3 | 7 | 3 | 8 | 7 | 2 | 1 |
| 派罗欣治疗组 | 10 | 7 | 7 | 0 | 1 | 0 | 5 | 1 | 4 | 0 | 0 | 0 |
| P值a | - | >0.05 | >0.05 | >0.05 | >0.05 | >0.05 | >0.05 | >0.05 | >0.05 | >0.05 | >0.05 | >0.05 |
注:"-" .无相关数据;aFisher确切概率法检验
尽管CHB的抗病毒治疗已经经历了20年的发展,但目前仍面临许多难题。IFN具有免疫调节作用,可以提高宿主细胞介导的免疫功能,有助于清除病毒和实现HBeAg血清学转换,从而降低肝癌的发生,提高患者的生存率,因此往往作为年轻初治患者的首选治疗药物。许多研究证实,长效IFN的疗效优于普通IFN。但在中国,由于经济原因,许多患者仍只能选择普通IFN治疗,影响了疗效。派格宾是厦门特宝生物工程股份有限公司生产的Y型Peg化重组人IFN 2b,是治疗用生物制品Ⅰ类新药,已经完成Ⅰ期和Ⅱ期临床试验,目前正在进行Ⅲ期临床试验。本研究为该药物Ⅲ期临床试验的一部分。
对于IFN治疗的疗效,一般通过应答率来评估。抗病毒治疗应答包括血清学应答(包括HBsAg转换率和HBeAg血清学转换率)、病毒学应答、生化学应答和组织学应答,但由于患者一般不接受二次肝脏穿刺活检,因此很难进行组织学应答观察,临床上一般以前三种应答为主要疗效判定指标。既往研究报道[4],派罗欣180 μg每周1次,治疗48周的HBeAg血清学转换率为32%,HBV DNA转阴率为32%,ALT复常率为41%。如果12周时HBsAg下降>1 500 IU/mL,HBeAg血清学转换率可以升高到58%;24周时HBsAg下降>1 500 IU/mL, HBeAg血清转换率可以升高到57%。2005年发表在新英格兰杂志上的一项多中心研究结果显示[5],派罗欣治疗48周后有27%的病例发生HBeAg血清学转换,52%的病例HBV DNA载量<105拷贝/mL,25%的病例HBV DNA载量<400拷贝/mL,39%的病例ALT复常;在治疗72周后,32%的病例发生HBeAg血清学转换,2%的病例发生HBV DNA<105拷贝/mL,14%的病例HBV DNA载量<400拷贝/mL,41%的患者ALT复常。发生联合应答,即同时发生HBV DNA <105拷贝/mL、ALT复常及HBeAg血清学转换的病例,在治疗48周时有10%,在治疗72周时有23%。本研究中派格宾治疗组和派罗欣治疗组治疗结束时及随访24周时的HBeAg血清学转换率、病毒学和生化学应答情况比较差异均无统计学意义,提示两种药物的疗效基本一致。但与上述研究结果比较,本研究中无论派格宾治疗组还是派罗欣治疗组,治疗结束时及随访24周时的血清学、病毒学和生化学应答率均偏低,考虑可能是因为本研究中的病例HBV DNA载量普遍较高而ALT水平不高有关。而既往研究表明,高ALT水平,低HBV DNA载量的患者具有较高的应答率[6,7]。关于IFN治疗后停药复发的问题,之前的研究一般统计的是停药后2年的复发率,而本研究观察时间尚短(目前仅观察至停药后24周),遂未进行统计。
既往研究发现,IFN治疗过程中的不良反应发生率比较高,其中较为常见的有流感样症候群、乏力、骨髓抑制、自身免疫疾病加重、性功能障碍等,需要密切监测[8,9]。本研究结果显示,派格宾和派罗欣治疗过程中常见的不良反应有乏力、发热、脱发、肌肉酸痛等,与之前关于IFN治疗中不良反应的报道基本一致。既往研究报道,Peg IFN治疗可以加重丙型肝炎患者性功能障碍,包括性欲下降,勃起障碍等,是常见的不良反应之一,但结束治疗往往可以恢复[10]。本研究中,一例患者出现勃起障碍,停药1个月后功能恢复,后治疗剂量减为135 μg每周一次,直至疗程结束,未诉再次出现症状。
需要注意的是,本研究中发现派格宾治疗组有7例患者在治疗过程中发生视网膜病变,而派罗欣治疗组未发现此不良反应。既往研究报道,IFN治疗的丙型肝炎患者中,37.5%的病例出现视网膜病变,其中,12.5%的患者出现视网膜出血,6.5%的患者出现一过性视力下降,治疗结束后均可逐渐恢复[11]。本研究中,对于视网膜病变的患者,我们均请眼科医师会诊,并在下一次给药前对其进行眼底复查。对于严重的视网膜病变,比如出现出血、视力下降或症状加重者,予停药观察,恢复后继续给药,其中1例患者停药时间长达1个月。虽然本研究中视网膜病变的发生率在两组间的差异无统计学意义,但仍值得临床医师重视。至于派格宾是否较派罗欣更容易引发视网膜病变,需要扩大样本量进一步观察。
综上所述,对于HBeAg阳性的CHB患者,派格宾与派罗欣治疗的疗效和安全性相近,但派格宾是我国的一类新药,拥有我国自主的知识产权,预计其上市后的价格会较派罗欣优惠一些,让我国更多的患者能够使用PegIFN治疗。
利益冲突 无



























