
观察加倍剂量替加环素治疗呼吸机相关性肺炎(VAP)的有效性和安全性。
连续收集2012年2月至2015年12月浙江省人民医院急诊重症监护病房(EICU)收治的使用替加环素治疗的71例VAP患者的临床资料,并进行回顾性分析,其中31例接受标准剂量替加环素治疗(50 mg,1次/12 h),40例接受加倍剂量替加环素治疗(100 mg,1次/12 h),采用t(秩和)检验或χ2检验对两组患者抗菌药物使用情况、临床疗效、微生物检出和清除及安全性等指标进行比较。同时将71例VAP患者分为临床治愈(34例)和临床失败(37例),采用多因素Logistic回归分析影响临床疗效的相关因素。
替加环素标准剂量组和加倍剂量组在单独使用替加环素和联合使用其他抗菌药物方面差异均无统计学意义(P>0.05),加倍剂量组的临床治愈率(24/40,60%)高于标准剂量组(10/31,32.3%)(χ2=5.386,P<0.05)。检出71株细菌,其中以鲍曼不动杆菌(42株)和肺炎克雷伯菌(17株)检出最多,加倍剂量组的细菌清除率(20/40,50.0%)高于标准剂量组(8/31,25.8%)(χ2=4.280,P<0.05)。Logistic回归分析发现,使用加倍剂量替加环素(OR=0.322,95%CI:0.105~0.989)是VAP患者临床治愈的独立预测因素,而不正确的初始抗菌药物治疗(OR=8.207,95% CI:1.802~37.367)则是临床治疗失败的预测因素。两组血尿素氮、血肌酐、丙氨酸转氨酶、总胆红素、血红蛋白及血小板等指标在治疗前后差异均无统计学意义(P>0.05)。
加倍剂量替加环素治疗能提高VAP患者的临床治愈率,而不正确的初始抗菌药物治疗会导致治疗失败。两种剂量替加环素均具有良好的安全性。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
呼吸机相关性肺炎(Ventilator-associated pneumonia,VAP)是重症监护病房(ICU)机械通气患者最常见的并发症,病死率可高达50%~70%[1]。抗菌药物的不合理使用不仅会增加VAP的病死率,还会增加多重耐药菌(Multi-drug resistant bacteria,MDRO)感染的机会。替加环素(Tigecycline)是第一个应用于临床的新一代甘氨酰环素,对革兰阳性菌、阴性菌及厌氧菌均具有良好的抗菌活性。由于缺乏其他有效的抗菌药物,替加环素常被用于治疗MDRO感染的重症患者。鉴于血药浓度-时间曲线下面积(AUC)/最低抑菌浓度(MIC)是替加环素抗菌活性的主要决定因素,加倍剂量替加环素(200 mg/d)可增强药物的抗菌能力[2]。本研究回顾性分析在急诊ICU(EICU)中应用加倍剂量替加环素治疗VAP患者的疗效,探讨其有效性和安全性。
选择2012年2月至2015年12月浙江省人民医院EICU收治住院并接受替加环素治疗的VAP患者71例,其中男性56例,女性15例。VAP诊断符合2013年中华医学会重症医学分会《呼吸机相关性肺炎诊断、预防和治疗指南》中的标准[3],即气管插管或气管切开患者在接受机械通气48 h后出现新发的或进展性的影像学肺部浸润,其诊断同时满足下述至少2项:(1)体温>38℃或<36℃;(2)外周血白细胞计数>10×109/L或<4×109/L;(3)气管支气管内出现脓性分泌物。根据发病时间,可分为早发VAP(发生在机械通气≤ 4 d)和晚发VAP(发生在机械通气≥5 d);同时排除无病原学依据、经验性治疗及替加环素疗程不足72 h的病例。31例接受标准剂量替加环素治疗(标准剂量组),即首次负荷剂量为静脉滴注100 mg,随后50 mg,1次/12 h;40例接受加倍剂量替加环素治疗(加倍剂量组),即首次负荷剂量为静脉滴注200 mg,随后100 mg,1次/12 h。研究方案经医院伦理委员会批准(2016KY003)。
收集相关临床资料,包括年龄、性别、基础疾病、入住EICU的原因、感染发生时间、抗菌药物治疗、微生物学资料及疗效;感染严重程度根据感染发生时的序贯器官衰竭评分(SOFA)、是否有脓毒性休克及急性肾损伤来评估;记录治疗前后血常规及生化各项指标来评估安全性。当痰培养药敏试验结果出来之前使用的抗菌药物,没有包含在之后体外药敏试验证实为敏感的抗菌药物中时,则定义为不正确的初始抗菌药物治疗(Inadequate initial antimicrobial treatment,IIAT)。
所有病例均经气管导管采用一次性痰液收集器直接从下呼吸道收集痰液样本或在纤维支气管镜下吸痰,获得样本进行定量培养,以定量培养分离细菌菌落计数≥105CFU/mL为阳性阈值,连续2次培养为同一细菌则确认为病原菌。药敏试验结果的判定遵循《替加环素体外药敏试验操作规程专家共识》[4]:替加环素对鲍曼不动杆菌及肠杆菌科细菌的MIC≤ 2mg/L为敏感,4 mg/L为中介,≥8 mg/L为耐药;对葡萄球菌属细菌的MIC≤0.5mg/L为敏感,>0.5 mg/L为耐药。MDRO是指对临床使用的三类或三类以上抗菌药物同时呈现耐药的细菌[5]。
参考文献[6,7],将疗效评估分为(1)临床疗效:分为临床治愈(症状和体征完全消退,且在肺部影像学上改善或无进展)和临床失败(症状或体征无改善或恶化、在肺部影像学上有进展而需要更换为其他抗生素);(2)微生物学疗效:分为清除(治疗结束时痰培养中未发现原病原菌)和未清除(培养结果持续阳性或出现二重感染)。
使用SPSS 13.0软件处理数据。正态分布的计量资料以 ±s表示,组间比较采用t检验;偏态分布的计量资料以中位数(M)及四分位数间距(Q75~Q25)表示,采用秩和检验。计数资料以例数(%)表示,采用χ2检验。对可能影响临床治愈的相关因素先进行单因素分析,对其中差异有统计学意义的进行多因素Logistic回归分析。P<0.05为差异具有统计学意义。
±s表示,组间比较采用t检验;偏态分布的计量资料以中位数(M)及四分位数间距(Q75~Q25)表示,采用秩和检验。计数资料以例数(%)表示,采用χ2检验。对可能影响临床治愈的相关因素先进行单因素分析,对其中差异有统计学意义的进行多因素Logistic回归分析。P<0.05为差异具有统计学意义。
接受标准剂量和加倍剂量替加环素治疗的VAP患者在年龄、性别、发生感染时的疾病严重程度、入住EICU的原因、早发VAP/晚发VAP和基础疾病方面差异均无统计学意义(P>0.05)(表1)。
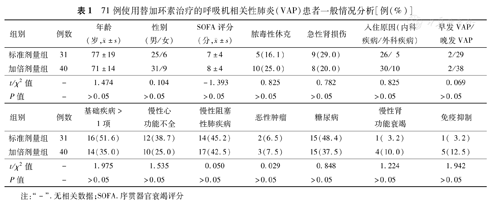
71例使用替加环素治疗的呼吸机相关性肺炎(VAP)患者一般情况分析[例(%)]
71例使用替加环素治疗的呼吸机相关性肺炎(VAP)患者一般情况分析[例(%)]
| 组别 | 例数 | 年龄(岁, ±s) ±s) | 性别(男/女) | SOFA评分(分, ±s) ±s) | 脓毒性休克 | 急性肾损伤 | 入住原因(内科疾病/外科疾病) | 早发VAP/晚发VAP |
|---|---|---|---|---|---|---|---|---|
| 标准剂量组 | 31 | 77±19 | 25/6 | 7±4 | 5(16.1) | 9(29.0) | 26/ 5 | 2/29 |
| 加倍剂量组 | 40 | 71±14 | 31/9 | 8±4 | 10(25.0) | 8(20.0) | 30/10 | 2/38 |
| t/χ2值 | - | 1.474 | 0.104 | -1.393 | 0.825 | 0.782 | 0.825 | 0.069 |
| P值 | - | >0.05 | >0.05 | >0.05 | >0.05 | >0.05 | >0.05 | >0.05 |
| 组别 | 例数 | 基础疾病>1项 | 慢性心功能不全 | 慢性阻塞性肺疾病 | 恶性肿瘤 | 糖尿病 | 慢性肾功能衰竭 | 免疫抑制 |
|---|---|---|---|---|---|---|---|---|
| 标准剂量组 | 31 | 16(51.6) | 12(38.7) | 14(45.2) | 2(6.5) | 15(48.4) | 1( 3.2) | 1( 3.2) |
| 加倍剂量组 | 40 | 14(35.0) | 10(25.0) | 17(42.5) | 3(7.5) | 15(37.5) | 4(10.0) | 5(12.5) |
| t/χ2值 | - | 1.975 | 1.535 | 0.050 | 0.029 | 0.848 | 1.224 | 1.942 |
| P值 | - | >0.05 | >0.05 | >0.05 | >0.05 | >0.05 | >0.05 | >0.05 |
注: "-" .无相关数据;SOFA.序贯器官衰竭评分
表2显示标准剂量组和加倍剂量组患者在替加环素单药及联合其他抗菌药物治疗上差异均无统计学意义(P>0.05);标准剂量组和加倍剂量组各有23例(74.2%)和34例(85.0%)存在IIAT,两组间差异无统计学意义(χ2=1.288,P>0.05)。
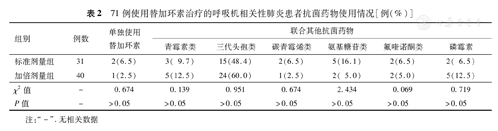
71例使用替加环素治疗的呼吸机相关性肺炎患者抗菌药物使用情况[例(%)]
71例使用替加环素治疗的呼吸机相关性肺炎患者抗菌药物使用情况[例(%)]
| 组别 | 例数 | 单独使用替加环素 | 联合其他抗菌药物 | |||||
|---|---|---|---|---|---|---|---|---|
| 青霉素类 | 三代头孢类 | 碳青霉烯类 | 氨基糖苷类 | 氟喹诺酮类 | 磷霉素 | |||
| 标准剂量组 | 31 | 2(6.5) | 3( 9.7) | 15(48.4) | 2(6.5) | 5(16.1) | 2(6.5) | 2( 6.5) |
| 加倍剂量组 | 40 | 1(2.5) | 5(12.5) | 24(60.0) | 1(2.5) | 2( 5.0) | 2(5.0) | 5(12.5) |
| χ2值 | - | 0.674 | 0.139 | 0.951 | 0.674 | 2.434 | 0.069 | 0.719 |
| P值 | - | >0.05 | >0.05 | >0.05 | >0.05 | >0.05 | >0.05 | >0.05 |
注: "-" .无相关数据
检出71株病原菌,其中69株(97.2%)为革兰阴性菌,细菌检出情况见表3。药敏试验显示所有病原菌均为MDRO,有39株(39/42,92.9%)鲍曼不动杆菌对碳青霉烯类耐药。替加环素的药敏试验结果显示,16株菌株为中介,其中14株来自替加环素加倍剂量组,2株来自标准剂量组;2株耐药的鲍曼不动杆菌则全部来自加倍剂量组(表4)。
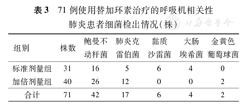
71例使用替加环素治疗的呼吸机相关性肺炎患者细菌检出情况(株)
71例使用替加环素治疗的呼吸机相关性肺炎患者细菌检出情况(株)
| 组别 | 株数 | 鲍曼不动杆菌 | 肺炎克雷伯菌 | 黏质沙雷菌 | 大肠埃希菌 | 金黄色葡萄球菌 |
|---|---|---|---|---|---|---|
| 标准剂量组 | 31 | 16 | 5 | 6 | 4 | 0 |
| 加倍剂量组 | 40 | 26 | 12 | 0 | 0 | 2 |
| 合计 | 71 | 42 | 17 | 6 | 4 | 2 |
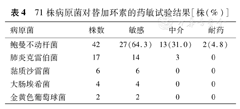
71株病原菌对替加环素的药敏试验结果[株(%)]
71株病原菌对替加环素的药敏试验结果[株(%)]
| 病原菌 | 株数 | 敏感 | 中介 | 耐药 |
|---|---|---|---|---|
| 鲍曼不动杆菌 | 42 | 27(64.3) | 13(31.0) | 2(4.8) |
| 肺炎克雷伯菌 | 17 | 14 | 3 | 0 |
| 黏质沙雷菌 | 6 | 6 | 0 | 0 |
| 大肠埃希菌 | 4 | 4 | 0 | 0 |
| 金黄色葡萄球菌 | 2 | 2 | 0 | 0 |
接受替加环素治疗的VAP患者中,临床治愈34例,治疗失败37例;微生物学清除28例,未清除43例。加倍剂量组的临床治愈率和微生物清除率均较标准剂量组更高(χ2=5.386和4.280,P<0.05)(表5)。
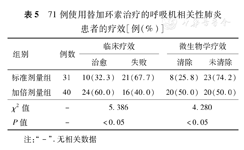
71例使用替加环素治疗的呼吸机相关性肺炎患者的疗效[例(%)]
71例使用替加环素治疗的呼吸机相关性肺炎患者的疗效[例(%)]
| 组别 | 例数 | 临床疗效 | 微生物学疗效 | ||
|---|---|---|---|---|---|
| 治愈 | 失败 | 清除 | 未清除 | ||
| 标准剂量组 | 31 | 10(32.3) | 21(67.7) | 8(25.8) | 23(74.2) |
| 加倍剂量组 | 40 | 24(60.0) | 16(40.0) | 20(50.0) | 20(50.0) |
| χ2值 | - | 5.386 | 4.280 | ||
| P值 | - | <0.05 | <0.05 | ||
注: "-" .无相关数据
将71例VAP患者按临床治愈(34例)和临床失败(37例)分组,单因素分析显示,基础疾病>1项和IIAT阻碍VAP患者临床治愈(χ2=4.410和6.579,P<0.05),而使用加倍剂量替加环素有利于VAP患者临床治愈(χ2=5.386,P<0.05)(表6)。多因素Logistic回归分析显示,加倍剂量替加环素治疗(OR=0.322,95%CI:0.105~0.989)是VAP患者临床治愈的独立预测因素,而IIAT(OR= 8.207,95%CI:1.802~37.367)则是临床治疗失败的危险因素(表7)。
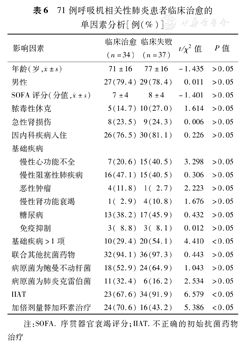
71例呼吸机相关性肺炎患者临床治愈的单因素分析[例(%)]
71例呼吸机相关性肺炎患者临床治愈的单因素分析[例(%)]
| 影响因素 | 临床治愈(n=34) | 临床失败(n=37) | t/χ2值 | P值 | |
|---|---|---|---|---|---|
年龄(岁, ±s) ±s) | 71±16 | 77±16 | -1.435 | >0.05 | |
| 男性 | 27(79.4) | 29(78.4) | 0.011 | >0.05 | |
SOFA评分(分值, ±s) ±s) | 7±4 | 8±4 | -1.401 | >0.05 | |
| 脓毒性休克 | 5(14.7) | 10(27.0) | 1.614 | >0.05 | |
| 急性肾损伤 | 8(23.5) | 9(24.3) | 0.006 | >0.05 | |
| 因内科疾病入住 | 26(76.5) | 30(81.1) | 0.226 | >0.05 | |
| 基础疾病 | |||||
| 慢性心功能不全 | 7(20.6) | 15(40.5) | 3.298 | >0.05 | |
| 慢性阻塞性肺疾病 | 16(47.1) | 15(40.5) | 0.306 | >0.05 | |
| 恶性肿瘤 | 4(11.8) | 1( 2.7) | 2.223 | >0.05 | |
| 慢性肾功能衰竭 | 1( 2.9) | 4(10.8) | 1.676 | >0.05 | |
| 糖尿病 | 13(38.2) | 17(45.9) | 0.432 | >0.05 | |
| 免疫抑制 | 3( 8.8) | 3( 8.1) | 0.012 | >0.05 | |
| 基础疾病>1项 | 10(29.4) | 20(54.1) | 4.410 | <0.05 | |
| 联合其他抗菌药物 | 32(94.1) | 36(97.3) | 0.443 | >0.05 | |
| 病原菌为鲍曼不动杆菌 | 18(52.9) | 24(64.9) | 1.043 | >0.05 | |
| 病原菌为肺炎克雷伯菌 | 11(32.4) | 6(16.2) | 2.534 | >0.05 | |
| IIAT | 23(67.6) | 34(91.9) | 6.579 | <0.05 | |
| 加倍剂量替加环素治疗 | 24(70.6) | 16(43.2) | 5.386 | <0.05 | |
注:SOFA. 序贯器官衰竭评分;IIAT.不正确的初始抗菌药物治疗
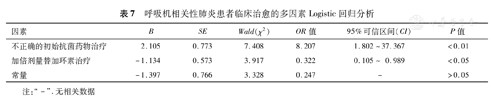
呼吸机相关性肺炎患者临床治愈的多因素Logistic回归分析
呼吸机相关性肺炎患者临床治愈的多因素Logistic回归分析
| 因素 | B | SE | Wald(χ2) | OR 值 | 95%可信区间(CI) | P值 |
|---|---|---|---|---|---|---|
| 不正确的初始抗菌药物治疗 | 2.105 | 0.773 | 7.408 | 8.207 | 1.802~37.367 | <0.01 |
| 加倍剂量替加环素治疗 | -1.134 | 0.573 | 3.917 | 0.322 | 0.105~ 0.989 | <0.05 |
| 常量 | -1.397 | 0.766 | 3.328 | 0.247 | - | >0.05 |
注: "-" .无相关数据
替加环素标准剂量组和加倍剂量组的各项实验室指标在治疗前后的差异无统计学意义(P>0.05)(表8)。同时两组患者在治疗期间均未发现恶心、呕吐等胃肠道症状。
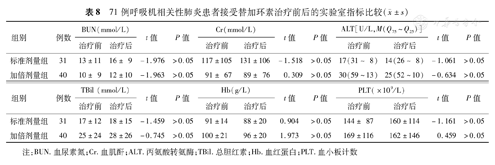
71例呼吸机相关性肺炎患者接受替加环素治疗前后的实验室指标比较( ±s)
±s)
71例呼吸机相关性肺炎患者接受替加环素治疗前后的实验室指标比较( ±s)
±s)
| 组别 | 例数 | BUN(mmol/L) | t值 | P值 | Cr(mmol/L) | t值 | P值 | ALT[U/L,M(Q75~Q25)] | t值 | P值 | |||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 治疗前 | 治疗后 | 治疗前 | 治疗后 | 治疗前 | 治疗后 | ||||||||
| 标准剂量组 | 31 | 13±11 | 16± 9 | -1.976 | >0.05 | 117±105 | 131±106 | -1.518 | >0.05 | 17(31~ 8) | 14(26~ 8) | -1.061 | >0.05 |
| 加倍剂量组 | 40 | 10± 9 | 12±10 | -1.963 | >0.05 | 91± 67 | 89± 76 | 0.309 | >0.05 | 30(59~13) | 25(52~10) | -0.634 | >0.05 |
| 组别 | 例数 | TBil (mmol/L) | t值 | P值 | Hb(g/L) | t值 | P值 | PLT(×109/L) | t值 | P值 | |||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 治疗前 | 治疗后 | 治疗前 | 治疗后 | 治疗前 | 治疗后 | ||||||||
| 标准剂量组 | 31 | 17±12 | 18±15 | -1.459 | >0.05 | 91±14 | 88±20 | 0.904 | >0.05 | 144± 87 | 160±114 | -1.161 | >0.05 |
| 加倍剂量组 | 40 | 25±24 | 28±26 | -0.745 | >0.05 | 100±21 | 96±20 | 1.973 | >0.05 | 169±116 | 162±146 | 0.459 | >0.05 |
注:BUN.血尿素氮;Cr.血肌酐;ALT.丙氨酸转氨酶;TBil.总胆红素;Hb.血红蛋白;PLT.血小板计数
在治疗下呼吸道感染时,抗菌药物的实际效果更取决于其在肺内局部浓度的高低。研究发现,替加环素不仅在感染者肺内的浓度要比健康体检者高[8],且在肺泡细胞和上皮细胞衬液内的浓度要比细胞外液和血清中高[9]。同时替加环素具有广谱抗菌活性,对临床上常见的耐药病原菌,如耐甲氧西林金黄色葡萄球菌、耐万古霉素肠球菌及产超广谱β-内酰胺酶肠杆菌科细菌等均有良好的疗效[10]。因此,尽管美国食品药品监督管理局(FDA)未将VAP列入替加环素治疗的适应证中,但由于替加环素良好的体外活性和肺内高浓度的药代动力学,国外已有使用替加环素治疗VAP感染的研究报道[11,12]。
ICU收治的患者病情危重,存在多种MDRO感染的危险因素,MDRO出现概率高,临床上常用的抗菌药物治疗效果差[13]。Heyland等[14]报道了VAP患者的病死率(当地ICU中平均为20%~55%),在病原菌为MDRO时可升高至76%。本研究分离出的病原菌均为MDRO,其中以鲍曼不动杆菌最多(59.2%)。碳青霉烯类是治疗鲍曼不动杆菌严重感染的常规选择,但碳青霉烯类的耐药性正在不断上升[15],本研究中分离的鲍曼不动杆菌有92.9%(39/42)对碳青霉烯类耐药,鉴于多黏菌素在国内未正式上市及其潜在的肾毒性,替加环素成为治疗MDRO引起的VAP的合适选择,这与专家共识及学者推荐一致[16]。同时药敏试验显示,18株菌株(15株鲍曼不动杆菌,3株肺炎克雷伯菌)对替加环素不敏感(16株为中介,2株为耐药),在治疗对常规剂量替加环素不敏感的MDRO时,临床医师选择性使用了加倍剂量治疗,达到更好的临床效果。
临床诊断为VAP的患者,在超过24 h或在获得微生物学检查结果后再开始抗感染治疗,即使治疗恰当,也会因延误治疗时机导致VAP病死率升高[17]。基于这一原因,临床医师在临床诊断VAP并留取合格的下呼吸道样本送检的同时,会立即给予经验性初始抗菌药物治疗,但初始抗菌药物的选择影响治疗效果。Luna等[18]的研究早已证实,即使在48~72 h后根据药敏试验结果改变抗菌药物治疗方案,其治疗效果与继续IIAT没有差别。本次研究通过对VAP患者进行多因素Logistic回归分析,发现IIAT是预测临床治疗失败的独立危险因素,说明一旦VAP诊断明确,初始抗菌药物的选择对于能否成功治疗感染十分重要,而IIAT将导致VAP治疗失败、医疗费用增加、机械通气时间和住院天数延长。
一项全球性临床Ⅱ期多中心、随机双盲研究比较了加倍剂量替加环素与亚胺培南/西司他丁治疗医院获得性肺炎患者的疗效和安全性,结果发现加倍剂量替加环素的临床治愈率不仅高于亚胺培南/西司他丁,而且还优于标准剂量替加环素[12]。本研究结果也证实了加倍剂量替加环素的有效性,其在VAP患者中的临床治愈率和微生物清除率分别为60.0%和50.0%,均较标准剂量组高(χ2=5.386和4.280,P<0.05);使用加倍剂量替加环素治疗是本研究发现的唯一预测临床治愈的独立因素(OR=0.322),再次证明了加倍剂量替加环素治疗VAP的重要意义。考虑到替加环素是抑菌剂以及可能出现的二重感染,所以即使体外药敏试验为敏感,标准剂量组和加倍剂量组中联合其他抗菌药物治疗的比例仍分别高达93.5%(29/31)和97.5%(39/40),因此我们无法对加倍剂量替加环素的单药治疗得出任何结论。
在已发表的临床试验中[19,20],恶心和呕吐是替加环素最主要的不良反应,还有少数患者可能出现以高胆红素血症为表现的肝功能异常。而使用剂量加倍可能会增加不良反应的发生率,以及增加停药风险。但由于本次研究的对象均已行机械通气且使用药物镇静,因此两组患者在治疗期间均未观察到恶心或呕吐等不良反应;且通过比较患者治疗前后的血常规及生化指标(包括BUN、Cr、ALT、TBil、Hb及PLT),发现两组患者的各项指标在治疗前后的差异无统计学意义,表明标准剂量及加倍剂量的替加环素均未造成肝、肾功能损害,因此VAP患者使用加倍剂量替加环素是安全可行的。尽管如此,在临床使用时应充分认识到替加环素的不足之处,即对铜绿假单胞菌、变形杆菌属和普罗威登斯菌属为天然耐药[21],对于怀疑为铜绿假单胞菌感染的患者应考虑其他药物治疗。
综上所述,IIAT会导致VAP治疗失败,因此初始抗菌药物的选择十分关键,临床上可以考虑具有广谱抗菌活性的替加环素;而加倍剂量的替加环素在临床治愈率及微生物清除率上均高于标准剂量组,且具有良好的安全性。本研究也有不足之处,比如为回顾性分析、未能监测血药浓度、无法对替加环素单药使用进行评估等,因此有待进一步的多中心、大样本及前瞻性的研究。
利益冲突 无



























