
探讨聚合酶链反应(Polymerase chain reaction,PCR)-荧光探针法在检测丙型肝炎病毒(HCV)基因型中的应用价值。
随机选择2016年3月至6月来自全国各地的166例慢性HCV感染者血清样本,采用逆转录巢式PCR扩增HCV的Core-E1(CE1)基因区域和测序、系统发育树分析确定基因亚型,并采用PCR-荧光探针法对HCV基因型进行检测。采用Kappa检验对两种方法测得的HCV分型结果进行比较。
巢式PCR测序法共分型166例,其中1b型66例(39.8%),2a型34例(20.5%),3a型16例(9.6%),3b型为27例(16.2%),6a型23例(13.9%);PCR-荧光探针法共分型166例,其中1b型68例(41.0%),2a型34例(20.5%),3a型16例(9.6%),3b型25例(15.0%),6a型23例(13.9%)。PCR-荧光探针法分型中的2例1b型,测序法分型为3b型,两种方法检测一致率为98.7% (164/166),差异无统计学意义(χ2=0.0492,P>0.05)。
PCR-荧光探针法对我国常见的HCV基因型鉴定准确率高,在临床上值得推广应用。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
据世界卫生组织(WHO)统计,目前全球有将近1.85亿人感染丙型肝炎病毒(HCV),每年新发丙型肝炎病例约3.5万例[1]。慢性丙型肝炎(Chronic hepatitis C,CHC)的主要治疗措施为抗HCV治疗,通过抗HCV延缓慢性肝炎的进展,从而降低HCV相关性肝硬化、肝衰竭及肝细胞癌的发生,减少HCV相关的医疗支出和病死率,达到改善患者生活质量的目标[2]。影响抗病毒治疗效果的因素较多,HCV不同基因型与干扰素、直接抗病毒药物(Directly acting antiviral agents, DAAs)的抗病毒效果有一定相关性[3,4,5,6]。因此,检测HCV的基因型和基因亚型,在确定抗病毒治疗药物剂量和疗程、疗效判断方面具有重要指导意义[2]。全基因组测序是HCV分型的金标准,但HCV全基因组扩增、测序难度大,通常可依据Core-E1区或NS5B区作为判定[7]。本研究随机选择166例来自全国16个省市的慢性HCV感染者样本,分别使用巢式聚合酶链反应(PCR)测序法和PCR-荧光探针法进行HCV基因分型,比较两种方法的检测结果,以评估PCR-荧光探针法在检测我国HCV常见基因型中的价值。
本研究的166份血清样品来自按数字表法随机抽取的2016年3月至6月到广州金域医学检验中心的慢性HCV感染者(病史至少半年),患者分别来自我国16个省市:华东地区26例(上海市2例、江苏省13例、安徽省11例),华南地区48例(广东省23例、广西省10例、海南省11例、福建省4例),华北地区30例(天津市10例、河北省10例、山东省10例),华中地区10例(湖南省10例),西南地区31例(云南省10例、贵州省11例、四川省10例),西北地区10例(陕西省10例),东北地区11例(沈阳市11例)。其中男性51例,女性40例,年龄21~70岁,平均为(49± 19)岁,HCV RNA载量为(2.12×104~4.32×105)拷贝/mL。诊断符合中华医学会肝病学分会、中华医学会感染病学分会《丙型肝炎防治指南(2015更新版)》[2]中的标准。采集患者血液2 mL后分离血清,-80℃保存。
采用实时荧光定量(RQ-PCR)法,由中山达安基因公司生产的HCV荧光定量PCR试剂盒检测,灵敏度为80拷贝/mL(具体操作详见说明书)。
采用QIAamp®Viral RNA Mini Kit试剂盒提取RNA,逆转录试剂盒采用Promega公司产品Invitrogen,具体操作详见说明书。
本研究的PCR引物见表1,采取巢式PCR扩增策略。引物由上海英滩捷基贸易有限公司合成。PCR扩增采用TaKaRa的TaqTM PCR试剂盒;PCR产物纯化采用QIAquick®PCR Purification Kit;PCR产物切胶回收采用QIAquick®Gel Extraction Kit。仪器有酶标仪Bio-Rad;Prism 7000型PCR仪(ABI公司);DNA测序使用ABI Prism®3500(ABI公司)测序仪和BigDye®Terminator v3.1(具体操作详见说明书)。PCR按下列程序条件扩增:95℃ 2 min, 95℃20 s,55℃ 30 s,72℃ 40 s,30个循环;94℃7 min。

HCV Core-E1序列巢式聚合酶链反应扩增引物
HCV Core-E1序列巢式聚合酶链反应扩增引物
| 引物名称 | 引物序列 | 引物结合位点(nt) | 片断长度(bp) |
|---|---|---|---|
| HCV-Core-E1-F1 | 5′-GCAACAGGGAACCTTCCTGGTTGCTC-3′ | 834~859 | 495 |
| HCV-Core-E1-R1 | 5′-CGTAGGGGACCAGTTCATCATCAT-3′ | 1 305~1 328 | |
| HCV-Core-E1-F2 | 5′-AACCTTCCTGGTTGCTCTTTCTCTAT-3′ | 846~868 | 474 |
| HCV-Core-E1-R2 | 5′-GTTCATCATCATATCCCATGCCAT-3′ | 1 293~1 316 |
注:引物结合位点均以HCV参考株AF009606为准
使用BioEdit 7.0.9软件、MEGA 6.0软件对获得的166株序列进行校对、保存和转换成.meg文件,并采用最大似然法(Maximum likelihood method)构建系统进化树。选取GenBank中10株代表已知基因型的HCV病毒株全序列作为对照(对照的Core-E1序列在基因库中的编号:1a.H77.AF011751,1b.JP.ABO16785,2a.JFH- 1.AB047639,2b.HC.J8.D10988,3a.ZS633.KC844041,3b.Tr.D49374,4a.ED43.NC009825,5a.EUH1480.Y13184,6a.EUHK2.Y12083,7a.QC69.EF108306),从而获得基因型分型情况。
采用福建泰普生物科学公司的商品化的HCV基因分型检测试剂盒进行的RT-PCR试剂盒和核酸提取试剂盒检测,PCR及结果分析使用ABI Prism实时荧光PCR(型号7500)及配套软件7500 System SDS Software Version 1.4。
吸取600 μL RNA提取液1转入洁净的1.5 mL离心管,再加入100 μL临床样本,迅速振荡混匀,室温静置5 min。按照说明书要求,加入500 μL RNA提取液2,迅速振荡混匀,转移至RNA纯化柱的吸附柱中,室温下7 104×g离心1 min(2次);先后往吸附柱中加入500 μL RNA提取液3、RNA提取液4、RNA提取液5,分别在室温下7 104×g离心1 min;最后将RNA纯化柱收集管中的液体倒掉,将吸附管装回收集管中,室温下15 984×g离心1 min,丢弃RNA纯化柱的收集管,将RNA纯化柱的吸附管放入到洁净的RNA收集管中;最后往吸附管中央滴加35 μL RNA提取液6,室温静置2 min后,15 984×g离心2 min。收集流穿液,-20℃保存备用。
往40 μL各组HCV反应液(1b亚型组、2a/6a亚型组和3a/3b亚型组)中分别加入样本或质控品的RNA提取产物各10 μL,总反应体积50 μL;然后将待测PCR反应管小心置于PCR扩增检测仪中。按下列程序条件扩增:42℃ 30 min; 95℃ 3 min; 94℃ 20 s,55℃ 20 s,72℃ 30 s,10个循环;94℃ 15 s,60℃ 45 s,30个循环。荧光探针参数设置:所有检测孔均设置为FAM-TAMRA和JOE-TAMRA,在60℃ 45 s阶段收集荧光信号。
反应结束后,根据分析后图像调节基线的开始、结束以及阈值。点击分析自动获得分析结果,在报告界面查看结果。
采用SPSS 17.0软件进行数据处理。两种分型方法的比较采用Kappa检验,以P<0.05为差异具有统计学意义。
巢式PCR测序法共分型的166例,1b型66例(39.8%),2a型34例(20.5%),3a型16例(9.6%),3b型27例(16.2%),6a型23例(13.9%)。其中,1b型分布于华南、华北、华东、西南及华中地区;2a型分布于华南、华北、华东及东北地区;3a型分布于华南、西南、西北、东北及西北地区;3b型分布于华南、华东、西南及华北地区;6a型分布于华南、西南及华中地区。HCV基因系统进化树分析见图1。
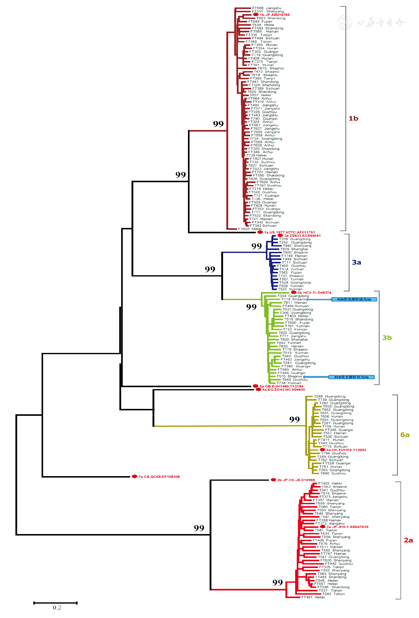

注:系统发育树包含了166个来自16个省市的Core-E1区序列和10个确定的HCV 1-7型参考序列(红色,参考序列均有GenBank号码)。不同的基因亚型以不同颜色表示,并在右边注明样本名称及来源地,Bootstrap值在每个亚型簇前标识
PCR-荧光探针法共分型166例,其中1b型68例(41.0%),2a型34例(20.5%),3a型16例(9.6%),3b型25例(15.0%),6a型23例(13.9%)。
两种结果比较发现,PCR-荧光探针法分型中的2例1b型,测序法分型为3b型(表2),两种分型方法的一致率为98.7% (164/166),差异无统计学意义(χ2=0.0492,P>0.05)。
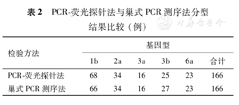
PCR-荧光探针法与巢式PCR测序法分型结果比较(例)
PCR-荧光探针法与巢式PCR测序法分型结果比较(例)
| 检验方法 | 基因型 | |||||
|---|---|---|---|---|---|---|
| 1b | 2a | 3a | 3b | 6a | 合计 | |
| PCR-荧光探针法 | 68 | 34 | 16 | 25 | 23 | 166 |
| 巢式PCR测序法 | 66 | 34 | 16 | 27 | 23 | 166 |
HCV为单股正链RNA病毒,根据HCV基因组核苷酸序列的差异程度,可将HCV分为6个基因型和67个确定的以及20个待定的基因亚型[8],而且仍不断有新的基因亚型被发现及报道[9,10]。在《丙型肝炎防治指南(2015更新版)》[2]中建议针对不同HCV基因型给予不同治疗方案,因此HCV基因分型检测在临床中意义重大。然而,目前临床上缺乏简单易行的HCV基因型检测方法,主要因为HCV基因型及亚型众多,序列间变异非常大。现在普遍采用的确定HCV基因分型方法为直接测序法,其原理为应用特异性引物进行巢式扩增Core-E1或NS5B区域,测序后联合多个参考序列进行系统发育树分析,从而得出HCV基因型。巢式PCR测序法特异性和敏感性很高,但需要经历提取HCV RNA、RT-PCR、测序和系统发育树分析等过程,操作复杂,技术要求高,一般条件的医疗单位难以常规开展。为此,近年来国内一些学者尝试采用新HCV基因型测定方法:如限制性长度多态性(RFLP)分析法、基因芯片法、型特异性引物PCR法、型特异性探针核酸杂交分析法和反向点杂交法等,但是这些方法同样存在操作繁琐、特异性和敏感性差异大、检测时间长和成本较高等缺点,亦不能满足临床需求[11,12,13,14]。国际上,已有一些以HCV某些特殊区段(如5′UTR区、C/E区和NS5B区)作为分型靶序列的商业HCV基因型诊断试剂盒问世,如INNO-LiPA、TRUGENE、Invader和Abbott等,但因价格昂贵等原因难以在国内用于常规临床检测。
我国是丙型肝炎高发区,HCV感染在我国仅次于HBV感染[15]。HCV基因型在全球的分布具有明显的地域性和人种分布特征[16]:全球HCV基因型普遍为1a、1b、2a、2b和3a型;然而我国却以1b、2a、3a、3b及6a型为主,其中1b(56.8%)为最主要的基因型[17]。进一步研究发现,我国各个地区基因型组成存在差异:在华北地区,6a型比率较低[18],在华南地区,6a型取代2a型成为第二主要基因型并传播迅速[19,20]。最近的分子流行病学调查显示,6a型在海南已经取代1b型成为最主要的流行亚型[21],并有个别HCV 6亚型在云南、广东地区陆续被发现[22,23]。虽然如此,全国范围内仍然以1b、2a、3a、3b和6a基因型为主。因此,只要能够有效检测这些基因型,即可满足临床工作的日常需求。国内曾有学者应用实时荧光PCR定量检测HCV RNA[24],说明实时荧光PCR在检测HCV RNA方面简单有效。之后有学者尝试使用荧光PCR技术鉴别HCV 1型和非1型发现,1型的符合率为80.9%,非1型的符合率仅为57.1%,其分型特异性不高[13],我们认为特异性不高的主要原因在于未能够充分选择不同亚型的保守靶序列以供筛选。本研究采用的PCR-荧光探针法,选取我国HCV主要流行的5种亚型(1b、2a、3a、3b和6a)的多个保守区域,设计相应的特异性引物和探针,运用RT-PCR技术和Tagman荧光探针技术,在扩增HCV 5种亚型保守基因部分片段的同时,实时检测亚型特异性探针的荧光型号,从而判断样本的基因亚型。与巢式PCR测序法相比,PCR-荧光探针法无需测序和分析系统发育树,操作简单,经济实惠。
本研究中的166个样本来源于我国16个省市,经过巢式PCR扩增Core-E1区、测序后系统发育分析显示基因型分布为:1b型66例(39.8%),2a型34例(20.5%),3a型16例(9.6%),3b型27例(16.2%),6a型23例(13.9%),与我国当前HCV主要流行的基因型分布一致[17]。如图1的系统发育树所示:5个常见HCV基因亚型中的序列分别属于不同的地区,并形成不同的进化簇,同一个亚型中未见HCV序列的明显地区聚集现象。在此基础上使用PCR-荧光探针检测HCV基因分型情况,可排除特异性探针的地区偏倚现象。结果显示,本研究中的PCR-荧光探针法与基因测序法的总体符合率为98.7%,除2例来源于陕西省的3b型被PCR-荧光探针法误判为1b外,其他的基因型结果完全一致,说明PCR-荧光探针法在检测我国常见HCV流行亚型的地区通用性和特异性高,优于之前的类似研究[13]。有2例3b型被PCR-荧光探针法检测成为1b型,提示目前使用的荧光探针在1b型与3b型的检测靶序列上仍存在有部分交叉反应。由于1b型和3b型是我国HCV最主要的两个流行亚型,因此本研究中所用的荧光探针仍需要进一步改进和完善,才能更符合临床需求。
总之,在检测我国目前常见的HCV基因型上,PCR-荧光探针法操作简便、快速,与直接测序法一致性高,可满足我国临床上HCV基因分型检测的需求,值得在临床上推广。然而,对于非常见的HCV基因亚型的检测,巢式PCR测序法在很长一段时间内仍难以替代,可作为PCR-荧光探针法的补充。此外,随着病毒的变异和进化,PCR-荧光探针法需要不断改进引物和荧光探针序列,以及时应对HCV基因的变异。
志谢:本研究的样本采集和相关分子生物学检测得到了广州金域医学检验中心的帮助,在此表示感谢。
利益冲突 无



























