
铜绿假单胞菌(Pseudomonas aeruginosa,PA)是一种机会性致病菌,在临床中可导致各种严重感染,这些感染往往伴有细菌生物膜的形成,其形成机制非常复杂,治疗也很棘手。研究表明,PA形成生物膜后其基因型和表型发生改变,菌体聚集并分泌胞外基质,从而包裹免疫系统原先可识别的细菌成分以及抗原,进而逃避人体免疫系统的识别。另外,生物膜PA可分泌各种毒力因子,阻碍固有免疫发挥效应。本文就PA生物膜所致慢性感染及其逃避机体固有免疫机制研究进展作一阐述。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
铜绿假单胞菌(Pseudomonas aeruginosa,PA)属假单胞菌科家族,革兰染色阴性杆菌,有鞭毛、菌毛等结构,无芽孢,是一种机会致病菌,临床中可导致严重感染,尤其形成生物膜后会导致感染慢性化。研究表明,大多数囊胞性纤维化患者在早期受到PA感染后,可在患者肺部形成生物膜,引起长期持续性感染[1];此外PA生物膜感染还可引起细菌性前列腺炎,导致泌尿道感染[2]及对各种抗生素治疗产生耐受,延迟伤口愈合[3,4,5,6]。铜绿假单胞菌及其生物膜形成和相关的免疫逃逸机制成为目前细菌感染研究领域的一个热点,本文就该领域的研究进展作一阐述。
人体固有免疫系统是阻止细菌感染的第一道防线,包括上皮屏障、宿主微生物、补体以及吞噬细胞(巨噬细胞和嗜中性粒细胞)、非吞噬细胞(自然杀伤细胞)等。固有免疫系统主要通过中性粒细胞(PMNs)和巨噬细胞释放炎症因子、细胞招募以及吞噬作用来清除PA及生物膜感染。致病菌表达一些病原体相关分子模式(PAMP),宿主固有免疫细胞可利用模式识别受体(PRR)来识别这些病原微生物特异性模式分子,比如脂多糖(LPS)和肽聚糖,释放各种炎症因子、趋化因子或通过Ⅰ型干扰素来激发一系列的抗菌免疫反应。
PMNs占外周血白细胞的大部分,组织中的肥大细胞、上皮细胞等可通过释放趋化因子IL-8、CXCL1、CXCL2以及活化因子IL-6来招募PMNs,PMNs被激活后迅速迁移至指定部位发挥吞噬作用并释放炎症因子TNF-α、IL-8以及IL-1β,吸引更多的PMNs发挥生物学效应。PMNs主要通过脱颗粒、吞噬作用、释放活性氧(ROS)及产生PMNs胞外诱捕网(NETs)来杀灭病原微生物。PMNs减少或PMNs介导抗菌机制缺陷的患者易受到PA感染。在PA致急性感染的小鼠模型中,敲除PMNs后会增加动物病死率[7]。一旦感染,PMNs可通过细胞表面的PRRs识别细菌中的PAMP,从而发挥经典的吞噬作用以及随后的细胞内杀伤来清除PA,每个PMN可在短时间内吞噬10~20个细菌。非吞噬的PRRs也参与免疫系统对PA的反应,其可被一系列的PAMPs(DNA、RNA、多肽、蛋白质以及多糖)激活,导致PMNs增加对细菌的吞噬作用。NOD1和NOD2是细胞内非吞噬的PRRs,可结合细胞内微生物的配体参与反应,主要是NOD1参与免疫系统对PA的反应。当免疫系统识别细菌后,可加速PMNs对细菌的摄取,这被称为细胞的调理作用[8]。除了细胞内杀伤,PMNs也能利用NET杀灭细胞外PA。NET由DNA支架、组织蛋白以及PMNs颗粒如髓过氧化物酶和PMNs弹性蛋白酶组成。已经证实,PMNs产生的胞外诱捕网可使细菌感染固定在局部[9]。PMNs杀灭细菌根据是否依赖还原型辅酶Ⅱ氧化酶产物ROS分为氧化应激和非氧化应激,PA对非氧化应激反应敏感,PMNs产生的弹性蛋白酶、溶菌酶、防御素以及抗菌肽可高效杀灭浮游细菌,但其诱导PMNs氧化应激反应产物ROS却可促使细菌持续存留机体[10]。
组织中巨噬细胞除了可吞噬外来颗粒和微生物,也能招募PMNs诱导免疫反应。活化的巨噬细胞涉及广泛的免疫活性,包括增加吞噬作用,抗原呈递,产生TNF-α,IL-1和IL-6等炎症因子[11]。当PMNs吞噬细菌或凋亡后,血液中不成熟的巨噬细胞(单核细胞)开始聚集。研究表明,兔、鼠和人缺少巨噬细胞很容易感染PA,机体对细菌的清除也会减慢,这可能是由于减少的巨噬细胞导致PMNs迁移受损所致[12]。巨噬细胞具有很强的吞噬活性,其可通过包括Fc受体、补体受体以及巨噬细胞甘露糖受体等PRRs识别PA表面配体从而吞噬组织和血液中的细菌。一旦细菌被吞噬,巨噬细胞可像PMNs一样产生细胞因子和趋化因子,如IL-1β、IL-6、IL-8、TNF-α以及ROS和NO来杀灭摄入的PA[12]。
PA生物膜可抑制或激活免疫系统,这与宿主免疫状态、生物膜入侵部位、生物膜组成、以及所遭遇的免疫细胞有关。生物膜细菌形成后,大量菌落聚集并分泌胞外聚合物(EPS),EPS主要由多糖、蛋白质和胞外DNA(eDNA)等组成,它可包裹菌落,同时分泌各种毒力因子逃避免疫识别,加上目前药物治疗的局限性(生物膜细菌相比浮游菌可增加对抗生素1 000倍的抵抗),最终导致宿主无法清除PA生物膜所致感染。宿主免疫系统通过PRR识别细菌PAMP,一些是与细菌结构相关的、一些是其分泌的特异性蛋白。尽管生物膜细菌分泌的各种成分具有免疫原性,但一旦被EPS包埋,免疫系统无法准确发挥作用[13]。如PMNs可迅速吞噬浮游细菌,但细菌开始聚集或者形成生物膜,这种吞噬作用就减弱了[14]。生物膜形成后PA还可通过减少细胞的调理作用、吞噬细胞的吞噬能力,固定PMNs以及抑制活性氧的产生来破坏宿主免疫细胞。PA生物膜形成后基质成分以及菌体结构改变与其逃避人体固有免疫之间存在密切关系,这些改变包括以下几方面。
胞外多糖是EPS的主要组成成分,有助于维持生物膜的完整性,并在细菌营养缺乏时提供营养[15,16]。EPS在不同的免疫条件下主要表达三种胞外多糖:Psl(与非黏液型EPS表型相关)、Pel和Alg(与黏液型EPS表型相关)。体外实验中,缺乏Psl的菌株对血清补体C3、C5和C7更敏感,更难以适应定居。同时,相比野生株生物膜和过表达Psl生物膜,其会增加PMNs产生ROS;缺乏Psl菌株也更易被PMNs以及巨噬细胞清除。动物模型亦表明生物膜细菌表达Psl对早期感染十分重要[17],还有研究证实,其可与eDNA交联构成纤维网,组装成生物膜骨架结构[18]。尽管PA可以产生鼠李糖脂快速裂解PMNs,宿主免疫系统在功能正常的情况仍然能有效清除浮游菌;而EPS中的Alg会导致生物膜细菌相比浮游菌减少PMNs约25%的调理或非调理杀伤作用[19]。当与巨噬细胞共培养时,Alg可减少生物膜细菌被杀灭,巨噬细胞上清液也能增加Alg表达,实验表明Alg突变的生物膜细菌约98%被巨噬细胞通过IFNγ介导的机制清除[20]。除了抑制固有免疫细胞,如PMNs和巨噬细胞活性,还可抑制补体的活性[20,21]。最新的研究表明,Pel是一种阳离子多肽,也可与eDNA在EPS中发生交联,在生物膜形成中承担一定功能[22]。从生物膜中提纯的多糖能结合钙离子(在细胞中作为信使传递信号),这可抑制PRR对细菌的识别[23]。
EPS中eDNA除了来源于小部分细菌本身的裂解-依赖群体感应信号分子(QS)系统控制[24],还可从宿主细胞,如PMNs以及其他细菌中产生[18]。它可促进细菌间基因的水平转移,也可促进细菌黏附和聚集,同时,能鳌和阳离子限制抗菌剂扩散[24,25]。最近有人利用DNA酶降解eDNA,发现它使PMNs减少分泌促炎因子IL-8和IL-1b,同时减少促使PMNs活化的表面标志物CD18、CD11b以及CD66b,并使PMNs对生物膜细菌吞噬作用减弱[26],这表明eDNA可能是EPS中一个主要的免疫原。有研究表明,eDNA可通过CpG和非依赖TLR-9的机制激活PMNs[26]。而Swartjes等[27]研究出一种新型的DNA酶,涂布于物体表面可延缓PA形成生物膜,有望减少插管相关性生物膜感染。
胞外蛋白质可协助生物膜细菌消化胞外大分子来维持能量获取、促进生物膜黏附及抵抗宿主细胞和分子,并增加细菌间的相互作用,维持生物膜结构的稳定。EPS中含有DNA结合蛋白,对生物膜的物理稳定性也起到了重要作用[28,29]。PA生物膜表现出不一样的转录组学和蛋白组学表型,有研究者通过荧光差异二维凝胶电泳技术揭示出PA生物膜细菌相比浮游型细菌高表达一些特异性蛋白,可通过这些蛋白的研究,找到使生物膜分散的靶点[30]。浮游细菌许多蛋白可作为PAMP被宿主细胞识别,如TLR2和TLR5等,但免疫系统与EPS相关的胞外蛋白之间的关系仍需深入研究。
OMV是分泌到菌体外,由膜脂质、脂多糖(LPS)以及DNA组成的球形双分子磷脂结构。它们的产生与细菌应激反应相关,也参与构成生物膜,但它们在EPS内的具体生物学作用尚不清楚。另外,OMV含有被多种PRR识别的多种PAMP的免疫原性组分,与可溶性抗原分子相比具有高度免疫原性,它可能与阻碍宿主对PA的清除从而形成慢性感染相关。Toyofuku等[31]研究表明,高达30%的来自体外生长的PA生物膜胞外蛋白质与OMV相关。
生物膜型PA可分泌许多小分子影响宿主免疫细胞,这些小分子包括次级代谢产物和抗菌素等。当细菌达到一定的数量后,可通过群体感应使不同的细菌生物学行为同步化,包括促使形成生物膜,分泌毒力因子等[32]。群体感应也可影响宿主细胞内的信号转导,影响免疫反应。有研究提示,PA生物膜3-oxo-C12-HSL分子可激活细菌内的LasR转录调节子,促进不同细胞基因的表达,如诱导PMNs并促使产生趋化因子IL-8[33];它还能通过不同的机制促使巨噬细胞、PMNs、成纤维细胞和血管内皮细胞等发生凋亡[34]。依据宿主细胞类型、3-oxo-C12-HSL浓度以及其他因素,可抑制或刺激免疫反应,但确切机制尚不明确,这可能是独立于PRR的另外一条途径[35]。尽管PA可以产生鼠李糖脂快速裂解PMNs,宿主免疫系统在功能正常的情况下仍然能有效清除浮游菌,但PA生物膜的群体感应信号系统las和rhl可使鼠李糖脂产生增加,它是一种具有表面活性剂作用的糖脂,可降低PMNs对细菌的吞噬作用。生物膜细菌和浮游型细菌上清液中提取的鼠李糖脂可快速裂解人PMNs并抑制其趋化性[36,37]。PA生物膜接触PMNs后,会使其固定并发生坏死,同时上调群体感应毒力因子的表达,而鼠李糖脂是上调的一个主要因子,可减少PMNs的杀伤作用[38]。动物实验表明,利用鼠李糖脂抑制剂阿焦烯(大蒜中提取的一种物质)后,生物膜细菌可快速被清除[39]。
浮游型PA形成生物膜后,除了分泌EPS以及毒力因子,也可通过细菌结构的改变来降低固有免疫细胞的吞噬作用。鞭毛可结合上呼吸道上皮产生的Muc1黏蛋白,对浮游型细菌的侵入、建立感染以及定居起重要作用,而形成生物膜表型后,细菌下调鞭毛基因的表达从而减少运动,而细菌聚集也有助于群体感应系统的激活。鞭毛可通过运动影响宿主PI3K/Akt信号通路:不同的感染模型表明PI3K/Akt的激活有助于免疫细胞依赖TLR的激活,从而促使宿主吞噬细胞对细菌的吞噬;相反失去鞭毛后,生物膜细菌抵抗巨噬细胞、PMNs和树突细胞的吞噬能力可增加100倍[40],而敲除PTEN磷酸酶(可使PI3K失活)促进吞噬细胞对PA的吞噬[41]。这些表明鞭毛的运动能力下调可使PA生物膜逃逸免疫细胞的吞噬从而导致持续感染。另外,Ciornei等[42]研究表明PA形成生物膜后细菌LPS结构发生特异性改变,失去O抗原;质谱分析表明形成生物膜后脂质A的结构也发生了变化,而LPS结构的改变会激活宿主TLR4受体产生更强的炎症反应,刺激PMNs产生更多的炎症因子如TNF-α以及IL-6等,但能增加免疫系统的炎症反应这一机制仍然不清楚。PMNs及巨噬细胞与生物膜PA关系如图1。
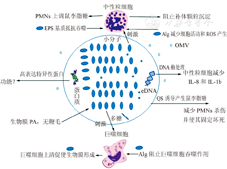

PA生物膜形成后,生物膜细菌逐渐适应人体内环境,与最初感染宿主时其基因型和表型相比已发生了改变,这种持续性的改变最终导致细菌逃避免疫系统及抗菌药物杀伤作用,使临床感染慢性化,迁延不愈。一方面,现有的临床治疗应首先控制并避免PA生物膜的形成;另一方面,只有通过加强对PA形成生物膜后EPS成分的研究,才能找到特异性作用于多糖、胞外蛋白、eDNA和QS系统等的药物,在生物膜细菌形成中或形成后杀灭细菌。对人体固有免疫系统与PA生物膜相互作用的深入研究,能够为利用人体免疫系统清除细菌生物膜感染开辟新途径。
利益冲突 无



























