乙型肝炎病毒(HBV)感染是威胁全球公众健康的重要危险因素,目前临床应用的抗HBV治疗药物主要为核苷(酸)类似物与聚乙二醇干扰素-α两大类,这些药物仅能通过直接或间接作用抑制病毒复制,不能清除病毒。因此,近年来医学研究者与多家医药企业积极研发抗HBV新药,已有多种药物进入临床试验阶段。本文围绕HBV的生命周期与抗病毒药物的作用靶位,对抗HBV治疗药物的特性、安全性及临床试验等研究近况作一阐述。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
据统计,全世界有3.5亿以上的人患有由慢性乙型肝炎病毒(HBV)感染引起的肝脏疾病,中国的HBV感染患者约占1/3(9 300万例),其中2 000万为慢性乙型肝炎(CHB),可进展为肝硬化、肝衰竭和肝细胞癌[1]。虽然乙型肝炎疫苗在我国已应用多年,大大降低了HBV的感染率,但仍有大量的CHB患者需要进行抗病毒治疗。目前临床应用的抗HBV药物主要为干扰素(IFN)和核苷(酸)类似物(NAs)两大类,但两类药物存在的共同问题是乙型肝炎表面抗原(HBsAg)清除率低(分别为10%和5%)[2],大多数患者即使长期治疗也难以清除病毒,停药后复发率高。因此,2015至2016年在国内外专家与各医药企业的努力下,部分新药进入了临床研究,抗HBV治疗取得了较大的进展。为了显著提高抗HBV疗效乃至根治HBV感染,研制出针对HBV生命周期关键环节的高效新药或针对多靶位药物的联合治疗成为迫切需求。笔者根据国内外近期文献报道,对新型抗HBV药物的研究近况作一阐述。
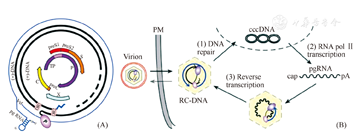
HBV基因组结构严密,在已知的病毒中是罕见的。HBV经pre-S1区域与宿主肝细胞表面受体(如NTCP)结合,进入肝细胞后脱去衣壳,将病毒松弛环状的双链DNA(rcDNA)运送至肝细胞核内,在DNA聚合酶等的作用下补齐双链缺口,形成共价闭合环状超螺旋DNA,即cccDNA,然后转录成3个短的信使RNA(mRNA)和1个长的前基因组RNA(pgRNA),3个mRNA分别编码3种表面蛋白。除编码核心抗原、e抗原和逆转录酶外,pgRNA还可作为病毒逆转录模板,逆转录为负链DNA,进而合成正链DNA,形成含有rcDNA的成熟核心颗粒[3,4]。成熟核心颗粒在细胞质中裹上包膜蛋白成为成熟病毒体释放至肝细胞外,部分可再次进入胞核补充cccDNA(图1)[3]。
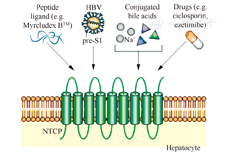
根据抗HBV治疗药物的作用机制或靶位,可将其分为8类[5,6]:(1)针对病毒入侵的阻断剂:阻止病毒入胞是重要的一个靶位,病毒入胞前有一个黏附过程,可能与肝细胞相关的硫酸乙酰肝素蛋白聚糖(HSPG)的侧链存在相关。有研究发现,肝细胞膜上的钠离子-牛磺胆酸共转运多肽(NTCP)是HBV的功能性受体,能够介导HBV入胞。一些脂肽药物(如Myrcludox B)作为肽配体能与NTCP结合从而阻止HBV入胞(图2)[7];亲环蛋白抑制剂,如CRV431、CPI-431-32、SCYX1454139、ALinia(Nitazoxannide)和NVP018(OCB-030)等也有相同作用。(2)针对HBV cccDNA形成或转录的抑制剂:因cccDNA以游离基因形式稳定储存于肝细胞核内,在HBV感染慢性化和肝炎复发中具有重要作用,对阻止cccDNA的形成十分关键。具有这方面作用的药物主要包括异芳基-二氢嘧啶(HAPs)、染色体修饰酶(如转录激活剂样效应剂核酸酶,TALENs)、CC-0975、LTβR及BSB1-25等。(3)针对HBsAg释放的抑制剂:如Rep2139-Ca和TKM-HBV。(4)针对核心蛋白的抑制剂:主要为衣壳蛋白的抑制剂,如NVR-1221、Bay41-4109、核心蛋白变构调节剂(CpAMS)及人La蛋白抑制剂(HBSC-11)。(5)RNA干扰(RNAi)药物:如ARC-520、SB9200、dd-RNAi compound、TKM-HBV及ALN-HBV等。(6)SMAC模拟剂:Birinapant(TL-32711)。(7)免疫调节剂:包括Toll样受体激动剂,如GS-9620(TLR7agonist)、CYT107(IL7)和治疗性疫苗,如TG1050等。(8)针对病毒DNA聚合酶抑制剂的新药:如TAF(GS-7340)、Besifovir、TXL™及MIV-210等。
目前NAs或聚乙二醇干扰素(PegIFN)单独抗病毒治疗方案可使大多数CHB患者获得持续病毒学应答,但长期疗效并不令人满意。主要表现在:(1)HBsAg清除率低,这主要是由于NAs只能抑制HBV DNA中核衣壳内正反链的合成,而对原始模板cccDNA无直接影响,HBsAg 5年转阴率只有10%[2],据Chevaliez等[8]报道,NAs治疗后随访102个月,HBsAg清除的中位时间为52.2年。(2)NAs需要长期或终生治疗,特别是HBeAg阴性患者。根据Cǎruntu等[9]数学模型计算,完全清除肝内cccDNA需要14.5年。(3)PegIFNα虽有免疫调节和抑制病毒基因转录的双重作用,也会抑制cccDNA形成,在一定程度上使cccDNA下降,但仅有35%的患者治疗获得成功,且不良反应较多。基于上述原因,目前还很难实现CHB患者"治愈"这一终极目标。
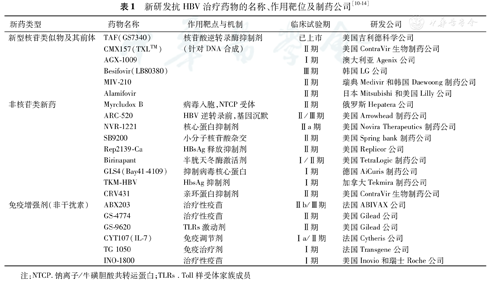
近年来各医药企业正在以"线路图"对多种新药进行验证,已发现有6种NAs新药及其前体、9种非核苷类似物及6种非干扰素免疫增强剂等具有较大临床应用前景(表1)[10,11,12,13,14]。
| 新药类型 | 药物名称 | 作用靶点与机制 | 临床试验期 | 研发公司 |
|---|---|---|---|---|
| 新型核苷类似物及其前体 | TAF(GS7340) | 核苷酸逆转录酶抑制剂 | 已上市 | 美国吉利德科学公司 |
| CMX157(TXL™) | (针对DNA合成) | Ⅱ期 | 美国ContraVir生物制药公司 | |
| AGX-1009 | Ⅰ期 | 澳大利亚Agenix公司 | ||
| Besifovir(LB80380) | Ⅲ期 | 韩国LG公司 | ||
| MIV-210 | Ⅱ期 | 瑞典Medivir和韩国Daewoong制药公司 | ||
| Alamifovir | Ⅱ期 | 日本Mitsubishi和美国Lilly公司 | ||
| 非核苷类新药 | Myrcludox B | 病毒入胞,NTCP受体 | Ⅱ期 | 俄罗斯Hepatera公司 |
| ARC-520 | HBV逆转录前,基因沉默 | Ⅱ/Ⅲ期 | 美国Arrowhead制药公司 | |
| NVR-1221 | 核心蛋白抑制剂 | Ⅱa期 | 美国Novira Therapeutics制药公司 | |
| SB9200 | 小分子核苷酸杂交 | Ⅱ期 | 美国Spring bank制药公司 | |
| Rep2139-Ca | HBsAg释放抑制剂 | Ⅱ期 | 美国Replicor公司 | |
| Birinapant | 半胱天冬酶激活剂 | Ⅰ/Ⅱ期 | 美国TetraLogic制药公司 | |
| GLS4(Bay41-4109) | 抑制病毒核心蛋白 | Ⅰ期 | 德国AiCuris制药公司 | |
| TKM-HBV | HbsAg抑制剂 | Ⅰ期 | 加拿大Tekmira制药公司 | |
| CRV431 | 亲环蛋白抑制剂 | Ⅱ期 | 美国ContraVir生物制药公司 | |
| 免疫增强剂(非干扰素) | ABX203 | 治疗性疫苗 | Ⅱb/Ⅲ期 | 法国ABIVAX公司 |
| GS-4774 | 治疗性疫苗 | Ⅱ期 | 美国Gilead公司 | |
| GS-9620 | TLRs激动剂 | Ⅱ期 | 美国Gilead公司 | |
| CYT107(IL-7) | 免疫调节剂 | Ⅰa/Ⅱ期 | 法国Cytheris公司 | |
| TG 1050 | 免疫治疗剂 | Ⅰ期 | 法国Transgene公司 | |
| INO-1800 | 治疗性疫苗 | Ⅰ期 | 美国Inovio和瑞士Roche公司 |
注:NTCP.钠离子/牛磺胆酸共转运蛋白;TLRs .Toll样受体家族成员
TAF是一种新合成的替诺福韦磷酸化前体,其血浆稳定性比富马酸替诺福韦二吡呋酯(TDF)更高,可以有效地渗入HBV感染的肝细胞内[15,16]。因此,当TAF的剂量低于TDF剂量(300 mg/d)的1/10时,即25 mg/d,就能在肝细胞内达到高浓度的双磷酸化替诺福韦,故其安全性更好。该药经美国FDA批准已于2016年11月10日上市。
Besifovir是一种新型的无环NAs,其抗病毒疗效与恩替卡韦相似。Besifovir是由韩国LG生命科学公司研发的一种与阿德福韦酯结构类似的口服抗HBV药物,于2012年完成Ⅱ期临床试验后卖给韩国Ildong制药公司。由韩国和中国香港多家医疗机构参与的以Besifovir 90 mg、150 mg和恩替卡韦为三组治疗CHB 96周临床试验[8,12]结果显示:(1)在病毒下降、ALT复常率和HBeAg转阴方面,三组差异无统计学意义。(2)三组的HBV DNA分别下降5.29、5.15和5.67 log IU/mL,HBV DNA检测不到20 IU/mL的百分比分别为80.7%、78.6%和80.0%,ALT复常率分别为90.3%、78.6%和93.3%,HBeAg转阴率分别为20.0%、21.4%和22.0%。(3)Besifovir 90 mg组出现1例患者因依从性差发生病毒学突破,三组均无患者出现耐药。(4)三组长期安全性良好,均未出现严重不良事件,但Besifovir最常见的不良反应为肉碱消耗大,因此需要补充肉碱。(5)目前的研究样本数量较小,未进行骨密度扫描和HBsAg定量测定。Besifovir在Ⅲ期临床试验后,未继续进行研究,但据韩国Ildong制药公司称,其药品销售许可已获韩国食品药品安全部(MFDS)批准。
Alamifovir为Kamiya等[17]首先发现的一类新结构类型的核苷酸药物,由日本Mitsubishi和美国Lilly公司联合开发的一种抗HBV新药。在Alamifovir分子结构中,除了对类似于阿德福韦酯的糖基结构进行改造外,其核苷碱基母核的6位为苯硫基所取代。Alamifovir对HBV具有高度选择性的抑制作用,体外抑制HBV的活性比拉米夫定高20~80倍,为阿德福韦(Adefovir)的10~20倍。与其他药物相比,其半数有效浓度也较高,而且对肝脏具有高度选择性的分布。体内实验证明,Alamifovir抗HBV作用强,其原因是能代谢形成4-羟基苯硫基与单三氟乙基酯两个活性产物,通过抑制P蛋白包装反应而抑制HBV复制,对野生型HBV拉米夫定耐药株也有作用。动物试验证明其肾毒性低于阿德福韦酯,Ⅰ期临床试验的安全性和疗效评价已完成,目前已进入Ⅱ期临床。
TXL是替诺福韦的一种新型前体药物。美国ContraVir生物制药公司于2016年3月29日宣布TXL体外实验结果[18,19],证明其是一种高效的抗HBV药物,优于TAF[TXL与TAF的50%效应浓度分别为(9.3±3.6)和(32.4±17.1)nmol/L,90%效应浓度分别为(186±53)和(474±261)nmol/L],后期抑制HBV复发的研究也表明TXL的活性高于TAF。TXL具有新的肝脏靶向结构,可以降低TDF全身浓度水平,从而减少对肾脏的不良反应。Ⅰb期剂量(100 mg/d,口服14 d)已显示出其优异的安全性、耐受性和药物分布概况。目前正在进行Ⅱa期多剂量递增临床研究,纳入84例初治CHB患者,并与TDF头对头比较研究,计划最高剂量为100 mg/d,初步认为TXL可能成为抗HBV药物联合的最佳基础药。TXL如与亲环蛋白抑制剂CRV431联用,可以发挥不同靶点杀灭病毒,会显著提高疗效[20]。
AGX-1009是由澳大利亚Agenix公司合成的Tenofovir前体药物,其本身没有活性,可经过体内代谢后变为具有活性的药物,因而可针对身体的具体部位。后期抑制病毒复发研究提示,AGX-1009的活性具有靶向性的作用,目前虽尚在Ⅰ期临床阶段,实际上已进入Ⅲ期临床研究[12,20]。澳大利亚Agenix公司已将中国权利给予欣凯(Cinkate)医药公司,估计不久会有结果。
MIV-210是一种双脱氧鸟苷前药,它作为一种核苷逆转录酶抑制剂,由瑞典Medivir和韩国Daewoong制药公司共同研制,可以有效地抑制HIV和HBV的活性。Ⅰ期临床试验显示,MIV-210口服吸收好,安全性也较好,适合治疗耐药HBV感染。2013年9月研发公司声明,认为该药对乙型肝炎未能达到理想的药效,决定放弃研究此项目。
目前应用于临床治疗CHB的抗HBV药物主要为PegIFNα与NAs,大部分因未获得HBeAg和(或)HBsAg血清学转换而停药,其复发率较高。临床资料表明,PegIFNα虽能下调病毒蛋白的表达和抗病毒作用,但有效率不到40%。NAs能有效抑制大部分CHB患者对HBV DNA的复制,从而阻断或延缓疾病的进展,但仅有少数可以实现HBsAg转阴。因此,单独应用上述二种药物治疗难以获得理想的治疗目标。国内外学者提出对现有NAs和PegIFN开展优化或联合治疗的研究。近年来,一些探索性研究发现,对NAs经治患者联合PegIFN治疗,可实现停药后持续病毒学应答和较高的HBeAg血清学转换率,甚至实现HBsAg清除或血清学转换,从而达到NAs停药期望。联合治疗的研究方案及方法报道较多,本文仅选择二项具有代表性作简单介绍。
由奥地利AOP orphan制药与美国PharmaEssentia公司共同研制的AOP2014,为第三代长效IFN,称为"Peg-P-IFNα-2b(P1101)" ,即在PegIFNα结构的氨基(N)末端增加脯氨酸(Proline)。研制公司宣布从2013年开始在欧洲14个国家开展对真性红细胞增多症治疗Ⅲ期临床试验,于2015年结束。本药品特点为:改变长效型高分子Peg与蛋白质的连接位置与方式;选用的Peg的相对分子量为40 000;使用基因重组技术获得创新IFNα-2b;将Peg连接到IFNα-2b上的特定位置。动物(猴子)PK/PD检测显示,其在血液与细胞中能维持药效至少2周以上。药华医药表示已启动抗HCV Ⅲ期临床试验,对HBV治疗的研究正在设计中。
Marcellin等[21]进行了一项随机对照双盲研究,共包括740例CHB患者。根据HBeAg状态和HBV基因型,将所有患者分为4个治疗组:组1(n=186)接受TDF+PegIFN治疗48周;组2(n=184)先接受TDF+PegIFN治疗16周,再单用TDF治疗至48周;组3(n=185)单用TDF治疗120周;组4(n=185)单用PegIFN治疗48周。治疗至第48周时,组1患者HBsAg下降-1.1 log,显著高于组2(-0.5 log)、组3(-0.3 log)和组4(-0.8 log)患者。继续观察至72周时,组1患者HBsAg转阴率亦显著高于其他3组患者(9.0% vs. 2.8% vs. 0% vs. 2.8%)。分析HBeAg状态和基因型时发现,HBeAg阳性患者HBsAg转阴率较高,共11例,而HBeAg阴性患者HBsAg转阴率较低,只有6例。基因型A、B、C和D患者的HBsAg转阴例数分别为4、5、5和3例。据估计10%左右获得理想治疗目标。
Brouwer等[22]进行的ARES研究是一项全球多中心随机对照研究(175例,96周)。研究比较了ETV治疗24周后加用PegIFNα或继续ETV单药治疗的疗效。48周时获得应答的患者在72周时停用ETV,2014年EASL年会上,研究者公布了96周的结果。结果表明,ETV+PegIFNα治疗组的持续性HBeAg血清学转换率、ALT复常和HBV DNA<2 000 IU/mL的比例均显著高于ETV单药治疗组(69% vs. 25%, 79% vs. 25%, P<0.05)。
目前抗HBV药物研究[23,24]主要集中在多聚酶抑制剂(包括NAs新药及其前体)和非核苷类抑制剂(包括HBV入侵抑制剂、HBV cccDNA靶向药物、核衣壳装配抑制剂及免疫调节剂等)。本文对已进入临床试验的10种重点药物研究概况作一介绍。
肝细胞膜上HBV-preSl特异性受体为NTCP。Myrcludex-B合成肽来自HBV前S1结构域的序列,已被证明能与NTCP特异结合,不仅能有效阻止HBV在感染肝脏内肝细胞间的扩散,而且能抑制最初感染的肝细胞内病毒cccDNA储存库的扩增。因此研发此病毒侵入抑制剂,使之与现有的抗病毒药物联用,能够显著提高疗效。临床前研究证实,Myrcludex-B可在体内和体外阻断HBV感染新肝细胞[25]。
德国开展了治疗CHB和丁型肝炎的首次临床试验研究,旨在评估Myrcludex B的安全性、耐受性及抗病毒疗效[26,27],其结果在第65届美国肝病协会年会(AASLD)上公布。研究方法:队列A为40例慢性HBV感染者,服用Myrcludex B 0.5、1、2、5和10 mg,1次/d,治疗12周(每种剂量8例患者),接受10 mg治疗的患者治疗延长至24周;队列B为24例丁型肝炎患者,8例在治疗前单独接受2 mg Myrcludex B治疗24周(B1),另外8例在第1个24周时加入Myrcludex B联合PegIFNα(B2)治疗,剩下的8例只接受PegIFNα治疗(B3)。研究结果显示,Myrcludex B有很好的耐受性,队列A中3例Myrcludex B治疗患者(10 mg组)发生注射侧皮炎,治疗结束后消失。1例丁型肝炎病毒(HDV)患者(B2)出现银屑病恶化,导致服药中止。观察到8例接受10 mg Myrcludex B治疗的患者中有6例在第12周出现HBV DNA下降>1 log,而其他剂量组中不经常发生。40例患者中22例(55%)ALT恢复正常,平均ALT值从治疗前的76 U/L下降至12周时的36 U/L(P<0.01)。HBsAg水平无显著性变化。对于丁型肝炎,可获得数据的Myrcludex B单一治疗组(B1)7例患者中有6例、联合治疗组(B2)7例患者7例第24周时HDV RNA下降>1 log,B3组患者在第12周7例中均出现此类反应。第24周时2例(B1)患者和5例(B2)患者的HDV RNA转阴,ALT值下降,B1组为6/7,B2为4/7,B3为3/7(第12周)。B1中1例、B2中1例患者在24周时HDV RNA转阴,ALT恢复正常。1例(B2)患者在第24周时出现HBsAg下降1 log。Myrcludex B治疗在>1 mg剂量时诱导前S特异性抗体和胆汁酸升高。结论:对于有或无HDV合并感染的HBsAg阳性患者,Myrcludex B是安全的,耐受性好。HBV的抑制与HBV DNA和HDV RNA下降及生化指标的改善具有明显的相关性。
ARC-520是一种基于RNA干扰(RNAi)技术设计的药物,由两个siRNA序列组成,针对HBV基因组两个区域[28]。目前,一项P1临床研究已在澳大利亚进行,另一项P2a研究也将在中国香港进行,在治疗CHB患者的Ⅱ期临床研究显示,ARC-520 2 mg/kg剂量治疗早期可显著下降HBsAg。
ARC-520通过作用于mRNA靶点,干扰HBV逆转录过程,用于治疗CHB。ACR-520采用了美国Arrowhead公司独有的输送系统,其原理是通过RNA干扰作用来封闭HBV某些蛋白的表达,导致病毒无法增殖,然后再利用人体免疫系统对剩余病毒进行清除,实现免疫清除状态,特征为HBsAg血清学转阴或血清学转换。因其在临床前研究中使用最高剂量组出现动物死亡,对其安全性提出质疑;但在人类研究中则少有严重不良事件发生。不久该公司决定重新开展该药物的研究,并将静脉注射改为皮下注射,并发布治疗乙型肝炎的临床Ⅱb期数据,结果显示,在治疗难治性HBeAg阴性CHB过程中,ARC-520通过与恩替卡韦(百时美施贵宝)联合,患者血清HBV DNA水平可降低99.99%,此奇效在业界引起了轰动[29]。
本品为Toll样受体-7(TLR-7)激动剂(代号GS-9620),能够刺激pDCs和B细胞表达TLR7,可被ssRNA或小分子激活。GS-9620是由美国吉利德公司推出的一种口服免疫调节剂,研究发现[30],在土拨鼠CHB模型中可诱导快速、显著而持久的血清病毒载量、肝内DNA复制中间体和病毒RNA水平的下降,还可显著降低cccDNA。Lanford等[31]报告了一项在大猩猩中的研究,评价GS-9620的疗效:3只慢性HBV感染的黑猩猩口服GS-9620,1 mg/kg, 3次/周,共4周,随后2 mg/kg,每周3次再治疗4周。使用LC/MS/MS法确定GS-9620血清浓度,检测血清HBV DNA、HBsAg、HBeAg、血细胞计数和血生化,并使用流式细胞仪分析淋巴细胞亚群的激活,通过点阵仪、肝脏组织学检查和免疫组化分析以及干扰素刺激基因(ISG)的诱导,确定肝脏和血液中细胞因子和趋化因子的水平。结果显示,3只动物接受GS-9620治疗后,病毒载量降低了2.0 log,血清HBsAg水平相应降低了50%~61%,HBeAg降低了58%~93%。病毒载量至少降低1 log的持续时间为64~121 d (监测结束时)。使用1 mg/kg剂量即有显著的药代动力学应答,使用2 mg/kg剂量时应答进一步增强,ISG增加超过100倍。治疗增加了活化的血液淋巴细胞和自然杀伤细胞数量以及凋亡的肝细胞数量,并使肝脏内淋巴细胞浸润逆转,符合免疫介导的对嗜肝病毒感染的应答。治疗中耐受性良好,不良反应是可逆的。不仅如此,GS-9620使实验动物肝细胞癌发生率从71%下降至8%。
Lopatin等[32]对75例健康志愿者进行了一项随机双盲对照试验,受试者分别每天服用0.3、1、2、4、6、8和12 mg的GS-9620,结果证明,GS-9620在健康志愿者体内吸收性、安全性和耐受性良好。直至剂量>8 mg时,才出现类似流感样等不良反应,但在72 h内都自行恢复。同时发现,高脂饮食可影响GS-9620的吸收和疗效。另外,AASLD 2016年会议上发表Ⅱ期多中心研究[33],将156例CHB分为A组(4周)、B组(8周)和C组(12周),随机分别接受GS-9620,1次/周,剂量为1、2和4 mg,每组均设安慰剂对照。在整个给药期间对外周血细胞因子和ISGs转录物进行检测及安全性评估,结果证实GS-9620在治疗CHB中安全性良好,虽然未发现HBsAg显著下降,但也证实了刺激基因15(ISG15)随剂量依赖性药效诱导。GS-9620联合TDF已批准于2017年1月正式进入临床试验阶段。
NVR-1221为HBV核心蛋白合成阻断剂,是一种小分子复合物,可以与HBV核心蛋白的寡聚体(如二聚体)结合,从而影响120二聚体核心蛋白的合成。该药物由美国Novira Therapeutics制药公司研发且目前正在开展Ⅱa期临床试验。相关研究显示[34],目前正在研究的4种核心蛋白抑制剂即使在高浓度情况下,也无细胞毒性作用,并且与HBV核心蛋白的疏水结合位点具有高度的亲和力。该药物对HBV所有基因型均有效,对NAs耐药患者亦有效,可以单独使用或者联合NAs及PegIFN治疗CHB。
SB 9200属于免疫调节剂,通过激活机体先天性细胞免疫反应,激发体内IFN产生,调控宿主免疫应答,使受感染HBV的肝细胞死亡从而清除病毒,同时使未感染肝细胞建立抗病毒状态。SB 9200是从美国Spring Bank制药公司的小分子核苷酸杂交技术平台筛选获得的,为口服的二核苷酸前体药物,属于新型免疫调节抗病毒制剂。SB 9200独特的抗病毒机制是通过激活宿主细胞内抗病毒应答蛋白,即胞浆病毒应答器前卫蛋白RIG-I和NOD2来完成的。RIG-I和NOD2对调节宿主先天性免疫应答和激活细胞对病毒RNA发出的IFN信号非常重要。初期研究[35]显示,SB 9200可联合NAs或其他研发的抗病毒制剂使用,抗病毒效果与IFN相似,但无IFN类流感样综合征等系统性不良反应。SB 9200对HCV、HBV及其他病毒均有作用,在治疗HCV时可联合抗HCV的直接抗病毒药物使用。
近期研究发现一种基于核酸的两性(亲水和疏水性)分子聚合物(NAPs)之一,代号Rep 2139-Ca(钙螯合物)[36]。在感染HBV的鸭及其他研究对象的临床前期研究中,该药物均可影响HBsAg形成,如与PegIFNα-2a或胸腺素α-1联用可增强宿主免疫,能阻断肝细胞释放HBV亚病毒颗粒(SVPs),进而控制HBV感染。HBsAg是HDV的重要组成部分,Rep 2139-Ca可以清除血清HBsAg而增强抗HDV感染的疗效。Rep 2139-Ca利用硫代磷酸酯寡核苷酸的非依赖特性与HBsAg的载脂蛋白相互作用,而载脂蛋白与SVPs形成密切相关,SVPs是HBsAg的主要组成成分,故Rep 2139-Ca可阻止感染肝细胞里SVPs的形成及分泌,最终影响HBsAg的形成。HBsAg有重要的免疫抑制作用,能够阻止机体的先天及获得性免疫。前期研究证明,利用Rep 2139-Ca可快速有效地清除HBV感染者血液中的HBsAg而迅速恢复机体的抗HBV免疫应答。因此,清除血液中的HBsAg能够大大提高抗HBV的免疫治疗。
以Ⅱ期临床研究的12例HBeAg阳性HBV/HDV合并感染的白人患者评价Rep 2139-Ca的治疗安全性与抗病毒疗效。12例患者接受Rep 2139-Ca治疗20~38周,治疗有应答后接受免疫抑制药物PegIFNα-2a和(或)胸腺肽α-1治疗。治疗24周结果显示,8例检测不到HBV RNA(HBV特异性引物RT-qPCR法定量),4例HBsAg血清学转换(抗-HBs:200~766 U/L),提示Rep 2139-Ca具有治疗CHB的前景[37]。本品具体应用方法:首先Rep 2139-Ca每周500 mg/次,静脉注射15周,然后改为每周250 mg/次,再注射15周,同时加用PegIFNα-2a 180 mcg持续冶疗48周。
Birinapant为美国TetraLogic公司研发的抗癌药物。Ebert等[38,39]科研团队在感染HBV细胞的研究基础上,发现Birinapant抗HBV作用强,在数百次模型测试中成功率为100%,因此,他们在《美国国家科学院院刊》(PNAS)杂志上发表了两篇令人无比鼓舞的文章。Birinapant为第二线粒体源性半胱氨酸天冬蛋白酶激活剂(SMAC)的类似物,通过模仿内源性SMAC功能从而拮抗细胞凋亡抑制蛋白(CIAPs),可以迅速降低HBV DNA和HBsAg水平,并促使HBV感染肝细胞的清除。临床前模型试验发现Birinapant与恩替卡韦联用后能更加迅速清除HBV DNA(与单药相比提高2倍)。动物试验表明本品耐受性良好,研究提示Birinapant及其类似物有可能成为CHB治疗良好的新药,如能与现有抗HBV药物联合,有治愈HBV的希望。但最近临床试验中发现Birinapant会导致颅神经麻痹,目前已出现18例颅神经麻痹,主要表现在第7对颅神经病变而造成"贝尔麻痹" [40],在给药第3剂量后会出现头痛、耳部或眼眶痛等前驱症状,因此,不得不中止Ⅱ期临床试验。
GLS4是以Bay41-4109为原型优化后的杂嘧啶类似物,为HBV组装抑制剂,是新一代的二氢嘧啶抗病毒药物。体内外研究结果显示[41],其靶向为HBV核心蛋白,能够干扰核心颗粒(核衣壳)的装配,抑制HBV复制。通过在HepAP38细胞系中测定,HBV cccDNA的形成/积累>90%被显著抑制,由cccDNA依赖性pgRNA转录>80%也降低,在cccDNA中的核心蛋白与结合H3组蛋白乙酰化也明显减少,并发现对阿德福韦酯耐药变异(rt A181T, rt A181V, rt N236T)病毒也有作用[42]。我国广东东阳光药厂研发的甲磺酸莫非赛定(GLS4JHS)于2014年已进入Ⅱ期临床,相信不久将会问世。
AL-3778是一种HBV衣壳组装调节剂(CAM)。美国强生公司对其特性、耐受性、药代动力学和抗病毒作用进行了研究。Ⅰ期临床研究结果[43]已在2017年APASL(上海)年会上发表。该项研究纳入了73例HBV DNA>20 000 IU/mL、ALT升高和不伴肝硬化的HBeAg阳性CHB患者(亚洲人群,基因B和C型),治疗28 d,随访28 d。四个队列中,患者随机分配至1次/d AL-3778 100 mg和200 mg(活性药物组∶安慰剂组=5∶1)、2次/d 400 mg和600 mg(活性药物组∶安慰剂组=4∶1)治疗组以及匹配的安慰剂治疗组。最高单一治疗剂量组的患者随机接收2次/d,1 000 mg AL-3778或安慰剂治疗(活性药物组∶安慰剂组=7∶2)。随后,患者随机分配至PegIFNα(180 μg,皮下注射,1次/周,共4次)结合AL-3778(600 mg,2次/d)治疗组或PegIFNα联合安慰剂治疗。各队列第1次给药后的第3、7、14、21和29天丈量C0 h进行药代动力学取样。血清HBV DNA定量使用TaqmanTM HBV Test v2.0 (Roche)检测,HBV RNA定量检测应用QuantigeneTM杂交测定形式进行检测。
AL-3778在CHB患者中的耐受性良好,不良反应主要为1级或2级,且为一过性,无严重不良事件。HBV DNA和HBV RNA呈剂量依赖性降低,但相较于基线,第28天的HBV血清学参数无显著差异;AL-3778 600 mg(2次/d)联合PegIFNα组的HBV DNA下降幅度最大,为1.97 log10 IU/mL,AL-3778单药组和PegIFNα单药组的降幅分别为1.72和1.06 log10 IU/mL。治疗28 d后,与基线相比较,各组平均HBV RNA变化分别为:安慰剂组=0.00;PegIFNα组=-0.73;600 mg,2次/d AL-3778组=-0.82;600 mg 2次/d AL-3778/PegIFNα联合组=-1.5。用药后观察到HBV DNA和HBV RNA呈现剂量相关性降低,在联合IFN组观察到额外的抗病毒效用证据。血清HBV RNA的减少与AL-3778新型作用机制相一致,即干扰有效的HBV RNA衣壳化组装这一过程。
CRV 431为环孢素A衍生的亲环蛋白抑剂制。体外研究表明,CRV431可以抑制HBV复制,与阻断HBx和宿主细胞亲环蛋白之间的特异性作用相关。本品有良好的口服生物利用度和首过效应,并集中在肝脏代谢。能减少或清除HBsAg、HBeAg、HBV DNA和cccDNA的产生。动物研究安全性良好,如与CMX157联合应用,会表现出强力抗HBV作用[44]。
近年来,由于抗HBV新药的重大进展,再次引发了各医药企业开发新抗HBV治疗药物的高潮。目前通过动物模型研究抗病毒治疗药物的疗效,开发了多种临床前和临床各期的新药物,多种药物具有强大的抑制HBV复制的惊人疗效,但能获理想的目标及安全性尚需进一步验证。当今临床实际应用仍按现已批准的药物联合治疗为主,包括PegIFN和现有或新开发NAs的联合,如Peg IFN+恩替卡韦和PegIFN+TDF(或TAF)等,可以提高HBeAg血清转换率或HBsAg转阴率。几种新抗病毒口服药物和免疫调节药物的联合方案,可能会获得HBsAg消失/转换和cccDNA减少或沉默的理想前景,其安全性仍需进一步临床研究。目前有限资料提示Myrcludex B+PegIFN、ARC-520+恩替卡韦及CXV431+CMX157联用等可能对于治疗HBV具有较大前景。
利益冲突 无