
肠道微生物在结直肠疾病发生发展过程中起着至关重要的作用,具核梭杆菌(Fn)作为肠道共生菌群与结直肠疾病具有密切关系,受到越来越多的关注。研究发现具核梭杆菌可促进肠道炎症及肿瘤的进展并且影响疾病的预后。本文就近年来具核梭杆菌致病机制及其对结直肠疾病影响的相关研究进展进行综述。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
具核梭杆菌(Fusobacterium nucleatum, Fn)属拟杆菌科梭杆菌属,是革兰氏阴性无芽孢厌氧菌,是人类口腔和肠道的共生菌群[1,2],在肠道粘液层和结肠腺窝定植[3,4],有5种亚型,分别为具核亚种、多型亚种、梭型亚种、文氏亚种和动物亚种[5]。肠道菌群研究发现,某些结直肠疾病与Fn感染具有明显相关性[6,7,8],推测Fn可能通过血液或经消化道传播,影响结直肠疾病的发生、发展及预后,同时发现Fn能够促进结直肠肿瘤的转移[9,10]。进一步机制研究发现,Fn菌体表面的具核梭杆菌黏附蛋白A(Fusobacterium nucleatum adhesin A, FadA)是介导Fn黏附、侵袭宿主细胞的主要致病因素[11,12]。本文对Fn菌体表面的FadA生物学功能及Fn与结直肠疾病的相关性研究进行综述。
细菌黏附、侵袭宿主细胞,是机体致病的重要原因[13]。研究发现Fn菌体表面的FadA是介导其发挥黏附、侵袭作用的主要因素[11,14]。FadA具有高度保守性,与已知细菌黏附素无同源性,仅在口腔源性梭菌属表面发现[1,9]。国外学者通过FadA基因互补实验证实,FadA基因缺失组的Fn增殖能力较正常组减慢[11],并且对口腔上皮细胞及中华仓鼠卵巢细胞的黏附、侵袭能力减弱[1]。将FadA基因片段缺失的Fn和正常Fn分别注入孕期小鼠体内,前组较后组小鼠脐带血内的白介素-6(IL-6)、角质细胞趋化因子(KC)及C-反应蛋白(CRP)等炎症因子水平明显降低,推测FadA的表达与Fn的黏附、侵袭、增殖及促炎作用密切相关[15]。
FadA为小分子蛋白,约13.6 kD,以未成熟的Pre-FadA和分泌形式的成熟FadA(mFadA)2种方式存在。Pre-FadA由129个氨基酸组成,存在于菌体胞膜内侧,与mFadA主要的区别在于,具有由18个氨基酸组成的单个信号肽区域。mFadA由111个氨基酸组成,位于菌体胞膜表面,mFadA单体通过亮氨酸链构成非α-螺旋发夹环丝状结构的晶体状态,该结构被证实是Fn发挥作用的重要部位[12,16]。两种形式的FadA可以以不同比例组合形成不同高相对分子质量复合物(FadAc),联通Fn细胞膜内外,介导细菌的黏附、侵袭过程[16,17,18]。不同亚型Fn表面的FadAc中Pre-FadA和mFadA的比例不同。滴度实验发现,FadAc中Pre-FadA只有达到一定比例时,才能够发挥介导细菌黏附、侵袭的生物学作用。研究显示Pre-FadA信号肽区域氨基酸突变,会明显影响Fn的黏附能力,推测Pre-FadA信号肽区域决定FadAc的形态结构进而调控Fn的黏附能力[19]。
国内外学者对Fn致病机制研究发现[20,21],宿主细胞膜上的内皮细胞钙黏蛋白(Endothelial cadherin, E-cadherin) 是Fn附着细胞的必需条件,E-cadherin是一种肿瘤抑制因子,在细胞与细胞间的连接发挥重要作用。研究证实Fn无法黏附和侵入不表达E-cadherin的结肠癌细胞,推测E-cadherin是宿主细胞表面FadA的受体[12,20,22] 。进一步研究发现FadA与E-cadherin的415-534区域结合,可使E-cadherin离开细胞与细胞连接处,向胞内转移,血管内皮细胞完整性改变,血管通透性增加,从而使Fn通过E-cadherin介导的细胞间结点穿过血管内皮,进入血液循环播散至机体其它部位。研究还发现,Fn可通过"FadA依赖机制"协助其它细菌的侵入,即FadA通过与E-cadherin结合,增加血管内皮通透性,促进其它微生物的系统性传播[23,24,25]。
Fn为口腔源性菌,在消化道内也可检测到,有人提出以下两种可能的播散机制:(1)牙龈袋内的Fn,通过牙龈溃疡入血传播,从而播散至胃肠道,参与某些疾病进展[26];(2)由于吞咽口腔菌,Fn通过胃肠道播散至消化道内[10]。多位学者对各种消化系统疾病患者的Fn感染检出率进行调查,结果如表1。研究显示,Fn在炎症性肠病(Inflammatory bowel disease,IBD)、结肠腺瘤及结直肠癌(Colorectal carcinoma, CRC)等病变组织中丰度增加,因此推测Fn可能是上述疾病发生的危险因素之一[7,9,27]。

不同消化系统疾病具核梭杆菌感染检出率
急性阑尾炎的病因,过去被认为主要是异物阻塞诱发黏膜炎症。Swidsinski等[28]对德国柏林70例急性阑尾炎患者病变组织进行菌群检测,发现菌群感染与阑尾炎发病关系密切,肠道内梭菌属感染检出率为62%,梭菌属以Fn为主,而在正常组织Fn感染检出率<1%,俄罗斯及中国地区患者检出率结果与之相近。卡它性阑尾炎患者梭菌属检出率为52%,化脓性阑尾炎患者检出率为70%,均以Fn为主,而急性阑尾炎患者直肠拭子检测未发现梭杆菌[32]。目前发现Fn与阑尾炎发病的相关机制包括:(1)激活细胞信号通路影响细胞骨架结构,包括肌动蛋白、微管等,发挥侵袭作用;(2)诱导外周血单核细胞和外周血多形核细胞的凋亡,从而逃避免疫杀伤细胞;(3)由于细胞壁外膜中存在内毒素,其毒力作用可导致不同程度的肠道炎症反应,诱发阑尾炎。Fn感染可能与阑尾炎密切相关,并且与疾病严重程度呈正相关[32]。
肠黏膜作为消化系统抵御外界侵害的第一道防线,肠上皮细胞合成与释放各种分子在粘膜免疫中发挥重要作用,使机体在疾病与健康状态间保持平衡。IBD患者肠道菌群检测发现,Fn是IBD患者最常见的感染菌之一,IBD患者Fn检出率为50%,对照组检出率为17%,二者差异具有统计学意义[29],这与之前的研究结果相符[32]。2012年有研究者报道,IBD患者炎症组织中Fn感染检出率为69%[30],IBD患者炎症组织中分离出的Fn较正常对照组分离出的Fn菌株黏附、侵袭能力增强[29,33,34],而IBD患者正常组织中分离出的Fn与正常对照组分离出的Fn侵袭力无明显差异[29,35]。Ohkusa等[36]报道,溃疡性结肠炎患者组织中提取的Fn可以在小鼠中成功诱导出实验性的炎性溃疡。同时研究发现,当Fn感染侵袭上皮细胞,导致粘液素分泌紊乱,引起肠道上皮屏障破坏,粘膜通透性增加,刺激肠上皮细胞释放白介素-8(IL-8)、白介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)及CC类趋化因子-20(CCL-20)等炎症介质[36,37,38],从而招募免疫细胞并引起免疫应答逐级放大,诱发强烈的炎症反应,最终导致组织损伤,IBD的发生机率增加。此外,Fn感染可抑制自噬相关蛋白16-1(ATG16L1)的表达,阻碍自噬体向自噬溶酶体成熟,减弱自噬体对Fn的清除作用,导致Fn持续感染并促进IBD的发生发展[39] 。
很多学者对CRC与Fn间的相关性给予了关注,发现二者间具有明显的相关性[4,40]。研究者分别使用Fn与正常饲料喂养Apc基因缺陷小鼠,对比研究发现Fn喂养组较正常饲料喂养组的Apc基因缺陷小鼠肿瘤发生率明显升高,Fn喂养组小鼠肿瘤内髓样来源的免疫细胞浸润增多,结肠中Fn丰度与促炎因子包括环氧酶-2(COX-2)、IL-8、IL-6、IL-1b和自然杀伤细胞-α(NK-α)等的表达密切相关,而肠道中其它菌种不具有这种联系,表明Fn增加肿瘤浸润性髓样细胞的多样性和选择性,产生促肿瘤的炎症微环境,促进结直肠肿瘤分化进展[9,27,41,42] 。后续研究发现腺瘤向腺癌转化过程中Fn丰度持续增高[8,42,43]。
Kostic等[4]和Castellarin等[40]对CRC病人和正常人的肠道菌群进行基因组学测序,发现结肠癌组织中Fn丰度显著升高。Chen等[44]验证了之前的研究结果并发现,CRC患者肠腔肿瘤组织中的梭杆菌比例明显高于正常组织(4.97%比0.47%)。2014年,Tahara等[7]发现肿瘤组织中Fn的检出率为52.3%,病变组织临近的正常组织中检出率为30.3%,部分肿瘤组织中Fn丰度较配对的临近组织高出近2倍[40,45,46],直肠到盲肠的肿瘤组织中Fn比例从2.5%逐步增加到11%[42],并且结肠腺瘤中梭菌属所占比例高于正常组织[6,27]。利用组织基因检测法从基因层面也证实了之前的报道,腺瘤、腺癌患者病变组织中FadA基因表达水平高出正常患者的10~100倍[22]。Ito等[43]检测465例结肠癌前病变与511例结肠癌患者肠道组织Fn感染情况时发现,高CpG岛甲基化表型的部位Fn检出率更高,而低或无甲基化表型的病变部位Fn检出率低,提示消化道病变组织中CpG岛甲基化表型及微卫星灶的不稳定性与Fn具有相关性[7,42,43],相关机制需要进一步的探索研究。
各国学者针对正常人群及结肠肿瘤患者粪便中的Fn进行了检测,发现不同地区人群粪便中Fn的检测结果各不相同,欧洲地区两组人群粪便中的Fn丰度无统计学差异[8],而中国[47]、日本[48]及北美地区[9]的调查结果均显示二者之间存在明显的差异性,而且调查显示腺瘤及腺癌患者粪便中梭菌属丰度较正常人群明显升高[9,29,42]。总之,目前对于粪便中Fn检出率能否反映肠道组织中Fn的感染情况尚存在争议,需要进一步大样本的调查研究。
Rubinstein等[22]报道称,Fn作为一种条件致病菌,正常条件下与肠道内其它菌群处于平衡状态。在促进肠道炎症、腺瘤及CRC的过程中,一方面,Fn通过表面的FadA与E-cadherin结合,激活β-catenin通路,促炎、促肿瘤及Wnt通路基因表达均显著升高。使用FadA纯化蛋白刺激肿瘤细胞,结肠癌细胞增殖加快,初步证明FadA通过E-cadherin/β-catenin信号转导,激发细胞炎症反应的同时刺激结肠肿瘤细胞的增殖、分化;另一方面Fn能够协助其它细菌入侵肠上皮细胞,促进肠道疾病的进展[19]。阻断Fn的侵入后,炎症反应无法激活,但促肿瘤因子表达仍增加,推测调控促炎与促肿瘤的信号通路并不完全一致[22]。
2016年日本学者通过检测CRC患者组织标本中的相关因子推测Fn促进CRC作用机制:(1)增加肿瘤组织中活性氧类(ROS)及炎症因子(IL-6、TNF)的表达,引起错配修复蛋白(MLH1)的表观遗传沉默,使微卫星灶不稳定性增加;(2)抑制T细胞调控肿瘤免疫微环境,导致机体抗肿瘤能力减弱;(3)刺激microRNA-21并使IL-10及前列腺素E2(PGE2)表达水平增加,抑制T细胞介导的肿瘤微环境中的适应性免疫[48]。
综合上述有关基因表达、蛋白及信号通路等方面的研究结果,总结Fn可能的促癌机制(图1):(1)慢性炎症诱导体突变、DNA甲基化;(2)Fn结合Toll样受体,导致细胞增殖周期失调;(3)FadA与上皮细胞表面的E-cadherin结合,激活β-catenin通路,致癌基因表达上调,炎症基因表达增加;(4)肿瘤浸润性髓样细胞聚集,肿瘤产生风险增加,炎症加重。
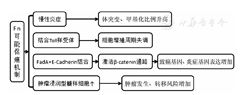

注:Fn. 具核梭杆菌;FadA. 具核梭杆菌黏附蛋白A
研究发现,Fn对上皮细胞及内皮细胞具有黏附、侵袭能力[49,50],这可能是促进肿瘤转移的原因之一。对于欧洲地区CRC患者的组织样本检测发现,患者Fn丰度与生存期呈负相关[42]。国外学者Viljoen等[6]与Mima等[42]检测患者结肠肿瘤组织发现,结直肠肿瘤分期越高,梭菌属的增殖水平就越高,二者之间呈明显的正相关。前期研究也提示,梭菌属丰度与淋巴结转移程度成正相关[51]。检测283例胰腺导管腺癌(PDAC)患者组织,肿瘤组织中梭菌属检出率为8.8%,临床及病理分型与Fn无相关性,却发现梭菌属阳性的胰腺肿瘤患者生存期较未感染者明显缩短[31]。因此研究者推测Fn可能具有一个特殊的电子传递链,使它能够在肿瘤组织低氧环境中继续增殖生存,这可能是肿瘤组织中Fn丰度高的原因之一[9,52]。未来Fn或许可以作为某些消化道肿瘤预后的预测指标之一,而目前Fn与消化道肿瘤进展及预后之间的具体作用机制仍不清,今后可以将其作为消化道肿瘤相关研究的一个方向。
幽门螺杆菌与胃癌、乙型肝炎病毒与肝癌及人乳头瘤病毒与宫颈癌间的相关性,反复证实病原微生物慢性持续感染诱发组织病变的事实。越来越多的证据显示,Fn不仅可导致牙周炎及牙龈炎等多种口腔疾病的发生,同时也与肠道疾病的发生发展密切相关。消化道疾病包括阑尾炎、IBD及CRC等均发现与Fn等微生物相关,并且发现Fn与消化道肿瘤预后相关。Fn可能作为感染源持续存在于肠道,诱发慢性炎症,刺激肠组织细胞不断增生和氧化应激,从基因、蛋白及信号通路等多方面对肠道产生影响,协同其它作用诱导肠组织出现异型增生,诱发病变[29,33,34]。目前,阑尾炎、IBD及CRC等消化道疾患病因和发病机制尚未完全明确,揭示Fn感染在消化道疾患中的作用,为疾病的探索和治疗开辟了新的研究领域,提供新的思路。健康人组织中也能够检测到Fn,并且丰度也可能很高,因此目前将其作为单一的生物指标不太可行,仍需明确Fn与肠道炎症性疾病间的具体作用机制,未来或许可以将其作为预测疾病进展及预后的一项指标。Fn表面的FadA蛋白是其黏附致病的主要结构,未来可能作为疾病治疗的靶点,预防和治疗相关疾病。
利益冲突 无































