近年来对狂犬病病毒(RV)的研究较深入,主要包括野毒、疫苗株及新鉴定的从蝙蝠分离株的基因结构、复制,基因功能与表达调控。根据核蛋白(N)碱基的同源性,将对人类致病RV分为7个基因型,分别归属于Ⅰ、Ⅱ、Ⅲ遗传谱系。人类狂犬病的发病机制尚未完全清楚,在治疗方面未能取得突破,专家对密尔沃基方案评价不认可。从目前动物模型的研究进展来看,新颖的治疗疫苗及抑制病毒复制与扩散药物的研制有前途,促使成功治愈狂犬病大有希望。本文回顾了狂犬病的若干新发现与信息,探讨RV的特性、暴露后对人类的致病机制及发病后的治疗研究的进展,希望对研究者与狂犬病防治者有所参考。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
狂犬病是由动物传播、病死率极高(近100%)的病毒性传染病,临床表现为急性进展性脑脊髓炎,目前在全球范围广泛存在,每年约造成55 000人死亡,其中90%来自亚洲和非洲,即平均每10 min就有1人死亡[1]。2007年,在国际狂犬病控制联盟(ARC)的倡议下,由世界卫生组织(WHO)、世界动物卫生组织(OIC)及美国疾病预防控制中心(CDC)等共同发起了"世界狂犬病日"。为了纪念发明狂犬病疫苗而作出重大贡献的法国微生物家-路易斯·巴斯德(Louis Pasteur,逝世于1895年9月28日),将第一个世界狂犬病日(9月8日)改为每年的9月28日。其口号是:共同努力,使狂犬病成为历史!其目标是:让更多的人知道,狂犬病是可以预防的疾病。2017年9月28日,我们又迎接了第十一个"世界狂犬病日"。为了2030年消除人类狂犬病,从事传染病预防、临床及实验室工作者肩负着重大的任务。首先,复习《狂犬病预防控制技术指南(2016版)》[2]及其相关资料甚为必要。对本病预防的技术处理,虽已在指南中有具体规定,但在狂犬病病毒(Rabies virus,RV)、发病机制与病理及发病后治疗等方面有新进展,笔者学习后对此作解读与探讨,仅供参考。
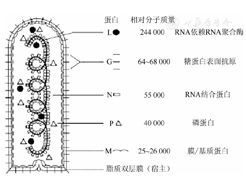
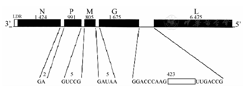
RV属于单股负链病毒目(Mononegavirales),弹状病毒科(Rhabdoviridae),狂犬病病毒属(Lyssavirus)。病毒基因组为单股、不分节段的负链RNA(长约12 kb)。由3′端至5′端结构基因依次排列着5个基因:N(1 424个核苷酸,编码RNA结合蛋白)、P或NS(991个核苷酸,编码磷蛋白)、M(805个核苷酸,M1、M2分别编码衣壳基质与囊膜基质蛋白)、G(1675个核苷酸,编码糖蛋白)和L(6 475个核苷酸,编码大蛋白,即依赖RNA的RNA聚合酶),见图1,图2[2,3,4]。RV属各成员RNA基因非编码间隔区的序列和长度不一样,采用反向遗传学研究该病毒,表明个别基因间隔区在基因表达中有其特定作用,如RV株的G和L基因间是423 nt的空间。
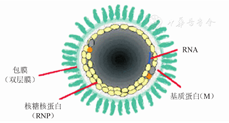
完整的RV病毒由内部螺旋状排列的核壳体及外部包膜两个结构和功能单位组成(图1,图3)[3,4,5,6],其蛋白功能:(1)核壳体由RNA与核蛋白(N)、磷蛋白(P或NS)和聚合酶大蛋白(L)3种蛋白构成;(2)包膜则由糖蛋白(G)和基质蛋白(M)构成。N蛋白是构成成熟病毒粒子核壳体螺旋对称结构的主要成分,占RV蛋白总量的36%。在病毒复制过程中,N蛋白与基因组RNA紧密结合形成核糖核蛋白(Ribonucleoprotein,RNP),才被RNA依颗的RNA聚合酶识别,RNP在诱生保护性免疫应答上也起重要作用。P蛋白与转录酶大蛋白结合,构成完整的病毒RNA聚合酶复合体,还与N蛋白相互作用,实现对病毒的转录、复制等多功能调节;P蛋白也是RV致病性的关键要素之一。L蛋白是RV中最大的结构蛋白,在RV的转录与复制中起催化作用。G蛋白是一种跨膜蛋白,构成病毒表面的突起,是RV与细胞受体结合的配体,成熟的G蛋白可分为膜外区、跨膜区、膜内区三部分,不同毒株的G蛋白糖基化位点数目和位置不全相同,但319位糖基化位点存在于已知的所有RV中。M蛋白在病毒的装配及细胞表面的芽生过程中起重要作用,已知病毒有三个基序:PX(T/S)AP、PPxY、YXXL,是N端晚期出芽结构域(Late-domains),其中PPxY(PPPY,aa35)基序发现在RV的M蛋白中[6,7]。此外,目前正在研究RV中M蛋白与真核翻译起始因子3亚基H(Eif3h)相互作用,发现M蛋白定位于早期小核糖体亚基部分,并参与了抑制经典(类Kozak)5′-UTR的mRNA的体外翻译。研究表明,可作为病毒装配/出芽和病毒转录调节功能的补充,从细胞翻译的机制中,M蛋白可在病毒感染细胞中抑制蛋白与蛋白间相互翻译中起作用[8]。
G蛋白是病毒最主要的抗原,可有效刺激特异性辅助性T细胞(Th)和细胞毒性T细胞(CTL)增生,并诱导机体产生特异性抗体。G蛋白诱导的特异性抗体是狂犬病疫苗最重要的保护性抗体,免疫效果主要依赖其抗原表位、结构、蛋白折叠及糖基化等。N蛋白也是一种有效的保护性抗原,能够刺激B细胞和Th细胞诱导产生细胞和体液免疫。P蛋白可诱导CTL,但保护作用较弱。M1蛋白为特异性抗原,并与M2蛋白构成细胞表面抗原[6]。
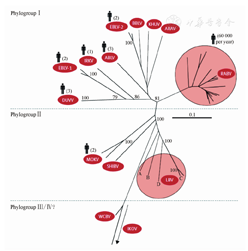
RV在20世纪50年代前一直认为是唯一的,随着血清学和单克隆抗体的发展,基因测序和种系进化分析的支持,发现RV相关病毒的多样性。近期,国际病毒委员会明确15种RV可分为三个谱系,包括5个血清型:Ⅰ型病毒以标准攻击株(Challenge virus standard,CVS)原型株(古典RV和实验株)为代表;Ⅱ型病毒以拉哥斯蝙蝠病毒为代表;Ⅲ型病毒以莫科拉病毒为代表;Ⅳ型以杜文黑基病毒为代表;Ⅴ型病毒即从乌克兰蝙蝠分离出的2株病毒(EBL-1和EBL-2)。血清Ⅰ型的疫苗株对Ⅱ~Ⅳ型RV相关病毒感染仅有很弱的保护作用[4]。
1993年,Bourhy根据N蛋白基因N端500个碱基的同源性,将RV分为6个基因型,其中基因1~4型与血清Ⅰ~Ⅳ型相对应,后又从德国、芬兰、澳大利亚蝙蝠中分离的病毒,分别列为基因5~7型[7]。根据2013年正式公布的《WHO狂犬病专家磋商会第二次报告》所提供的RV属中14种病毒的最新分类和简要说明,又补充了2012年从西班牙Lleida地区长翼蝠中发现的新狂犬病毒[9]。在全球的陆生哺乳动物(含人)中,基因1型RV分布最广,基因2、3、4型分布于非洲,而基因5、6型仅在欧洲发现。已证实在这7种基因型中,除了基因2型外,其余基因型均可引起人类疾病。本文将目前所发现的RV相关病毒属加以归纳,见表1。
| 遗传谱系 | 基因型 | 名 称 | 初始宿主 | 地理分布 | 致死人数/年 |
|---|---|---|---|---|---|
| Ⅰ | 1 | 狂犬病毒(rabies virus,RABV) | 犬类和蝙蝠 | 全球(除澳大利亚、南极和若干岛屿的陆生哺乳动物及美洲的蝙蝠外) | >60 000 |
| 7 | 澳大利亚蝙蝠狂犬病毒(Australian bat lyssavirus, ABLV) | 狐蝠科蝙蝠和食虫蝙蝠(囊喉墓蝠属) | 澳大利亚(含附近的若干岛屿) | 3 | |
| 5 | 欧洲蝙蝠狂犬病毒1型(European bat lyssavirus type 1,EBLV-1) | 食虫蝙蝠(主要Eptesicus serotinus ) | 从西班牙到乌克兰的欧洲大部分地区(主要德国) | <10 | |
| 6 | 欧洲蝙蝠狂犬病毒2型(European bat lyssavirus type 2,EBLV-2) | 食虫蝙蝠(主要Myotis daubentonii和M.dasycneme ) | 西北欧(主要芬兰) | 2 | |
| 库詹德病毒(Khujand virus,KHUV) | 食虫蝙蝠(须鼠耳蝠) | 中亚 | 0 | ||
| 阿拉万病毒(Aravan virus,ARAV) | 食虫蝙蝠(须鼠耳蝠) | 中亚(主要吉尔吉斯坦) | 0 | ||
| 波克罗蝙蝠病毒(Bokeloh bat virus,BBLV) | 食虫蝙蝠(纳氏鼠耳蝠) | 法国,德国 | 0 | ||
| 4 | 伊尔库特病毒(Irkut virus,IRKV) | 食虫蝙蝠(白腹管鼻蝠) | 东亚(俄罗斯、中国东北) | 1 | |
| 杜文黑基病毒 | 食虫蝙蝠 | 撒哈拉以南非洲 | 3 | ||
| Ⅱ | 2 | 拉各斯蝙蝠病毒(Duvenhage virus,DUVV) | 狐蝠科蝙蝠 | 撒哈拉以南非洲 | 0 |
| 3 | 莫科拉病毒(Mokola virus,MOKV) | 未知 | 撒哈拉以南非洲 | 2 | |
| 未定 | 希莫尼蝙蝠病毒(Shimoni bat virus,SHIBV) | 食虫蝙蝠(康氏蝠属) | 肯尼亚 | 0 | |
| Ⅲ | 未定 | 西高加索蝙蝠病毒(West Caucasian Bat virus,WCBV) | 长翼蝠属的食虫蝙蝠 | 欧洲东南部(俄罗斯等) | 0 |
| 未定 | 伊科马狂犬病毒(koma lyssavirus,IKOV) | 未知(非洲灵猫中分离) | 坦桑尼亚 | 0 | |
| 未定 | 莱里达蝙蝠狂犬病毒(Lleida bat virus,LLEBV) | 长翼蝠属 | 西班牙东北部 | 0 |
注:"致死人数/年"因未能继续调查,可能不完全正确
国际上目前公认蝙蝠RV在西半球(南美洲和北美洲)均为基因1型,迄今西半球在所有动物中未发现基因1型以外的狂犬病相关病毒。而在东半球(欧洲、亚洲及澳洲)的蝙蝠中,发现的RV均不属于基因1型。1969至2008年,在中国各地分离的61株RV,均为基因1型,其中51株从犬中分离,从鼬獾及患者中分离各5株[10]。2004年又报道从2 651例(中国五个省)的狗和人类中分离出RV,通过N蛋白基因测序,其同源性为86.6 %~99.9%,这些病毒可分为3个遗传谱系,系统发育分析表明,所有中国分离株与亚洲犬种群的病毒有密切关系,提示在中国流行的RV与以前的流行病中报告的病毒相似,也是基因1型。2013年,中国首次从东北蝙蝠-白腹管鼻蝠(Murina leucogaster)中分离到蝙蝠RV,病毒株名TRKV-TH China12株,其与俄罗斯伊尔库特病毒(Irkut病毒)一致性为92.4%[11]。然而,2005年罗廷荣等[12]在中国广西地区应用RT-PCR技术对犬脑(268份)、蝙蝠(320只)和野鼠(65只)脑组织进行RV检测,并将阳性材料作鼠脑内接种试验。结果表明,犬脑的RV阳性率为1.12%,蝙蝠阳性率为0.94%,野鼠阳性率为3.1%。该调查证明了广西除犬之外,野鼠和蝙蝠等野生动物也携带有RV。后罗廷荣团队[13]在《Virus Genes(2013)》上发表了一篇相关论文,主要内容为在中国广西省2003至2008年收集的2 969份蝙蝠RV样品中,N基因阳性总检出率为2.86%,系统序列分析证明与基因1型的关系最接近。这2篇从广西蝙蝠中分离到基因1型病毒的报道,受到质疑。部分学者认为只有RT-PCR阳性结果而没有直接免疫荧光抗体试验(FAT)或病毒分离证实,是证据不足,也是不可靠的。此后,覃纪敏等[14]采用荧光定量PCR、套式PCR和FAT等方法相结合检测广西564只野生蝙蝠RV,均未能证明阳性。
绝大多数人类狂犬病患者是由于被患狂犬病的动物咬伤所致,少数是由于被抓挠或伤口、黏膜被污染所引起,偶有因移植狂犬病患者捐赠的器官或组织而发病的报道。RV不会侵入没有损伤的皮肤,但其致病机制尚未完全清楚。
RV在侵入神经肌肉接头时,首先病毒G蛋白结合细胞受体。这类受体目前已知主要有烟碱乙酰胆碱受体(Nicotinic acetylcholine receptor,nAchR)、神经细胞黏附分子(Neural cell adhesion molecule,NCAM)及神经营养因子p75受体(Law-affinity neuropin receptor,p75NTR)三种。其中位于突触后膜的nAchR和位于突触前膜的NCAM起到了重要的介导作用[15]。p75NTR可能会促进RV在神经轴突内的逆向移动,但并非对RV感染最初神经元是必需的[16]。此外,细胞膜上的神经节糖苷(Gangliosides)也可能参与RV的侵入。最新研究显示,细胞膜动力蛋白的轻链可与RV的磷酸化蛋白相互作用,细胞膜动力蛋白是细胞微管转运系统的重要组成成分,因此推断其可协同RV在体内移行。
RV嗜神经性是自然感染的主要特征,病毒的复制几乎只限于神经元内。病毒最初进入伤口时,不进入血液循环(通常在血液中检测不到病毒),而是在被咬伤的肌肉组织中小量增殖,在局部可停留1~2周或更久(>72 h),然后通过运动神经元的终板(End plates)和轴突(Axons)侵入外周神经系统,并以运输小泡(Transport vesicles)为载体,沿轴突以逆轴索浆运动的方向,向中枢神经系统"向心性"扩展,而不被感觉或交感神经末梢所摄取(一些蝙蝠变异株病毒增殖也可以发生在感觉神经内)[17]。病毒体进入外周神经后,其移行速度取决于转运方式,以3 mm/h的速度至脊髓的背根神经节(Dorsal root ganglia)再大量繁殖,然后侵入脊髓和整个中枢神经系统。主要以侵犯脑干、小脑等处的神经细胞为主,一般不进入血流。随后病毒从中枢神经再向周围神经扩展,侵入各器官组织,尤以唾液腺、舌部味蕾、嗅神经上皮等处病毒量较多。由于迷走、舌咽及舌下脑神经核受损,吞咽肌及呼吸肌痉挛,可出现恐水、吞咽和呼吸困难等症状。若交感神经受累时可出现唾液分泌和出汗增多;迷走神经节、交感神经节和心脏神经节受损时,可引起病人心血管功能紊乱或猝死。
研究表明,除RV诱导产生的中和抗体外,干扰素和细胞介导的免疫在预防疾病形成方面同样扮演着重要角色。另一方面,RV可通过不同的机制来抑制宿主的免疫反应,如直接抑制宿主的基因表达、隔离病原相关分子模式或者修饰细胞因子信号途径,这些均能防碍宿主对抗RV入侵的保护性免疫反应。病毒利用完整的血脑屏障的免疫逃避作用,妨碍了对存在中枢神经系统中病毒的彻底清除。尚无明确证据显示,在RV感染的患者中存在免疫抑制或加速死亡。
当病毒进入皮肤或肌肉后,可立即触发宿主先天免疫反应。先天免疫系统能够通过种系模式识别受体(PRRs)来鉴定RV进化的保守结构,如病原相关分子模式(PAMPs)和危险相关分子模式(DAMPs)等。在PRRs家族中主要有Toll样受体(TLRs)、视黄酸诱导基因-I样受体(RLRs)和黑色素瘤分化相关基因5(MDA5)、热蛋白、HIN200结构域蛋白(PYHIN家族)和核苷酸结合寡聚化结构域(NOD)样受体(NLRs,如NOD1、NOD2蛋白是细胞内微生物传感器)。病毒一旦到达中枢神经系统(CNS)组织,即可在神经元、星形胶质细胞和小神经胶质细胞中诱发一种由RIG-I介导的反应,该反应可激发一个经典的初级IFN应答(激活IRF3和NF-κB)和次级IFN应答(激活STATs和IRF7),从而导致产生细胞因子和趋化因子(如IL-6、TNF-α、IFN-γ、IL-12、IL-5、CCL2和CXCL10等)能干扰血脑屏障(BBB)的渗透性,但这些细胞因子也会对神经元造成损伤。
RV逃脱免疫的机制[18]: RV蛋白能够阻碍核转录因子kB(NF-kB)的诱导,影响IFN-β的产生,又能导致树突细胞中I型MHC和IFN的下调表达,一旦神经元感染,会表达Fas L、B7-H1和HLA-G,可以与在T细胞表面表达的相应受体而相互作用,即Fas对应FasL,PD-1对应B7-H1,CD8对应HLA-G等。分子间的相互作用也会触发CD4+/CD8+T细胞和自然杀伤细胞(NK)的损耗和/或消亡,这些都会有助于病毒在神经系统中的逃脱。
神经元细胞凋亡被认为参与了RV的致病过程,这个结论是依据神经细胞株的体外研究和接种实验室毒株的小鼠实验而得出的[18]。然而,感染野生型病毒的小鼠尽管表现出与疾病相关的临床症状,但其体内仅含有极少量的TUNEL阳性神经元(Tunel/Neun),提示细胞凋亡或许并不是一个必需的神经致病性机制。
主要的病理变化为急性弥漫性脑脊髓炎改变,其特征:(1)脑实质和脑膜水肿、充血及微小血管出血;(2)神经细胞胞质内包涵体;(3)血管周围单核细胞及浆细胞浸润;(4)小神经胶质细胞浸润;(5)神经细胞空胞形成、透明变性和染色体分解,血管周围单核细胞浸润等。
常见以大脑基底面海马回和脑干部位(中脑、桥脑和延髓)及小脑损害最为明显,外观有充血、水肿和微小出血等。镜下脑实质有非特异的神经细胞变性与炎性病变,如血管周围单核细胞浸润等,脑膜多正常。脊髓病变以下段较明显,是因病毒沿受伤部位转入神经,经背根节、脊髓入脑。故咬伤部位相应接近背根节、脊髓段者,其病变常较严重。多数病例在肿胀或变性的神经细胞浆中,可见到1至数个圆形或卵圆形、直径约3~10 μm的嗜酸性包涵体,即内基小体(Negri body)。内基小体呈圆形或椭圆形,直径约3~10 μm边缘整齐,内有1~2个状似细胞核的小点,常见于海马及小脑Purkinje组织的神经细胞中,偶亦见于大脑皮层的锥体细胞层、脊髓神经细胞、后角神经节和交感神经节等。电子显微镜下可见内基小体内为病毒集落,是该病特异并具有诊断价值的病变,但约20%的患者为阴性。此外,也出现唾液腺肿胀,质柔软,腺泡细胞明显变性,腺组织周围有单核细胞浸润。表现急性细胞变性者尚有胰腺腺泡和上皮、胃黏膜壁细胞、肾上腺髓质细胞、肾小管上皮细胞等。
人狂犬病为急性进行性脑脊髓炎,临床症状可表现为狂躁型和麻痹型,并且这两者不能采用RV在中枢神经系统内的特异性病理解剖定位来区分。主要的临床体征可能是由不同位点的特异性反应所致,神经功能障碍也可解释昏迷症状的发生。电生理学方法研究病理机制发现,麻痹型狂犬病的虚弱症状与外周神经轴突病变或脑白质变性有关。总之,从狂犬病死亡病例中提示,有些主要死因并非中枢神经本身的严重病理损害,而是与中枢神经系统功能紊乱相关。
首先对狂犬病病例要有明确诊断,根据标准,包括流行病学、临床表现和实验室检查结果进行综合判断,确诊一定需要实验室证据[2]。临床诊断病例,符合下列任何一项即可诊断:(1)典型的狂躁型狂犬病临床表现;(2)明确的动物致伤史+典型的麻痹型狂犬病临床表现;(3)实验室检查,符合下列实验室标准中的1种或几种即可确诊:①直接荧光抗体法或ELISA法:检测患者唾液、脑脊液或颈后带毛囊的皮肤组织标本中RV抗原阳性,或用RT-PCR检测RV核酸阳性;②细胞培养方法:从患者唾液或脑脊液等标本中分离出RV;③脑组织检测:尸检脑组织标本,用直接荧光抗体法或ELISA法检出RV抗原阳性、RT-PCR检出RV核酸阳性或分离出RV。
近年来,虽然对犬咬或其他公认的途径暴露,及时注射狂犬病疫苗和RV免疫球蛋白能有效预防狂犬病,但是能拯救已出现狂犬症状的患者的有效方法,还没有一种得到确认。人类狂犬病的治疗仍是一个巨大的挑战,现代医学常规处理方法,主要是抗病毒、保护患者神经元与支持治疗,包括严格隔离,防止唾液等污染;重症监护治疗,如维持心血管、呼吸系统功能;支持治疗,补充营养与体液平衡等。虽能延长患者存活时间,但至今仍未实现零的突破。2004年以来联合"密尔沃基方案"(Milwaukee protocol)治疗取得数例的成功及若干新颖抗病毒制剂的发现,引起医学界的关注。然而大量后续应用"密尔沃基方案"均未获理想的成功。虽然如此,目前科学家仍认为抗病毒是关健,正在利用动物模型实验治疗研究开发多种抗病毒制剂,相信不久可成功治愈狂犬病。本文对密从尔沃基方案、新颖抗病毒制剂、保护神经元治疗及未来方向等作重点介绍,供研究者及临床参考。
此方案于2004年由美国Wisconsin医学院儿科医院罗德尼.威洛比(Rodney E Wiloughby)副教授创建,他以氯胺酮(Ketamine,剂量为0.5~1.0 mg·kg-1·d-1)"诱导昏迷"为主的神经元保护方法,同时加用抗病毒药物金刚烷胺(200 mg/d)等联合疗法(新版方案已删除利巴韦林)。又加用镇静剂咪达唑仑(Midzolam)及防止脑动脉痉挛的尼莫地平(Nimodipine),抢救了一例15岁狂犬病患者珍娜.基思(Jeanna Giese,女,蝙蝠传播)成功,创造了奇迹(具体方法见Milwaukee protocol指南,第4英文原版)[19]。2011年4月25日,美国8岁女童普米舍丝·雷诺兹(Precious Reynolds)被野猫咬伤而证实为狂犬病,深度昏迷了一周,采用密尔沃基方案治疗,获得成功。据威洛比说,已有11例狂犬病患者治愈康复(秘鲁4例,美国2例,哥伦比亚、巴西、智利、印度、卡塔尔各1例),美国首例(珍娜)已产下一名健康孩子。
此后,据文献报道,经密尔沃基方案治疗中,有6例证据较完整发病后幸存的狂犬病患者,但这些幸存者都在出现症状前曾接种过狂犬病疫苗。对这6例幸存者进行随访,其预后并不理想,有的出现了严重后遗症,有些生命仅延缓了2~4年,其中只有2例仅轻微或无神经系统后遗症者是被蝙蝠RV感染者[20,21,22]。据报道至2014年,全世界狂犬病幸存者有13例(2014年4月印度报道最后一例),直至2016年Manoj等[23]又报道一例存活,共14例。加拿大曼尼托巴大学(University of Manitoba)狂犬病权威专家Alan C Jackson对密尔沃基方案并不认可,其主要理由[22,23,24]:(1) 7例中有3例蝙蝠感染,2例猫感染,这两种动物带有蝙蝠突变株,致病力可能较轻;(2)上述治疗成功2例,暴露后虽非使用疫苗及免疫血清,但在其唾液中未测到病毒核酸,只有在其血清中免疫荧光法(IFA)检测到特异性抗体IgM和IgG;(3)除6例外,其他多数犬类感染患者按密尔沃基方案治疗均未获成功。其他"诱导昏迷"的治疗方法,国内曾有报道[25],应用亚冬眠治疗可延长狂犬病患者生存时间:42例兴奋期的狂犬病患者分为实验组和对照组,实验组患者以氯丙嗪和异丙嗪混合(0.5~1.0 mg/kg)给药,对照组患者给予安定等镇静治疗,结果显示,两组均无治愈,但实验组平均生存时间为6.8 d,对照组平均生存时间为4.2 d,实验组临床症状也较轻。1992年,宁波市微循环与莨菪类药研究所,首创东莨菪碱(Scopolamine)联合氯丙嗪的"杨氏1+1戒毒法"研究成功,这种方法类似诱导性昏迷为主的疗法,也可能有保护神经元作用。因此有人提出,该方法是否可以部分或完全代替氯胺酮组合到密尔沃基方案治疗狂犬病,在机制及原则上是否合理,尚待研究。
我国科学家将聚肌胞(poly I:C)与卡那霉素和Ca2+结合成聚肌胞卡钙(PICKCa)后,成为能产生快速强烈的细胞免疫和体液免疫的新型皮卡佐剂狂犬病疫苗[26,27]。这种疫苗具有良好的保护效果,明显优于无此佐剂的市售疫苗。因此,皮卡佐剂狂犬病疫苗有可能发展为一种治疗性疫苗。2013年9月,国家科技部重大专项实施管理办公室将皮卡佐剂狂犬病疫苗的研究列入"重大新药创制"项目。2014年11月,该项目获得了新加坡医药卫生署批准的I期临床试验资质。同时,该疫苗还成功将免疫疗程从目前的28 d缩短至一周,注射次数由5针减少到3针,为接种人群带来了极大方便。
该产品由依生生物制药有限公司自主开发,采用全新的能够激活免疫细胞Toll样受体3(TLR-3)的皮卡佐剂技术。皮卡是稳定的双链RNA化学类似物,被用来作为狂犬病疫苗的佐剂。临床前的研究结果示,皮卡狂犬病疫苗可增强体液免疫和细胞免疫,能显著地降低感染狂犬病野毒株小白鼠死亡率,明显地优于法国维尔博狂犬病疫苗和国产铝佐剂狂犬病疫苗(P<0.01)。法国与国产疫苗对暴露后小白鼠的保护率为0,人用皮卡佐剂狂犬病疫苗保护率为75%[26]。其成果于2016年1月在美国《病毒学》期刊上发表,题为"一种创新型利用Toll样受体3激动剂的狂犬病疫苗在动物实验中展现出优秀的安全性和有效性"[27]。病毒攻击后,使用皮卡佐剂狂犬病疫苗动物的存活率为70%~80%,而非本佐剂疫苗组(对照)的存活率为20%~30%。根据毒性试验结果,皮卡和皮卡佐剂狂犬病疫苗在小鼠中表现出良好的耐受性。2017年11月22日已开始临床Ⅱ期研究,随机选取126名健康受试者,其结果显示皮卡疫苗具有良好的耐受性与抗原性[28]。因此,这项研究表明皮卡佐剂狂犬病疫苗是一种有效且安全的疫苗,既可用于暴露后预防性又可用于发病后治疗性的一种疫苗,正准备开展Ⅲ期临床验证。
DRACO具有广谱抗病毒的疗效,并在小鼠体内发现了有效的对抗流感病毒作用。据报道,病毒感染的哺乳动物细胞会有选择性地诱导快速凋亡,而未受感染的细胞则无损伤[30,31]。DRACO的作用原理是触发被入侵细胞的自杀功能,阻止病毒感染,而健康细胞则无损害。当病毒感染健康细胞后会占领并利用细胞的复制机制,产生长的双链RNA(dsRNA),这标志着细胞已经被感染。一旦病毒完成复制,就会杀死宿主细胞,然后入侵其他细胞。而人体内有些附着在dsRNA上的蛋白质可以阻止病毒进行自我复制。科学家把其中一种蛋白质和另一种能导致细胞凋亡的蛋白质结合在一起,研制出了DRACO。该药利用人体细胞的自然防御系统对抗病毒。试验已证明DRACO对15种病毒有效,包括H1N1禽流感病毒、登革热、脊髓灰质炎病毒、胃肠病毒和几种出血热病毒等[30]。动物试验表明对狂犬病发病也有效。
OSU-03012是塞来昔布(Celecoxib)的衍生物,也被称作AR-12,是一种有效的重组磷酸肌醇依赖性激酶-1(Phosphoinositide-dependent kinase 1,PDK-1)抑制剂。化学名:2-amino-N-[4-[5-phenanthren-2-yl-3-(trifluoromethyl) pyrazol-1-yl] phenyl] acetamide,其分子式:C26H19F3N4O。塞来昔布是一种近年来新上市的非甾体抗炎药物(NSAID),是一种选择性环氧化酶-2(Cyclooxygenase-2,COX2)抑制剂[31],主要用来解热、镇痛和抗风湿治疗。AR-12的抗癌活性比塞来昔布高,但是不能抑制COX2。在动物模型中,AR-12证实能抑制多种肿瘤的生长,又能对多种病毒和细菌感染有作用。研究人员证实,AR-12能有效地抑制RV、艾滋病病毒(包括耐药性HIV毒株)、基孔肯雅病毒、麻疹病毒、风疹病毒、呼吸道合胞病毒、马尔堡病毒、拉沙病毒、巨细胞病毒、柯萨奇病毒、腺病毒、登革热病毒、西尼罗河病毒、黄热病病毒和肠道病毒71型的复制能力。AR-12也能降低多种HSP90和HSP70家族分子伴侣的功能和ATP酶活性。与某些药物组合使用时,AR-12可通过降低靶细胞表面的病毒受体表达和阻止被感染的细胞中的病毒复制,降低其感染性。动物试验表明[32]AR-12可用于治疗已发病的RV感染实验动物,目前该药正准备在多国进行临床试验,中国已有公司进口或仿制,但费用极昂贵。
卡拉胶(Carrageenan),又称为角叉菜胶、麒麟菜胶、石花菜胶和鹿角菜胶等,因其是从红藻类海草中提炼出来的亲水性胶体,其化学结构是由半乳糖及脱水半乳糖所组成的多糖类硫酸酯的钙、钾、钠、铵盐。由于其中硫酸酯结合形态的不同,产生了3种主要类型的卡拉胶:κ-型(Kappa form)、I-型(Iota form)、λ-型(Lambda form)。研究发现,卡拉胶对许多病毒(主要为包膜病毒与裸病毒)有抑制作用。其中λ-卡拉胶P32在抑制RV感染中的潜在作用引起医学界注意,研究结果显示,P32特异性地抑制多种RV毒株在多种细胞系中的复制,并显示出低细胞毒性[33]。P32主要在吸附后期的早期阶段消除病毒复制,不仅可影响病毒的内在化,还可通过阻断RVG蛋白介导的细胞融合来影响病毒脱壳。此外,P32在吸附后期可完全抑制体外RV感染,而与P32具有相似结构的肝素和硫酸乙酰肝素则显示对RV感染性不完全抑制。总之,λ-CG P32是一种有前途的药物,主要通过抑制病毒内化和G蛋白介导的细胞融合来抑制RV感染,可用于开发新型抗RV药物。
本文目的是回顾狂犬病的若干新发现与信息,探讨RV的特性、暴露后对人类的致病机制及发病后的治疗研究的进展,希望对研究者与狂犬病防治者有所参考。近年来对狂犬病病毒的研究较深入,主要包括野毒、疫苗株及新鉴定的从翼手目哺乳动物(蝙蝠)分离株的基因结构、复制,基因功能与表达调控。根据N蛋白碱基的同源性,将对人类致病RV分为7个基因型,分别归属于Ⅰ、Ⅱ、Ⅲ遗传谱系。人类狂犬病的发病机制尚未完全清楚,在治疗方面未能取得突破。专家对密尔沃基方案评价虽然不认可,但对一些狂躁型或兴奋期患者,保护其神经元或延长存活期及减轻患者痛苦可能会有帮助。从目前动物模型的研究进展来看,新颖的治疗性疫苗(PIKA佐剂疫苗)及抑制病毒复制与扩散的药物,如DRACD、AR-12、λ-CG P32及抗RV多克隆免疫球蛋白等的研制有前途,促使成功治愈狂犬病的希望很大。
无