
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
NDM-1是一种新型的金属β-内酰胺酶,又称为新德里金属β-内酰胺酶-1。产NDM-1细菌常对包括碳青霉烯类在内的所有β-内酰胺类抗生素耐药[1]。自2008年Yong等[2]首次报道之后,blaNDM-1在世界范围内开始播散流行,给临床抗感染治疗带来极大挑战,对感染防控构成严重威胁。由于NDM-1具有严重耐药性和播散速度快的特点,已成为全球重点关注的问题。在中国,大多数已发现的产NDM-1菌株属于不同序列型(Sequence type,ST),呈散在分布。但Jin等[3]报道山东省发现产NDM-1肺炎克雷伯菌的小范围暴发流行。因此,加强对这些菌株的监测,有助于临床抗感染治疗,有效的预防与控制这些菌株在医院感染的发生、流行和暴发。为了阐明携带NDM-1基因菌株临床感染特点及流行病学特征,本研究对分离自我院的17株携带NDM-1基因菌株感染患者的临床资料进行了回顾性分析,同时采用多位点序列分型(Multilocus sequence typing,MLST)技术对测试菌株进行了分型,报道如下。
收集2013年5月至2015年11月临床分离的非重复耐碳青霉烯肠杆菌(Carbapenem-resistant Enterobacteriaceae,CRE)[亚胺培南最小抑菌浓度值(MIC)≥4 μg/mL],共26株。其中肺炎克雷伯菌17株、大肠埃希菌5株、阴沟肠杆菌3株和产酸克雷伯菌1株,来自痰标本10株、尿液6株、血液5株、分泌物2株、导管1株、咽拭子1株和肛周拭子1株。试验所用菌株采用法国梅里埃公司的Vitek 2 Compact和MALDI-TOF MS(Bruker)进行菌种鉴定。质控菌株大肠埃希菌25922和肺炎克雷伯菌700603购自卫生部临床检验中心。
Vitek 2 Compact全自动细菌鉴定仪、配套药敏卡AST-GN16(法国生物梅里埃公司);MALDI-TOF MS质谱鉴定仪(Bruker);PCR扩增仪(美国Perkin Elmer公司);水平电泳仪(北京六一仪器厂);Gel Doc XR+凝胶成像系统仪(美国Bio-Rad公司)。所有引物由上海Sangon公司合成。
Vitek 2 Compact系统配套药敏卡对细菌进行药敏试验,操作和结果判读参照美国临床实验室标准化协会(CLSI)2016年标准执行。
采用煮沸法,挑取血平板上18~24 h培养后的新鲜菌落,将其放入盛有100 μL去离子水的1.5 mL EP管中,然后放入加热仪中,经100 ℃ 15 min后,12 000×g离心5 min,取上清液作为PCR扩增模板。
委托上海Sangon公司合成4对碳青霉烯酶基因引物,包括KPC、NDM、IMP、VIM,反应体系为25 μL,参数分别为:blaKPC、blaNDM 94 ℃预变性5 min,94 ℃ 30 s,55 ℃ 30 s,72 ℃ 60 s,35个循环后,72 ℃延伸10 min。blaIMP、blaVIM为96℃预变性5 min,96 ℃ 60 s,58 ℃ 60 s,72 ℃ 60 s,30个循环后,72 ℃延伸10 min。反应结束后取5 μL PCR产物经含溴化乙锭的1.5%琼脂糖凝胶电泳。电泳结束后凝胶置于Gel Doc XR+凝胶成像仪中进行摄像,并保存图片[4]。与标准条带相比,在预期位置出现的条带为阳性。
将PCR扩增阳性产物送上海Sangon公司进行测序。测得DNA序列利用NCBI网站(http: //www.ncbi.nlm.nih.gov/)的Blastn程序进行比对,确定基因型。
26株CRE菌株基因检测结果显示,有18株blaNDM基因阳性,9株blaKPC基因阳性,blaVIM、blaIPM均为阴性。18株blaNDM基因阳性菌株分别为肺炎克雷伯菌9株、大肠埃希菌5株、阴沟肠杆菌3株和产酸克雷伯菌1株,其中1株肺炎克雷伯菌同时携带blaNDM和blaKPC基因,予以剔除。9株blaKPC基因阳性菌株均为肺炎克雷伯菌。将PCR阳性扩增产物委托上海Sangon公司进行纯化测序,测序结果提交到GenBank在线数据库进行比对,结果与blaNDM-1和blaKPC-2基因序列一致。
17株产NDM-1菌株药敏结果显示,对厄他培南、亚胺培南、头孢曲松、头孢吡肟和氨苄西林均耐药,其中亚胺培南MIC≥8 μg/mL。除1株肺炎克雷伯菌和1株大肠埃希菌对哌拉西林/他唑巴坦中介外,其他均耐药。除1株肺炎克雷伯菌对氨曲南中介及1株大肠埃希菌和1株产酸克雷伯菌对氨曲南敏感外,其余菌株对氨曲南均耐药。除1株大肠埃希菌对阿米卡星耐药及1株肺炎克雷伯菌对替加环素耐药外,其余菌株对阿米卡星、替加环素均敏感。3株肺炎克雷伯菌、2株大肠埃希菌和1株产酸克雷伯菌对庆大霉素敏感。1株肺炎克雷伯菌、2株大肠埃希菌和1株产酸克雷伯菌对妥布霉素敏感。4株肺炎克雷伯菌、1株阴沟肠杆菌和1株产酸克雷伯菌对环丙沙星敏感。5株肺炎克雷伯菌、1株阴沟肠杆菌和1株产酸克雷伯菌对左旋氧氟沙星敏感。2株肺炎克雷伯菌、1株大肠埃希菌、2株阴沟肠杆菌和1株产酸克雷伯菌对复方黄胺甲噁唑敏感。抗菌药物对NDM-1肠杆菌科细菌MIC见表1。
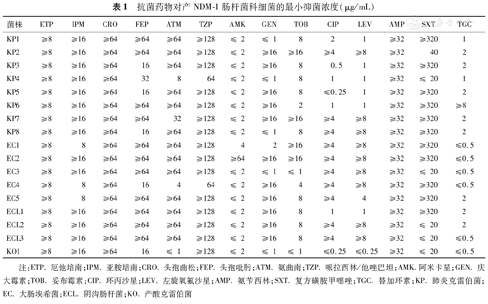
抗菌药物对产NDM-1肠杆菌科细菌的最小抑菌浓度(μg/mL)
抗菌药物对产NDM-1肠杆菌科细菌的最小抑菌浓度(μg/mL)
| 菌株 | ETP | IPM | CRO | FEP | ATM | TZP | AMK | GEN | TOB | CIP | LEV | AMP | SXT | TGC |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| KP1 | ≥8 | ≥16 | ≥64 | ≥64 | ≥64 | ≥128 | ≤ 2 | ≤ 1 | 8 | 2 | 1 | ≥32 | ≥320 | 1 |
| KP2 | ≥8 | ≥16 | ≥64 | ≥64 | ≥64 | ≥128 | ≤ 2 | ≥16 | ≥16 | ≥4 | ≥8 | ≥32 | 40 | 2 |
| KP3 | ≥8 | ≥16 | ≥64 | 16 | ≥64 | ≥128 | ≤ 2 | ≥16 | 8 | 0.5 | 1 | ≥32 | ≥320 | 2 |
| KP4 | ≥8 | ≥16 | ≥64 | 32 | 8 | 64 | ≤ 2 | ≤ 1 | 8 | 1 | 1 | ≥32 | ≤ 20 | 1 |
| KP5 | ≥8 | ≥16 | ≥64 | 16 | ≥64 | ≥128 | ≤ 2 | ≥16 | 8 | ≤0.25 | 1 | ≥32 | ≥320 | 2 |
| KP6 | ≥8 | ≥16 | ≥64 | ≥64 | ≥64 | ≥128 | ≤ 2 | ≥16 | 2 | 1 | 1 | ≥32 | ≥320 | ≥8 |
| KP7 | ≥8 | ≥16 | ≥64 | ≥64 | 32 | ≥128 | ≤ 2 | ≥16 | ≥16 | ≥4 | ≥8 | ≥32 | ≥320 | 2 |
| KP8 | ≥8 | ≥16 | ≥64 | 16 | ≥64 | ≥128 | ≤ 2 | ≤ 1 | 8 | ≥4 | ≥8 | ≥32 | ≥320 | 2 |
| EC1 | ≥8 | 8 | ≥64 | ≥64 | ≥64 | ≥128 | 4 | 2 | ≥16 | ≥4 | ≥8 | ≥32 | ≥320 | ≤0.5 |
| EC2 | ≥8 | ≥16 | ≥64 | ≥64 | ≥64 | ≥128 | ≥64 | ≥16 | ≥16 | ≥4 | ≥8 | ≥32 | ≥320 | ≤0.5 |
| EC3 | ≥8 | ≥16 | ≥64 | ≥64 | ≥64 | ≥128 | ≤ 2 | ≤ 1 | ≤ 1 | ≥4 | ≥8 | ≥32 | ≤ 20 | ≤0.5 |
| EC4 | ≥8 | 8 | ≥64 | 16 | 4 | 64 | ≤ 2 | ≥16 | 4 | ≥4 | ≥8 | ≥32 | ≥320 | ≤0.5 |
| EC5 | ≥8 | 8 | ≥64 | ≥64 | ≥64 | ≥128 | ≤ 2 | ≥16 | 8 | ≥4 | 4 | ≥32 | ≥320 | 2 |
| ECL1 | ≥8 | ≥16 | ≥64 | ≥64 | ≥64 | ≥128 | ≤ 2 | ≥16 | 8 | 1 | 1 | ≥32 | ≥320 | 2 |
| ECL2 | ≥8 | ≥16 | ≥64 | ≥64 | ≥64 | ≥128 | ≤ 2 | ≥16 | 8 | ≥4 | ≥8 | ≥32 | ≤ 20 | 2 |
| ECL3 | ≥8 | ≥16 | ≥64 | ≥64 | ≥64 | ≥128 | ≤ 2 | ≥16 | 8 | ≥4 | ≥8 | ≥32 | ≤ 20 | ≤0.5 |
| KO1 | ≥8 | ≥16 | ≥64 | 16 | ≤ 1 | ≥128 | ≤ 2 | ≤ 1 | ≤ 1 | ≤0.25 | ≤0.25 | ≥32 | ≤ 20 | ≤0.5 |
注:ETP.厄他培南;IPM.亚胺培南;CRO.头孢曲松;FEP.头孢吡肟;ATM.氨曲南;TZP.哌拉西林/他唑巴坦;AMK.阿米卡星;GEN.庆大霉素;TOB.妥布霉素;CIP.环丙沙星;LEV.左旋氧氟沙星;AMP.氨苄西林;SXT.复方磺胺甲噁唑;TGC.替加环素;KP.肺炎克雷伯菌;EC.大肠埃希菌;ECL.阴沟肠杆菌;KO.产酸克雷伯菌
17株产NDM-1肠杆菌科细菌分别来自17例患者,对17例病例进行回顾分析。5例患者(病例8、12、13、14和15)虽分离到产NDM-1细菌,均未入住ICU病房,无多脏器功能衰竭,未予抗生素治疗,给予相应对症支持治疗,如予肠内营养、降糖和降脂等,好转出院。病例2、7和10,患者均未入住ICU病房,无多脏器功能衰竭,无机械通气,给予抗生素积极治疗,好转出院。病例1和4为婴儿,病例1诊断为肺炎,入院8 d后分离到NDM-1菌株,使用抗生素治疗,8 d后好转出院;病例4也诊断为肺炎,在进入本院治疗24 h内分离到NDM-1菌株,进行抗菌治疗,12 d后好转出院。3例患者(病例3、5和11)曾入住ICU,分离菌株前有长时间住院史,伴有多种脏器功能衰竭,有机械通气,死亡原因与基础疾病有关,与产NDM-1细菌感染关系并不明确。病例6,患者高龄,伴有呼吸衰竭,肝、肾功能衰竭,高血压、冠心病和糖尿病等多种疾病,入住ICU 2 d后分离到NDM-1细菌,死亡原因仍与基础疾病有关。病例9,患者高龄,伴有肝功能损害、呼吸衰竭、肾功能衰竭、心力衰竭和糖尿病等多种疾病,未曾入住ICU病房,分离菌株前有长时间住院史,虽予抗生素积极治疗,无效死亡,死亡原因与基础疾病有关。病例16、17,患者主动要求出院,治疗结果不详。17例产NDM-1肠杆菌科细菌感染患者的临床资料见表2。
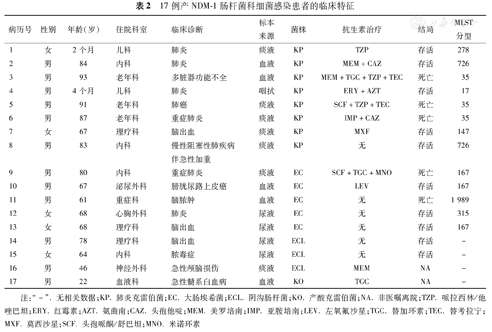
17例产NDM-1肠杆菌科细菌感染患者的临床特征
17例产NDM-1肠杆菌科细菌感染患者的临床特征
| 病历号 | 性别 | 年龄(岁) | 住院科室 | 临床诊断 | 标本来源 | 菌株 | 抗生素治疗 | 结局 | MLST分型 |
|---|---|---|---|---|---|---|---|---|---|
| 1 | 女 | 2个月 | 儿科 | 肺炎 | 痰液 | KP | TZP | 存活 | 278 |
| 2 | 男 | 84 | 内科 | 肺炎 | 血液 | KP | MEM+CAZ | 存活 | 726 |
| 3 | 男 | 93 | 老年科 | 多脏器功能不全 | 血液 | KP | MEM+TGC+TZP+TEC | 死亡 | 35 |
| 4 | 男 | 4个月 | 儿科 | 肺炎 | 咽拭 | KP | ERY+AZT | 存活 | 17 |
| 5 | 男 | 91 | 老年科 | 肺癌 | 痰液 | KP | SCF+TZP+TEC | 死亡 | 35 |
| 6 | 男 | 87 | 老年科 | 重症肺炎 | 痰液 | KP | IMP+CAZ | 死亡 | 35 |
| 7 | 女 | 67 | 理疗科 | 脑出血 | 痰液 | KP | MXF | 存活 | 147 |
| 8 | 男 | 83 | 内科 | 慢性阻塞性肺疾病 | 痰液 | KP | 无 | 存活 | 726 |
| 伴急性加重 | |||||||||
| 9 | 男 | 80 | 内科 | 重症肺炎 | 痰液 | EC | SCF+TGC+MNO | 死亡 | 167 |
| 10 | 男 | 67 | 泌尿外科 | 膀胱尿路上皮癌 | 血液 | EC | LEV | 存活 | 167 |
| 11 | 男 | 61 | 重症科 | 脑脓肿 | 血液 | EC | 无 | 死亡 | 1 989 |
| 12 | 女 | 68 | 心胸外科 | 肺炎 | 尿液 | EC | 无 | 存活 | 315 |
| 13 | 女 | 68 | 理疗科 | 脑出血 | 尿液 | EC | 无 | 存活 | 167 |
| 14 | 男 | 78 | 理疗科 | 脑出血 | 尿液 | ECL | 无 | 存活 | - |
| 15 | 女 | 64 | 内科 | 脓毒症 | 尿液 | ECL | 无 | 存活 | - |
| 16 | 男 | 46 | 神经外科 | 急性颅脑损伤 | 痰液 | ECL | MEM | NA | - |
| 17 | 男 | 22 | 血液科 | 急性髓系白血病 | 血液 | KO | TGC | NA | - |
注:"-".无相关数据;KP.肺炎克雷伯菌;EC.大肠埃希菌;ECL.阴沟肠杆菌;KO.产酸克雷伯菌;NA.非医嘱离院;TZP.哌拉西林/他唑巴坦;ERY.红霉素;AZT.氨曲南;CAZ.头孢他啶;MEM.美罗培南;IMP.亚胺培南;LEV.左氧氟沙星;TGC.替加环素;TEC.替考拉宁;MXF.莫西沙星;SCF.头孢哌酮/舒巴坦;MNO.米诺环素
17例携带NDM-1肠杆菌科细菌患者中,来源科室主要为内科、老年科和理疗科,临床诊断以肺炎为主。其中男性患者多于女性,男性12例,女性5例。年龄以60岁以上为主,占76%,平均年龄(62.29±29.16)岁。标本来源以痰液(41%)、血液(29%)和尿液(24%)为主。菌种分布以肺炎克雷伯菌所占比例最高(47%),其次为大肠埃希菌(29%)、阴沟肠杆菌(18%)和产酸克雷伯菌(6%)。17例CRE患者中5例死亡,病死率为29%。对17株产NDM-1肠杆菌科细菌进行MLST分型分析,其中8株携带NDM-1肺炎克雷伯菌,MLST分型共有5种ST型,其中有3株为ST35型,2株为ST726型,1株为ST278型,1株为ST17型,1株为ST147型;5株携带NDM-1大肠埃希菌MLST分型共有3种ST型,其中有3株为ST167型,1株为ST315型,1株为ST1 989型。3株阴沟肠杆菌和1株产酸克雷伯菌未做分型,其中产酸克雷伯菌因无数据库而未进行分型。MLST分型结果见表2。
碳青霉烯类抗菌药物具有良好的通透性和广谱抗菌活性,目前被认为是治疗高产AmpC酶和超广谱β-内酰胺酶肠杆菌科细菌最有效的抗菌药物。但随着该药物在临床上广泛使用,对碳青霉烯类抗生素耐药的肠杆菌科细菌日益增多,尤其是肺炎克雷伯菌和大肠埃希菌[7]。产碳青霉烯水解酶是肠杆菌科细菌耐碳青霉烯类药物的重要机制之一,目前国际流行的主要有KPC、IMP、VIM和NDM[8,9]。Zhang等[10]研究显示,在我国耐碳青霉烯肺炎克雷伯菌主要以KPC为主,而耐碳青霉烯大肠埃希菌主要以NDM为主。本研究中分离到17株耐碳青霉烯肺炎克雷伯菌,携带NDM或KPC基因约占50%,高于文献报道的NDM分离率,同时在大肠埃希菌、阴沟肠杆菌和产酸克雷伯菌中,均分离到NDM。在我院产NDM菌株分离率高,暗示blaNDM-1正在成为本院肠杆菌科细菌对碳青霉烯耐药的主要原因,须引起足够重视。研究发现,17株产NDM-1菌株主要来自痰、尿和血标本。由于痰和尿标本具有开放性特点,容易造成环境污染及接触人员感染,须在院内对患者采取严格的消毒措施来防止其在医院内播散、流行。
NDM属于Ambler-B类碳青霉烯酶,是一种依赖锌离子的金属-β-内酰胺酶,这类酶可以强烈水解除氨曲南以外的β-内酰胺类抗生素。体外试验表明,NDM-1菌株对头孢菌素和碳青霉烯类抗生素呈现高水平耐药。由于酶的特异性,理论上碳青霉烯酶不能水解喹诺酮类、氨基糖苷类以及氨曲南和替加环素类抗生素[11]。本研究显示,产NDM-1菌株对喹诺酮类、氨基糖苷类、氨曲南和替加环素都有不同程度耐药,可能是由于这些菌株同时携带如CTX、SHV、TEM等其他多种耐药基因,导致其对碳青霉烯、头孢菌素、氨曲南及喹诺酮类等多种抗生素耐药,更加限制了抗生素的使用。然而,本研究显示NDM-1菌株并非对所有抗生素耐药。体外试验表明,阿米卡星和替加环素对产NDM-1肠杆菌科细菌具有良好的抗菌活性,部分菌株对环丙沙星、左旋氧氟沙星也具有良好的抗菌活性。因此,依据药敏结果合理选用抗生素,可提高临床治疗成功率。
对17例产NDM-1肠杆菌科细菌感染病例进行回顾分析,其中5例死亡,病死率为29%,该结果与黄增光等[1]一项华南地区的产blaNDM-1细菌感染病死率研究结果相似。对病例资料进一步分析发现,男性多于女性,年龄多>60岁,标本来源以痰液、血液和尿液为主。NDM感染患者的预后与入住ICU、多脏器功能衰竭和机械通气有密切关系,与张雯等[12]研究结果一致。因此,要提高临床治疗成功率,合理使用抗生素的同时,一定要加强患者全身综合治疗。
MLST是一种基于核酸序列的分子分型方法,具有较高的分辨力,是一种更为准确的分型方法。它通过对不同菌种的管家基因核心序列进行分析,进而比较其等位基因的多样性,不同的等位基因对应着不同的ST,因此可对菌株进行世界范围内比较。在中国,大多数已发现的产NDM-1菌株属于不同ST型,呈散在分布[13]。Zhang等[10]对26个省市肺炎克雷伯菌进行研究,发现8个省市存在NDM-1肺炎克雷伯菌,各地区主要流行型别共6种ST型,分别为ST23、ST35、ST273、ST45、ST17和ST11;大肠埃希菌以ST167分布地方最广。本实验研究的8株肺炎克雷伯菌MLST分型同样呈现多样性,共5种ST型,ST35所占比例最高;大肠埃希菌以ST167为主,肺炎克雷伯菌与国内其他地方流行的类型不同,而大肠埃希菌有共同之处。虽然关于NDM国内报道大多发现菌株呈分散分布,流行病学意义不大。但是,2015年报道山东省发现NDM-1型肺炎克雷伯菌的小范围暴发流行。因此,我们不能忽视对这些菌株的监测,应该加强对这些菌株临床感染特点和传播能力的研究,提供有效的数据支持,预防和控制产NDM-1菌株引起的医院感染的发生、流行和暴发。
虽然产NDM-1菌株极易播散且耐药性广泛,但仍可预防控制。医务人员需高度重视产NDM-1细菌的监测工作,筛选携带NDM-1的高危患者,如发现产NDM菌株,应采取隔离措施控制传染源,合理使用抗生素,以提高临床治疗效果,预防NDM-1暴发。
无


























