
生物膜的形成与侵袭性真菌感染有关。因此,生物膜被认为是一个重要的毒力因子。白假丝酵母菌已成为医院感染的重要菌群之一,也是临床分离率最高的真菌,主要以呼吸道感染为主。生物膜的形成,可促进白假丝酵母菌的粘附、增殖及扩散,导致最低抑菌浓度和耐药性都明显增加。本文就白假丝酵母菌生物膜的形成机制、结构特点和防治现状相关研究进展进行概述,为白假丝酵母菌生物膜形成临床防治策略的制定提供参考。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
假丝酵母菌是一种条件性致病真菌,常寄生于人体的皮肤、口腔和阴道黏膜及内脏器官等。人体的免疫力低下、植入医疗器械或正常寄生部位微生态环境被破坏等,均可导致假丝酵母菌感染[1]。假丝酵母菌感染是医院获得性感染最常见的形式之一。近年来,热带假丝酵母菌、光滑假丝酵母菌、近平滑假丝酵母菌及克柔假丝酵母菌的感染率有所上升,但白假丝酵母菌仍是假丝酵母菌属感染的主要病原体[2]。白假丝酵母菌可引起浅表感染和危及生命的系统感染,已成为临床严重危害患者生命健康的主要因素之一。尽管对于危重患者的医疗技术支持有所提升,但病死率仍高达50%左右[3]。
唑类抗真菌药物因其具有良好的生物利用度和生物安全性而成为临床上应用广泛的抗真菌药物,但由于长期不合理用药等原因,导致了白假丝酵母菌对唑类药物耐药性的产生,并且存在交叉耐药和多药耐药现象,给临床治疗带来了极大的困难。因此,研究白假丝酵母菌耐药机制具有重要的意义。目前,已明确的白假丝酵母菌耐药机制主要包括药物靶酶基因的突变或高表达、生物膜的形成及外排泵基因的高表达等。白假丝酵母菌寄居于人体时,常存在着两种状态:浮游状态和生物膜状态。当白假丝酵母菌形成生物膜时,比浮游状态具有更强对抗真菌药物的能力,并且对许多常见的抗真菌药物产生耐药,从而导致了这种感染的治疗难度增加,影响着深部真菌感染的治疗效果并会导致持续感染。因此,对于白假丝酵母菌生物膜形成的研究尤为重要。本文将对白假丝酵母菌生物膜的形成及其相关的影响因素进行综述。
白假丝酵母菌生物膜是一种由附着在细胞外基质上的细胞和菌丝形成的复杂群落。在导管和假体(非生物)及粘膜表面(生物)形成生物膜是白假丝酵母菌的重要特征,有助于真菌粘附、增殖和扩散到其他感染部位[4]。白假丝酵母菌可成长为个体的卵圆细胞(称为酵母细胞或孢子)或端到端连接的长丝状细胞(称为假菌丝或菌丝的细胞结构)。在多种条件下的体外培养试验中发现,生物膜的生长有一个酵母细胞的基底结合层,深度约为20~100 μm。菌丝可从基底层生长并延长数百微米,生物膜的酵母细胞通常是由菌丝产生的,尤其是在其顶端区域。白假丝酵母菌生物膜的主要成分是碳水化合物、蛋白质和核酸,形成分为三个发展阶段:早期阶段(0~11 h)、中间阶段(12~30 h)和成熟阶段(31~72 h)[5]。在早期阶段,单个酵母细胞附着于基板,然后通过增殖扩散产生菌落,进而形成生物膜的基底层。随着菌丝的出现和细胞外基质的产生,生物膜的发展进入了高代谢活动的中间阶段。在最后成熟阶段,细胞外基质物质大量积累。生物膜形成的最后一步可被认为是细胞的释放,通过细胞增殖扩散形成新的生物膜,这也是播散性感染的原因。在弥漫性感染模型中,释放的细胞比浮游细胞更具毒性。因此,生物膜分散产生了一类独特的酵母细胞,能产生新的生物膜并引起感染[6]。白假丝酵母菌酵母相和菌丝相间的可逆转换对致病性及生物膜的形成过程起着重要的作用,菌丝相对于维持成熟生物膜结构的完整性和多层体系是非常重要的。生物膜形成的早期即可表现出耐药性,但与成熟期形成的耐药机制并不相同[7]。越来越多的证据表明,白假丝酵母菌和细菌之间的相互作用,对于白假丝酵母菌的定植、生物膜形成和酵母相及菌丝相的转变至关重要[8]。混合物种的生物膜与白假丝酵母菌单体生物膜相比,更紧凑,但不牢固,与细胞周期相关的功能基因和菌丝的发展被压抑>2倍[9]。
白假丝酵母菌生物膜的形成过程主要包括:基底细胞粘附、生物膜初步形成、生物膜的成熟以及扩散。目前,对于白假丝酵母菌生物膜形成的主要影响因素大致可以分为以下几种:细胞外基质、群体感应、外排泵及形态转换等。图1为影响白假丝酵母菌生物膜形成各阶段的具体作用因素。
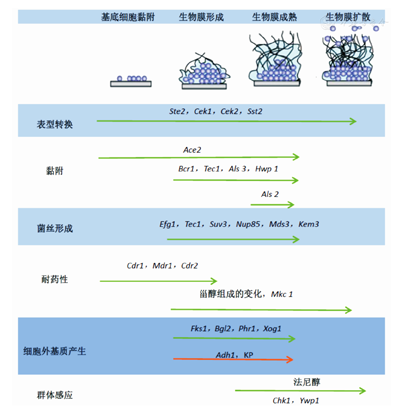

注:黑色箭头表示作用于生物膜形成的阶段;绿色箭头表示在此阶段促进生物膜的形成;橙色箭头表示在此阶段抑制生物膜的形成
生物膜与微生物群落的区别就在于其表面被细胞外基质包围。这种复杂的细胞外物质具有防御吞噬细胞、维持生物膜完整性和限制有毒物质进入生物膜等功能[10]。同时,细胞外基质也是一种有组织的细胞共同体,嵌入在一个具有聚合物质的矩阵里[11]。该矩阵的成分比较复杂,主要有蛋白质、糖蛋白、碳水化合物、脂类和核酸。多糖是细胞壁的主要成分,主要的多糖成分为α-甘露聚糖、β-1, 6葡聚糖和β-1, 3葡聚糖[12]。β-1, 3-葡聚糖已被证明能够将唑类药物、棘白菌素类药物及多烯类药物隔离在生物膜之外,导致生物膜对多种抗真菌药物耐药,并且被证明是生物膜特有的,其合成依赖于FKS1基因编码的β- 1, 3葡聚糖合成酶。研究发现,FKS1基因的过度表达或缺失,并不影响浮游生物对唑类药物、棘白菌素类药物及多烯类药物的敏感性。基因BGL2、PHR1和XOG1参与编码葡聚糖转移酶和葡聚糖外切酶,以及调控β-1, 3-葡聚糖输送到矩阵的过程。这些基因的突变,可以降低葡聚糖的含量,导致生物膜对上述抗真菌药物的敏感性增强[13]。杀手肽(Killer peptide,KP)是一种十肽,来自编码单链重组抗独特型抗体的可变序列,是一种广谱杀菌酵母杀手毒素,针对β-1, 3-葡聚糖D细胞壁受体,可对抗白念珠生物膜的形成[14]。
细菌和许多真菌均以单细胞形式存在,它们能够通过对信号因子的分泌和响应来协调它们的活动,这些信号因子在细菌生物膜动力学中也起着至关重要的作用。群体感应描述了一组广泛的现象,其中细胞密度依赖的反应就是通过分泌这种信号因子来完成的。群体感应也是生物膜细胞扩散的重要因素之一。与浮游状态相比,白假丝酵母菌形成生物膜后会产生和释放更多的群体感应分子。成熟生物膜中的细胞密度比早期生物膜高,同时也会分泌更多的群体感应分子,耐药性更强[15]。法尼醇是一种由白假丝酵母菌产生的胞外群体感应分子,一定浓度的法尼醇可以抑制酵母-菌丝转换,并且可以把生物膜保持在静止状态从而抑制其成熟。法尼醇与麦角甾醇之间可能存在某种关系,在这种关系中,法尼醇可能作为一种化学信息分子来调节基因表达,从而抑制白假丝酵母菌生物膜对氟康唑的耐药过程[16]。
目前,白假丝酵母菌细胞膜上与耐药相关的主动外排系统主要为ATP结合盒转运蛋白超家族(ATP-binding cassette transporter superfamily,ABC)[17]。ABC转运蛋白广泛存在于真核生物和原核生物,参与分子能量的跨膜转运,是最常见且最重要的外排泵。编码ABC转运蛋白基因的高表达,可使药物外排能力增加,导致细胞内药物累积浓度下降而使药物治疗失败,从而导致真菌耐药,尤其是在唑类药物耐药性中起着非常重要的作用。ABC转运蛋白还参与真菌交配因子和群体感应分子的分泌,这些分子可以通过影响生物膜的结构而导致其耐药性增加[18]。外排泵基因CDR1、CDR2及MDR1的高表达,可导致白假丝酵母菌对唑类药物的耐药性增加。在生物膜形成的过程中,基因CDR1、CDR2及MDR1的表达上调。但这三种基因的单独缺失或联合缺失,对于成熟的生物膜的耐药性而言,并无明显影响[19]。
白假丝酵母菌的基因组中含有一个交配型位点(Mating type like locus,MTL),MTLa1和MTLα2已经确定位于白假丝酵母菌的第5号染色体。MTL基因不仅可以控制白假丝酵母菌的交配,而且参与调控白灰(White-opaque)表型转换。MTLa1/α2杂合子通过控制基因WOR1(White-opaque regulator 1)来抑制白灰表型转换,这一发现解释了只有MTL纯合子可以进行白灰表型转换。白灰表型转换也可影响生物膜的形成[20],在白细胞和灰细胞中,信息素可以诱导某些与交配相关基因的表达,包括基因STE2、CEK1、CEK2和SST2等。灰细胞表现为进行有效的交配,白细胞则表现为交配调节通路的激活,导致凝聚力、黏附性的增强以及生物膜的形成。少数灰细胞可以通过分泌信息素使大多数白细胞形成生物膜[21],而生物膜也为灰细胞提供了一种促进交配的环境。白细胞通过旁分泌系统回应的信息素已经证明是白假丝酵母菌MTL纯合子的一般特征。而Ste11-Hst7-Cek1/2-Tec1介导MAPK通路主要通过控制信息素来诱导MTL纯合子菌种形成生物膜,Ras-cAMP/PKA通路则控制MTLa/α菌株的生物膜形成[22]。
影响生物膜生长的抗菌药物主要包括以氟康唑、伊曲康唑及伏立康唑等为主的唑类抗真菌药物;以卡泊芬净、米卡芬净及阿尼芬净为主的棘白菌素类药物[23];以制霉素、两性霉素B为主的多烯类药物[24]。随着抗菌药物的发展,发现了可能治疗白假丝酵母菌感染的新选择:制霉色基素、槐糖脂和桧醇。
制霉色基素是一种多烯类抗生素,与经典的多烯类抗真菌药物两性霉素B相比,不仅对生物膜的形成有相似的影响,而且在抑制白假丝酵母菌生物膜的形成的过程中存在一种剂量依赖性关系[25]。它可诱导白假丝酵母菌细胞凋亡,最低抑菌浓度为10 μg/mL。当制霉色基素的浓度为40 μg/mL时,>80%的生物膜的形成受到抑制。当制霉色基素的浓度为20 μg /mL时,基因ALS1、ALS3、HWP1、EFG1、HYR1、CPH1和BCR1的表达受到了显著影响。制霉色基素可显著抑制生物膜的形成,在降低设备感染率中扮演了很重要的角色[26]。
槐糖脂是一种糖脂生物表面的活性剂,已被证实其具有抗菌的作用和抗癌特性[27]。Haque等[28]已经证实槐糖脂可抑制白假丝酵母菌生物膜的形成,以及降低其预膜的活力并且使菌丝形成的相关基因HWP1、ALS3、ECE1和ECE4等表达下调。此外,槐糖脂还与两性霉素B、氟康唑在抑制生物膜形成的过程中具有协同作用。
Komaki等[29]证明随着桧醇剂量的增加,白假丝酵母菌的生长呈剂量依赖性抑制。白假丝酵母菌的生长受腺苷酸环化酶(Cyr1)的调控,Cyr1由Ras1蛋白激活。桧醇可通过抑制Ras1介导的信号转导通路,从而抑制白假丝酵母菌生长。Kim等[30]采用生物膜代谢活性的定量研究来评价桧醇对生物膜的抑制效应,对于氟康唑敏感及氟康唑耐药的菌株,桧醇均可有效地防止生物膜的形成。采用RT-PCR实时检测在白假丝酵母菌细胞膜的发育过程中特定基因的表达水平。桧醇治疗生物膜形成的早期阶段,是通过抑制与黏附过程相关基因HWP1(编码菌丝细胞壁蛋白)和ALS3(编码凝集素样序列)的表达;桧醇也可抑制基因UME6和HGC1(与菌丝的形成和维护相关)的表达;基因HWP1和ALS3是cAMP-PKA通路下游组件,可被基因EFG1调控,在桧醇治疗生物膜的过程中,基因EFG1的表达并不受影响,但基因EFG1的上游组件基因CYR1和RAS1的表达有所下调。结果表明,桧醇可能通过减少黏附素和中断cAMP-PKA途径从而干扰菌丝形成以及限制菌丝的长期生长等作用来影响生物膜的形成。
综上所述,生物膜的形成可导致白假丝酵母菌耐药性的增加。它的形成包括基底细胞粘附、生物膜的形成、生物膜的成熟以及扩散。影响生物膜的因素有细胞外基质的形成、群体感应分子、外排泵以及表型转换的作用等。抗菌药物的发展,对白念珠的生物膜的形成起到了一定的抑制作用,而制霉色基素、槐糖脂和桧醇也可能成为抑制白假丝酵母菌生物膜形成的新选择,为白假丝酵母菌生物膜感染的治疗提供一种改进的、安全的临床方法。生物膜相关的耐药机制仍然存在很多问题有待解决,群体感应分子是如何影响成熟生物膜的耐药性,外排泵是通过何种分子而改变生物膜的形成能力至今尚不清楚,有待进一步研究。
无



























