
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
流行性感冒(以下称流感)可分为甲、乙、丙、丁四型,其中甲型和乙型较为常见,丙型和丁型不多见。甲型流感病毒根据H和N抗原可分为许多亚型,H可分为H1~H17,N可分为N1~N10,其中H1N1、H2N2和H3N2主要感染人类,其他许多亚型的自然宿主是多种禽类和其他动物(如具有高致病性的H5N1、H7N9等禽流感病毒),但先后有感染人类的事件发生。1889年以来,由甲型流感病毒及其抗原变异导致了几次世界范围的流感大流行,造成了严重的后果,对全球性公共卫生事业带来极大挑战。2013年以来,人感染H7N9禽流感已经在我国历经了5个流行季,病死率达到39.5%。由于给家禽大规模注射疫苗,2017年底至2018年,人感染H7N9禽流感的数量明显下降。乙型流感病毒主要有两种亚型:Victoria型和Yamagata型。从2017年底到2018年初诊断的流感病例中,乙型占了很大比例,其中Yamagata型明显增多,与目前的三价流感疫苗未覆盖Yamagata型有关。
流感的治疗中,神经氨酸酶抑制剂(NAI)是最基本的抗病毒治疗药物。目前,在我国上市的有奥司他韦(Oseltamivir,磷酸奥司他韦胶囊,达菲)和帕拉米韦(Peramivir),其中奥司他韦应用最为广泛。帕拉米韦是2013年国家食品药品监督管理总局新批准的抗病毒药物,可应用于流感重症患者、无法接受吸入或口服药品、对奥司他韦产生耐药的患者。最近在日本等国家被批准静脉注射的那尼纳米韦(Laninamivir)是一种长效选择性NAI,一次吸入后药物有效浓度可维持在5 d以上,可单次给药治疗流感病毒感染,对于甲型和乙型流感病毒感染均有效,可用于治疗季节性流感、甲型H1N1流感和H5N1禽流感,对耐奥司他韦的流感病毒感染也有效,目前在我国还未上市[1]。众多研究表明,以奥司他韦为首的NAI对甲型流感均有良好的疗效,耐药性低,不良反应少,患者耐受性良好。国家卫生计生委发布的《流行性感冒诊疗方案》(2018年版)指出:在发病48 h内应尽早开始抗流感病毒治疗。虽然有资料表明发病48 h后使用NAI亦有效,但大多数研究证明早期治疗疗效更为肯定;疗程通常是5 d。对于重症甲型流感,抗病毒药物是否有效,各种抗病毒药物是否有差别,是否需要加倍剂量或者联合治疗,以及是否需要延长治疗疗程,目前的证据较少。因为在重症患者中无法开展随机对照研究,绝大部分研究为观察性、回顾性的队列研究,并且因为发病例数的关系,大部分的试验局限在猪流感病毒H1N1,病死率更高的H5N1及H7N9禽流感中,抗病毒治疗的研究更为有限。在临床实际应用中,流感的抗病毒治疗仍需积累更多的证据。
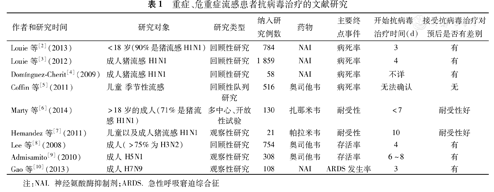
Louie等[2]回顾性分析了从2009年4月至2012年9月收治的784例<18岁入住ICU的危重症流感患者,其中90%为猪流感H1N1患者,开始抗病毒治疗的中位时间为3 d,NAI治疗组653例,病死率6%,未治疗组131例,病死率8%。多因素模型分析发现,治疗组的死亡风险下降,比值比0.36,起病48 h内开始治疗与存活显著相关(P=0.04)。该研究认为危重症流感患儿接受恰当的NAI治疗可提高存活率。对成年的危重症甲型流感患者进行分析研究[3],纳入1 859例入住ICU的猪流感H1N1患者,其中1 676例(90%)患者接受NAI治疗,183例(10%)患者未接受治疗,患者的中位年龄为37岁,79%的患者有超过1种的合并症,26%的患者死亡。从起病到开始NAI抗病毒治疗的中位时间为4 d(0~52 d)。使用NAI治疗与存活有关:183例未治疗的患者,存活107例,存活率58%,1 676例治疗的患者存活1 260例,存活率为75%,治疗越早越能提高存活率(P<0.01)。起病5 d内开始抗病毒治疗可显著提高存活率(P<0.05)。该研究认为,NAI可以改善危重症猪流感H1N1患者的预后,起病5 d内开始抗病毒治疗可使患者获益。Domínguez-Cherit等[4]纳入墨西哥899例猪流感H1N1患者,58例为极危重,其中24例死亡。与死亡病例比较,存活患者接受NAI治疗的比例更高(OR=8.5,95%CI 1.2~62.8,P=0.04),提示抗病毒治疗改善预后。
Coffin等[5]在儿童中开展的一项回顾性队列研究中,264例危重症流感患者起病初接受奥司他韦治疗,252例入院后24 h内接受奥司他韦治疗,前者与后者相比,总的住院时间缩短18%,但是重症监护室停留时间、院内病死率及再次住院率并无明显差别。该试验的缺陷是无法明确从起病到抗病毒治疗的间隔时间。一项针对扎那米韦的多中心、开放的临床Ⅱ期试验[6],纳入130例>18岁的重症流感患者,71%是猪流感H1N1患者,接受扎那米韦(600 mg,2次/d)治疗,症状出现7 d内给药,发现病死率与历史对照相仿。Hermandez等[7]纳入31例患者,其中20例成人,11例儿童,均有快速进展的病毒性肺炎和呼吸衰竭,30例患者接受了机械辅助通气,静脉注射帕拉米韦治疗1~14 d(中位时间10 d),患者对帕拉米韦耐受性好,14、28和56 d的存活率分别为76.7%、66.7%和59%。未设未抗病毒治疗的对照。Lee等[8]的研究涉及754例季节性流感,表明奥司他韦治疗与疾病预后直接相关,多因素分析显示死亡的校正风险比为0.27(95%CI 0.13~0.55,P<0.01) 。
Admisamito等[9]对东南亚发生的308例H5N1患者进行研究,发现接受超过一个剂量的奥司他韦治疗的患者其存活率要大于未曾接受治疗的患者。即使患者在起病6~8 d后用药也能获益。Gao等[10]研究了111例H7N9患者,其中76.6%的患者入住ICU,108例患者接受了NAI的治疗。单因素分析表明,起病3 d内接受抗病毒治疗ARDS的发生率要比3 d后的发生概率低。重症流感患者使用NAI治疗耐受性好,病死率降低。
重症、危重症流感患者抗病毒治疗的文献研究
重症、危重症流感患者抗病毒治疗的文献研究
| 作者和研究时间 | 研究对象 | 研究类型 | 纳入研究例数 | 药物 | 主要终点事件 | 开始抗病毒 治疗时间(d) | 接受抗病毒治疗对预后是否有差别 |
|---|---|---|---|---|---|---|---|
| Louie等[2](2013) | <18岁(90%是猪流感H1N1) | 回顾性研究 | 784 | NAI | 病死率 | 3 | 有 |
| Louie等[3](2012) | 成人猪流感H1N1 | 回顾性研究 | 1 859 | NAI | 病死率 | 4 | 有 |
| Domínguez-Cherit[4](2009) | 成人猪流感H1N1 | 回顾性研究 | 58 | NAI | 病死率 | 不详 | 有 |
| Coffin等[5](2011) | 儿童季节性流感 | 回顾性队列研究 | 516 | 奥司他韦 | 病死率 | 无法确认 | 无 |
| Marty等[6](2014) | >18岁的成人(71%是猪流感H1N1) | 多中心、开放性试验 | 130 | 扎那米韦 | 耐受性 | <7 | 耐受性好 |
| Hemandez等[7](2011) | 儿童以及成人猪流感H1N1 | 观察性研究 | 21 | 帕拉米韦 | 耐受性 | 10 | 耐受性好 |
| Lee等[8](2008) | 成人(>75%为H3N2) | 回顾性研究 | 754 | 奥司他韦 | 存活率 | 4 | 有 |
| Admisamito[9](2010) | 成人H5N1 | 观察性研究 | 308 | 奥司他韦 | 存活率 | 6~8 | 有 |
| Gao等[10](2013) | 成人H7N9 | 观察性研究 | 108 | NAI | ARDS发生率 | 3 | 有 |
注:NAI.神经氨酸酶抑制剂;ARDS.急性呼吸窘迫综合征
NAI最佳的应用时间是起病后48 h内,这是基于健康门诊患者病毒排毒时间和抗病毒药物抑制流感病毒快速复制的最大效能来制定的[11]。各项临床试验也证实重症流感起病48 h内开始抗病毒治疗患者获益最大。Muthuri等[12]纳入了2009年1月至2011年3月公开发表的78项研究中的29 234例患者。比较未治疗与NAI治疗在减少病死风险方面的相关性(OR=0.81,95%CI 0.70~0.93;P=0.0024)。与延迟治疗比较,早期治疗(起病2 d内开始治疗)可减少病死风险(OR=0.48,95%CI 0.41~0.56;P<0.0001)。早期治疗与不治疗相比可显著降低病死率(OR=0.50,95%CI 0.37~0.67;P<0.0001),但是在儿童中并不显著。与早期治疗比较,每延迟1 d开始治疗,直至起病第5天,均增加病死风险率(调整后的风险比HR 1.23,95%CI 1.18~1.28;P<0.0001)。研究认为,在流感住院患者中早期应用NAI治疗可以降低病死率。西班牙[13]的一项针对重症甲型流感的研究中,重症甲型流感开始治疗的中位时间为10 d,起病48 h内开始治疗与48 h后开始治疗,其ICU停留时间、住院时间以及机械通气时间均有差别,对于ICU病死率亦有影响,分别为21.5%和34.3%(OR=1.9,95%CI 1.06~3.41)。多因素分析提示,48 h内开始治疗是降低ICU病死率的独立变量。2009年,Jain等[14]纳入272例猪流感H1N1患者,开始抗病毒治疗的中位时间为3 d(0~29 d),重症患者67例,开始抗病毒治疗的中位时间为6 d(0~24 d),其中19例患者死亡,死亡患者开始抗病毒治疗的时间为起病后8 d(3~20 d),23%的患者48 h内开始抗病毒治疗,均未死亡。危重症患者如能在48 h内开始抗病毒治疗,可获得最大益处。但是重症患者抗病毒治疗普遍延迟[10,15,16,17],48 h以后抗病毒治疗,是否仍能获益?延迟治疗与甲型流感的预后是否有关?2007年,McGeer等[18]在加拿大开展的一项前瞻队列研究评估抗病毒治疗对于流感住院患者病死率的影响。主要终点事件是起病15 d内的病死率。患者中位年龄为77岁,绝大部分患者具有基础疾病,如心脏或肺部疾病。研究的100例患者中,22例患者起病后49~72 h开始抗病毒治疗,21例在起病后73~96 h开始抗病毒治疗。结果显示在>65岁人群中,48 h后开始抗病毒治疗与未治疗比较,在病死率方面差异并无统计学意义。一些小样本的回顾性研究认为重症患者在起病3 d[2]、4 d[3,8]及之后开始抗病毒治疗仍能改善预后[9]。重症流感患者抗病毒治疗的最佳时间仍为起病后48 h内,起病48 h后治疗仍可能获益,在>65岁人群中可能并无差别。
重症流感患者中是否应该延长疗程到5 d以后,目前尚无该方面的研究。重症患者中病毒排毒时间的研究,对于是否需要延长疗程具有一定的指导价值。2009年中国最初的426例猪流感H1N1患者的研究发现[19],患者从起病到病毒rtPCR阴性的中位时间为6 d,这些患者绝大部分为轻症患者。对重症患者的研究发现,76%的患者起病7 d时甲型流感病毒仍为阳性,提示重症患者病毒排毒时间延长。Lee等[20]纳入131例住院的流感患者,均有基础疾病,如充血性心力衰竭、癌症、慢性肝病或肾病及需要使用免疫抑制剂的患者等。研究比较了接受奥司他韦抗病毒治疗和未抗病毒治疗的患者血清中的病毒浓度。研究发现,84.4%未治疗的患者在起病第5天病毒仍阳性,57%的患者第7天病毒阳性,而治疗组中第7天仅25.7%的患者病毒阳性(P=0.007);而健康志愿者中的排毒时间平均仅为2.5 d[9]。目前并无直接证据支持重症流感患者需要延长抗病毒疗程,仅提示重症流感患者病毒排毒时间延长,可能需要更长的治疗时间。
2000年,一项随机、安慰剂对照研究纳入726例流感门诊患者[21],比较奥司他韦75 mg(2次/d)和150 mg(2次/d)的治疗效果,均在起病36 h内给药。研究发现,与安慰剂(116.1 h)比较,两种剂量(97.6和89.4 h)均可显著减少症状持续时间。但两种剂量之间差别不大,因此FDA只批准了使用75 mg(2次/d)来治疗流感。一项来自东南亚的研究表明[22],入院治疗的重症流感患者使用双倍剂量的抗病毒药物奥司他韦,并未显示更好的病毒学及临床收益。这项研究首次对更大剂量奥司他韦治疗重症流感住院病例的有效性进行了分析,研究中的重症流感患者包括季节性、流行性以及禽流感重症患者。该研究自2007年4月开始,截止2010年2月,共有326例重症流感患者参与(75.5%是<15岁的儿童)。患者随机被分为两组,一组接受标准剂量(75mg,2次/d,儿童剂量根据公斤体重数调整),另外一组接受双倍剂量的奥司他韦(150 mg,2次/d,儿童剂量根据公斤体重数调整)。两组均进行为期5 d的治疗。研究人员采集鼻咽拭子检测其病毒水平。其他评估结果还包括死亡、移送重症监护、辅助呼吸(机械通气)。不同剂量的两个治疗组之间在病毒水平、病死率和不良事件发生率上并无不同。因此,使用双倍剂量的奥司他韦治疗重症流感住院患者,与标准剂量相比,并无病毒学或临床优势。
随着抗病毒药物的广泛应用,耐药率逐渐升高,抗病毒药物的联合应用疗效是否优于单药治疗成为目前研究热点。关于联合治疗疗效目前报道较多,但大部分为体外研究、动物研究及回顾性观察研究,目前尚缺乏大型临床随机对照研究,尤其是针对危重症流感患者。一项以非复杂性且大部分为H3N2病毒感染的成年患者为研究对象的随机、双盲、安慰剂对照试验发现,联合奥司他韦和吸入性扎那米韦治疗与单药奥司他韦相比,其病毒学应答和临床应答较慢[23],但联合治疗可能在降低二级传播上更有效[24]。一项针对人感染H7N9禽流感的回顾性研究,纳入了82例患者,比较了奥司他韦联合帕拉米韦(n=39)和奥司他韦(n=43)单药对于病毒排毒时间、急性呼吸窘迫综合征发生率及病死率,发现差异并无统计学意义[25]。
目前,三药联合治疗主要指金刚烷胺、利巴韦林和奥司他韦联合治疗。一项关于感染流感病毒的高度免疫抑制患者的队列研究发现,三药联合患者中无耐药基因转变,且连续使用10 d以上耐受性良好,并且个体化用药仍可提供有效的靶向浓度[26]。2011年对韩国28家医院收治的猪流感H1N1危重症患者进行回顾性分析[27],纳入127例患者,其中24例接受奥司他韦、金刚烷胺及利巴韦林三药联合治疗,103例患者接受奥司他韦单药治疗,两组患者的疾病严重程度及从起病到开始抗病毒治疗的间隔时间并无差异。对第14天的病死率进行分析发现,联合用药组为17%,单药治疗组为35%,差异并无统计学意义。Logistic回归分析表明,三药联合治疗与90 d病死率之间的比值比为0.58,表明三药联合的效果与奥司他韦单药的效果相仿。
在联合治疗方面,目前较为成功的是克拉霉素、萘普生和奥司他韦的联合。针对H3N2的一项前瞻、开放、随机对照研究,比较了克拉霉素、萘普生和奥司他韦联合与奥司他韦单药治疗效果,发现联合治疗组可降低患者的30 d病死率并缩短住院时间。并且多因素分析显示联合治疗是降低30 d病死率的唯一的独立因素[28]。提示不同作用机制之间的联合抗病毒治疗,能真正增加疗效。
流感患者抗病毒治疗是关键,但是针对重症流感的研究较少,且均为观察性。虽然多因素回归分析和倾向性分析可减少选择性偏倚,但是肯定有未知或未测量的指标影响了这些研究中的治疗结果。因此尚需开展更多的随机对照研究来进一步证实。
无


























