
比较海正美特和美平对革兰阴性菌的体外抗菌活性。
选取来自国内多个省市的非重复临床菌株418株,包括大肠埃希菌104株,肺炎克雷伯菌104株,变形杆菌56株,其他肠杆菌52株,鲍曼不动杆菌和铜绿假单胞菌均为51株。其中大肠埃希菌、肺炎克雷伯菌和变形杆菌根据是否产超广谱β-内酰胺酶(ESBLs)分为产ESBLs菌株和非产ESBLs菌株,各组分别为52、52和28株。两种注射用美罗培南分别为日本住友制药有限公司生产的美平和中国浙江海正辉瑞制药公司生产的海正美特,根据美国临床和实验室标准化协会(CLSI)(2016版)标准,采用微量肉汤稀释法和琼脂稀释法测定两种美罗培南对不同菌种的最低抑菌浓度(MIC)。
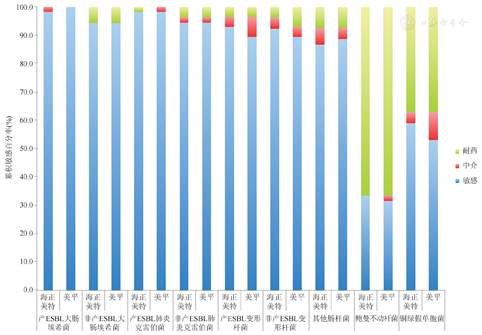
两种美罗培南对大肠埃希菌、肺炎克雷伯菌、变形杆菌等肠杆菌科细菌的敏感率基本在85%以上,对ESBLs稳定;对鲍曼不动杆菌和铜绿假单胞菌的敏感率较低,分别为33.3%、31.4%和58.8%、52.9%。
海正美特与美平对肠杆菌科细菌均具有良好的体外抗菌活性,对鲍曼不动杆菌和铜绿假单胞菌的敏感率均较低。两种美罗培南对ESBLs稳定,对主要革兰阴性菌的体外抗菌活性无差异。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
碳青霉烯类抗生素与其他β-内酰胺类抗生素如青霉素、头孢菌素、β-内酰胺抗生素/β-内酰胺酶抑制剂复合制剂相比,具有抗菌谱更广、抗菌活性更强的特点[1]。其对超广谱β-内酰胺酶(ESBLs)、头孢菌素酶(AmpC酶)等高度稳定,同时对肠杆菌科细菌及非发酵菌等革兰阴性菌均具有较好的抗菌活性,已成为当前多重耐药革兰阴性菌感染,特别是重症感染的首选治疗药物[2,3,4]。美罗培南是临床上最常用的碳青霉烯类抗生素之一,被批准用于治疗复杂性腹腔内感染、复杂性皮肤软组织感染、复杂性尿路感染、社区及医院获得性肺炎及败血症等多种严重感染,且是唯一被批准用于治疗细菌性脑膜炎的碳青霉烯类抗生素[5]。目前常用的注射用美罗培南制剂主要有日本住友制药公司生产的美平与中国浙江海正辉瑞制药公司生产的海正美特两种。本研究旨在比较两种不同美罗培南制剂对不同菌种的体外抗菌活性,为临床药物选择提供依据。
随机选取本课题组保存的非重复的临床菌株418株,包括大肠埃希菌104株,其中产ESBLs与非产ESBLs大肠埃希菌各52株;肺炎克雷伯菌104株,其中产ESBLs与非产ESBLs肺炎克雷伯菌各52株;变形杆菌56株,其中产ESBLs与非产ESBLs变形杆菌各28株;其他肠杆菌52株,包括阴沟肠杆菌、产气肠杆菌、黏质沙雷菌、弗氏柠檬酸杆菌等;鲍曼不动杆菌51株;铜绿假单胞菌51株。质控菌株为大肠埃希菌ATCC25922。
Vitek 2 Comapt细菌全自动鉴定仪及浊度仪,MH培养基、麦康凯培养基为法国生物梅里埃公司(BioMérieux, France)产品;PCR扩增仪由美国PE公司生产;紫外成像仪购自德国Biometra公司。PCR扩增试剂及DNA分子量标准(DNA marker)均购自大连Takara公司;美平为住友制药有限公司产品,海正美特为海正辉瑞公司产品。
从-80℃冰箱20%甘油肉汤菌种保存管中挑取少量菌液于MH平板进行四区划线,置于37℃培养箱中孵育18 h。
所有细菌采用Vitek 2细菌全自动鉴定仪进行鉴定,如无法获得单一准确鉴定结果,则进一步采用16S rRNA(引物序列:P1:AGAGTTTGATCMTGGCTCAG;P2:TAAGGAGGT GATCCARCCGCA)基因测序方法进行鉴定。
采用CLSI指南(2016版)[6]推荐的琼脂稀释法检测两种美罗培南的最低抑菌浓度(MIC),其中变形杆菌采用微量肉汤稀释法进行检测。每批次同时对质控菌株大肠埃希菌ATCC25922进行检测。
参照CLSI指南(2016版)[6]推荐的美罗培南药敏折点进行结果判读(肠杆菌科细菌:≤1 μg/mL为敏感,2 μg/mL为中介,≥4 μg/mL为耐药;鲍曼不动杆菌和铜绿假单胞菌:≤2 μg/mL为敏感,4 μg/mL为中介,≥8 μg/mL为耐药。
两种药物对菌株的体外抗菌活性比较。产ESBLs大肠埃希菌对海正美特与美平的敏感率分别为98.1%和100.0%,其MIC50均为≤0.0625 μg/mL,MIC90分别为≤0.0625 μg/mL和0.1250 μg/mL;非产ESBLs大肠埃希菌对海正美特与美平的敏感率均为94.2%,其MIC50和MIC90均为≤0.0625 μg/mL。产ESBLs肺炎克雷伯菌对海正美特与美平的敏感率均为98.1%,其MIC50均为≤0.0625 μg/mL,MIC90分别为0.125 μg/mL和0.250 μg/mL;非产ESBLs肺炎克雷伯菌对海正美特与美平的敏感率均为94.2%,其MIC50均为≤0.0625μg/mL,MIC90分别为≤0.0625 μg/mL和0.1250 μg/mL。产ESBLs变形杆菌对海正美特与美平的敏感率分别为92.8%和89.3%,其MIC50均为0.25 μg/mL,MIC90分别为1 μg/mL和2 μg/mL;非产ESBLs变形杆菌对海正美特与美平的敏感率分别为85.7%和89.3%,其MIC50分别为1 μg/mL和0.5 μg/mL,MIC90均为2 μg/mL。其他肠杆菌对海正美特与美平的敏感率分别为86.5%和88.5%,其MIC50均为≤0.0625 μg/mL,MIC90均为2 μg/mL。鲍曼不动杆菌对海正美特与美平的敏感率分别为33.3%和31.4%,其MIC50分别为32 μg/mL和64 μg/mL,MIC90均为128 μg/mL;铜绿假单胞菌对海正美特与美平的敏感率分别为58.8%和52.9%,其MIC50分别为1 μg/mL和2 μg/mL,MIC90分别为32 μg/mL和64 μg/mL(表1和图1)。
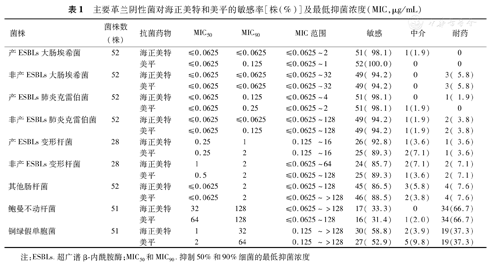
主要革兰阴性菌对海正美特和美平的敏感率[株(%)]及最低抑菌浓度(MIC,μg/mL)
主要革兰阴性菌对海正美特和美平的敏感率[株(%)]及最低抑菌浓度(MIC,μg/mL)
| 菌株 | 菌株数(株) | 抗菌药物 | MIC50 | MIC90 | MIC范围 | 敏感 | 中介 | 耐药 |
|---|---|---|---|---|---|---|---|---|
| 产ESBLs大肠埃希菌 | 52 | 海正美特 | ≤0.0625 | ≤0.0625 | ≤0.0625~2 | 51( 98.1) | 1(1.9) | 0 |
| 美平 | ≤0.0625 | 0.125 | ≤0.0625~1 | 52(100.0) | 0 | 0 | ||
| 非产ESBLs大肠埃希菌 | 52 | 海正美特 | ≤0.0625 | ≤0.0625 | ≤0.0625~32 | 49( 94.2) | 0 | 3( 5.8) |
| 美平 | ≤0.0625 | ≤0.0625 | ≤0.0625~32 | 49( 94.2) | 0 | 3( 5.8) | ||
| 产ESBLs肺炎克雷伯菌 | 52 | 海正美特 | ≤0.0625 | 0.125 | ≤0.0625~4 | 51( 98.1) | 0 | 1( 1.9) |
| 美平 | ≤0.0625 | 0.25 | ≤0.0625~2 | 51( 98.1) | 1(1.9) | 0 | ||
| 非产ESBLs肺炎克雷伯菌 | 52 | 海正美特 | ≤0.0625 | ≤0.0625 | ≤0.0625~128 | 49( 94.2) | 1(1.9) | 2( 3.8) |
| 美平 | ≤0.0625 | 0.125 | ≤0.0625~128 | 49( 94.2) | 1(1.9) | 2( 3.8) | ||
| 产ESBLs变形杆菌 | 28 | 海正美特 | 0.25 | 1 | 0.125 ~16 | 26( 92.8) | 1(3.6) | 1( 3.6) |
| 美平 | 0.25 | 2 | 0.125 ~16 | 25( 89.3) | 2(7.1) | 1( 3.6) | ||
| 非产ESBLs变形杆菌 | 28 | 海正美特 | 1 | 2 | ≤0.0625~64 | 24( 85.7) | 2(7.1) | 2( 7.1) |
| 美平 | 0.5 | 2 | ≤0.0625~128 | 25( 89.3) | 1(3.6) | 2( 7.1) | ||
| 其他肠杆菌 | 52 | 海正美特 | ≤0.0625 | 2 | ≤0.0625~128 | 45( 86.5) | 3(5.8) | 4( 7.6) |
| 美平 | ≤0.0625 | 2 | ≤0.0625~>128 | 46( 88.5) | 2(3.8) | 4( 7.6) | ||
| 鲍曼不动杆菌 | 51 | 海正美特 | 32 | 128 | ≤0.0625~>128 | 17( 33.3) | 0 | 34(66.7) |
| 美平 | 64 | 128 | ≤0.0625~128 | 16( 31.4) | 1(2.0) | 34(66.7) | ||
| 铜绿假单胞菌 | 51 | 海正美特 | 1 | 32 | 0.125 ~>128 | 30( 58.8) | 2(3.9) | 19(37.3) |
| 美平 | 2 | 64 | 0.125 ~>128 | 27( 52.9) | 5(9.8) | 19(37.3) |
注:ESBLs.超广谱β-内酰胺酶;MIC50和MIC90.抑制50%和90%细菌的最低抑菌浓度

肠杆菌科细菌是临床上最常见的革兰阴性菌,包括大肠埃希菌、肺炎克雷伯菌和变形杆菌等,是导致人类感染的重要病原体[7],容易引起泌尿道、呼吸道、腹腔及血流等局部或全身侵袭性感染。同时,鲍曼不动杆菌和铜绿假单胞菌是重要的条件致病菌,在宿主免疫力低下或缺陷时感染宿主,导致炎症发生,甚至败血症,成为医院感染的主要病原菌[8,9]。根据中国CHINET细菌耐药监测网数据显示,大肠埃希菌、肺炎克雷伯菌和变形杆菌等肠杆菌科细菌,鲍曼不动杆菌及铜绿假单胞菌一直高居临床分离菌株的前几位[10]。近年来,由于广谱抗生素的大量和不合理使用,这几类细菌的耐药性呈逐年上升趋势,给全球公共卫生带来严峻的挑战。
美罗培南是碳青霉烯类抗生素的代表药物之一,对革兰阴性菌具有很强的体外抗菌活性。本研究结果显示,产与非产ESBLs大肠埃希菌及肺炎克雷伯菌对两种美罗培南制剂的敏感率均在94%以上,MIC50均≤0.0625 μg/mL,MIC90也保持在0.25 μg/mL以下,表明两种美罗培南制剂对大肠埃希菌和肺炎克雷伯菌仍保持很强的抗菌活性。而变形杆菌及其他肠杆菌对美罗培南的敏感性稍差,MIC90达到2 μg/mL(除了海正美特对产ESBLs变形杆菌的MIC90为1μg/mL),说明已有约10%的这些菌种已对美罗培南不敏感,在临床治疗过程中应引起关注。
相对于肠杆菌科细菌,非发酵菌对美罗培南的敏感性则低得多。本研究结果显示,鲍曼不动杆菌对美罗培南的耐药率达到了66.7%,而对海正美特的敏感率稍高于美平,分别为33.3%和31.4%。铜绿假单胞菌对美罗培南的敏感率较鲍曼不动杆菌高,但耐药率也达到了37.3%。根据2016年中国CHINET细菌耐药性监测网,鲍曼不动杆菌和铜绿假单胞菌对碳青霉烯类抗生素的耐药率已接近30%和70%[10]。碳青霉烯类抗生素是耐药革兰阴性菌感染的首选经验治疗药物之一,而对碳青霉烯类耐药菌株的检出率却呈逐年增高趋势,所以一旦发生此类细菌感染,临床可供选择的药物极其有限。
两种美罗培南制剂体外药敏结果显示,两者的MIC50、MIC90及MIC分布都非常接近,大部分只差一个梯度,有些菌种甚至完全一致;同一菌种对两者的敏感率也大致相同,例如产ESBLs变形杆菌、鲍曼不动杆菌和铜绿假单胞菌等。
综上所述,两种美罗培南制剂(海正美特与美平)体外抗菌活性并无明显差异,二者对肠杆菌科细菌,包括产ESBLs与非产ESBLs菌种,均具有良好的体外抗菌活性,是治疗此类细菌感染的首选药物;但对鲍曼不动杆菌和铜绿假单胞菌等非发酵菌的体外抗菌活性较差,用于治疗非发酵菌感染时,应根据体外药敏试验等合理选择用药方案,以提高临床疗效。
无



























