
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
据世界卫生组织(WHO)估计,2016年全世界约有1 040万新发结核病患者,约有170万死于结核病,病死率为16.3%[1]。结核病的诊治至今仍是一个难题,但随着基因组学和蛋白组学,以及高通量技术的发展,医学生物研究进入了一个以分子生物学为主导的时代,而这些技术有助于疾病的诊治。研究中,高质量生物标本的保存及完整病例资料数据库的建立尤其重要,是研究的基础和重要保障,为结核病的诊治及研究提供了平台。本研究针对结核病标本库和信息库进行了建立及分析,现报道如下。
自2015年7月到2018年7月,结核病标本库共收集267例患者的标本。采集的标本均来自杭州市红十字会医院结核外科收治的手术患者,在不损害标本提供者利益和隐私的前提下收集标本。取标本前均需征得患者及其家属的知情同意,并签属知情同意书,该研究经过医学伦理委员会审批通过(【2015】临审第(03)号)。
超低温冰箱(MDF-U5386S,济南来宝)、液氮储存罐(YDS-2-30,山东博科)、低温离心机(ST40R赛默飞世尔)、细胞培养液(RPMI-1640,天津灏洋)、样本密度分离液(LTS1077,天津灏洋)、照相机(Camon EOS M3,北京)、电脑(DELL 7010MT,北京)、打印机(HP LaserJet P1106,上海)等。
在患者入院诊断后的第一次手术时采集组织标本。标本均来自患者手术中需要切除的离体组织,包括结核病变中央组织(干酪样坏死组织)、病变周边组织(周围肉芽组织)、正常组织。尽量留取有病理代表性的组织,大小约0.5 cm×0.5 cm,每种组织标本各取5份,以备随机抽样检测,减少标本反复冻融次数,进而降低标本遗传信息降解的风险。在确保进行病理诊断的前提下尽量多取,并在30 min内完成采集,以防遗传物质(DNA/RNA和蛋白质)的降解[2]。如采集标本时相应部位的标本缺少或无法采集则可考虑放弃,并在相应抗冻管和登记本中注明缺失及原因。将组织放入无菌冻存管中,用黑色永久性记号笔标注编号T1到T5。需提取RNA的标本,用DEPC水溶液冲洗,并装入含有0.1%DEPE水处理过的无菌冻存管中。上述操作需在手术室内严格无菌条件下进行,并放入标本盒编号T的相应位置。标本收集完后,一并快速置入转移式液氮罐,在30 min内放入-80℃超低温冰箱长期保存[3],并记入结核病组织标本信息库。注明采取日期、时间、患者信息、标本信息及存放方式和具体位置。
液体标本包括血液、脓液、浆膜腔积液和灌洗液。为防止标本被污染,需在相对无菌的病房或手术室采集标本。采集前患者不能进行输液和输血治疗,大量输液(>1 000 mL)的患者禁止在12 h内采集。采集需在患者手术开始之前进行,病情有变化的患者经对症治疗后在登记表中注明。(1)血液的收集:外周静脉穿刺采血,禁止在输液的同侧肢体上及输液装置的近心端进行采血,禁止在输液管内采血。每例患者术前采集非抗凝血4 mL、抗凝血4 mL共2管。抗凝管用柠檬酸钠抗凝管,而不用肝素抗凝管,以免影响PCR反应。抗凝管采血后轻轻颠倒混匀3次静置,防止溶血。(2)脓液、灌洗液及浆膜腔积液的采集:用5 mL一次性无菌注射器穿刺采集,采集部位为含有脓液、灌洗液及浆膜腔积液的腔隙,禁止在腔隙开放状态下采集。采集2管,每管液体量>4 mL,如抽出液体未能达到实际采集量或黏稠无法采集时,可考虑用等渗氯化钠溶液灌洗后采集。如标本为实质性标本则在标本登记本中注明无法采集。责任医师负责将采集的液体标本交至实验室,若不能及时送出需将其储存于4℃冰箱,且时间不能超过2 h[4]。
将采集的液体标本带入实验室进行分离。(1)血液的分离:将采集的非抗凝血在800×g下约离心10 min(半径15 cm水平转子),用微量加样器小心吸取血清(Serum,S),按每管200 μL分装成5份,放入无菌冻存管中,用黑色永久性记号笔标注编号S1~S5,并放入标本盒编号S的相应位置,作蛋白组学分析。将抗凝管采集的血液用以400×g离心20 min(半径15 cm水平转子),用微量加样器小心吸取血浆(Plasma,P),按每管200 μL分装成5份,放入无菌冻存管中,用黑色永久性记号笔标注编号P1~P5,放入标本盒编号P的相应位置。取1份4 mL抗凝血加入离心管中,再加入等体积的RPMI-1640细胞培养液,小心加入样本密度分离液4 mL于液面之上,并以400×g离心15 min(半径15 cm水平转子)。分离后离心管从上到下分4层,分别为血浆层、淋巴细胞层、透明分离液层和红细胞层。用微量加样器小心吸取淋巴细胞(Lymphocyte,L),按每管200 μL分装成5份,放入无菌冻存管中,用黑色永久性记号笔标注编号L1~L5,并放入标本盒编号L的相应位置。(2)脓液、灌洗液及浆膜腔积液的分离:用微量加样器小心吸取液体标本(Liquid specimen,LS),按每管200 μL分装成5份,放入无菌冻存管中,用黑色永久性记号笔标注编号LS1~LS5。
将采集完液体标本的抗冻管放入标本盒编号相应位置,一并快速置入转移式液氮罐,在30 min内放入-80℃超低温冰箱长期保存。分离出的标本需尽快保存[5]。登记入结核病组织标本信息库。注明患者信息、分离时间、具体位置及标本信息。
我院结核标本库采用5×10冷冻管盒,一人一盒制。将注有标本相关信息的条形码打印纸贴在标本盒的正面上。在对应抗冻管的第一行盒面上用黑色永久性记号笔标注编号①~⑩。并注明①~⑩各个编号代表的标本名称。如:①为组织标本(T),②为血清标本(S),③为淋巴细胞(L)等。并在相对应列上的抗冻管头上标注,如:第1列为血清标本,则在相对应列的抗冻管头上标注S,编号为S1到S5;第2列为血浆标本,则在相对应列的抗冻管头上标注P,编号为P1~P5,以此类推,具体可参考图1。


数据库系统运行平台基于Windows操作系统,有独立的服务器,以保证数据库的高安全性和高容量。另外,标本库信息管理系统需具备与医院LIS系统接口,以便提取患者的基本信息和检验、治疗、病理及随访等信息。
包括姓名、入组编号、性别、年龄、住院号(ID号)、联系方式、诊断、病理号、治疗方案等。
包括入组编号、组织名称、病变部位、处理方式、保存方法、采集人的姓名和采集方式、记录标本的离体时间和保存时间等。
包括使用标本的出入库编号及日期、归还时间及使用人、标本的位置等。
包括废除编号、标本位置、日期、原因、审批人等。
挑选有丰富经验的实验员,对标本处理人员进行培训。培训内容包括:讲解原理、步骤和可能遇到的问题及解决方法。经过2周的培训及试用,使标本人员熟练掌握质量控制的方法、操作规范以及收集流程。
DNA/RNA提取及鉴定:从标本库保存的组织中定期随机抽取样本,提取后经1%琼脂糖凝胶150 V电压下电泳15 min,紫外灯下可显示检测的DNA/RNA完整性如何,有无降解,电泳条带是否清晰。所有用于试验的标本均详细登记其试验时间、试验人、试验内容、试验结果,以进行标本质量控制。
患者自出院后需定期随访,了解患者病情,并在随访本中记录。
共收集267例患者的标本,其中结核性脓胸患者53例(组织标本53例、脓液标本53例、血液标本53例),空洞型肺结核患者35例(组织标本35例、灌洗液标本35例、血液标本35例),肺结核球患者23例(组织标本23例、血液标本23例),毁损肺患者12例(组织标本12例、血液标本12例),肺结核合并肺癌患者7例(组织标本7例、血液标本7例),结核性心包炎患者21例(组织标本21例、心包积液标本21例、血液标本21例),淋巴结结核患者116例(组织标本116例、脓液标本67例、血液标本116例)。
从标本库保存的组织标本中定期随机抽取样本,委托杭州邦唯生物技术有限公司完成样本组织DNA/RNA的提取及鉴定。随机抽取的组织样本为8例标本(淋巴结组织标本3例,结核性脓胸组织标本2例,肺结核球组织标本1例,结核性心包炎组织标本1例,毁损肺组织标本1例),受检组织样本利用凝胶电泳实验检测。所检测组织标本的RNA均可见清晰的28S及18S条带,表明有较好的RNA完整性(图2)。所有检测的标本DNA完整性良好,无降解,电泳条带清晰(图3),能够满足科研实验的要求。
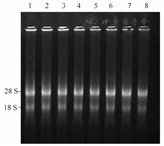

注:1~8.随机抽样标本的RNA
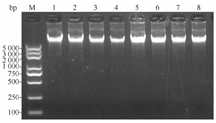

注:M. DNA标准带,1~8.随机抽样标本的DNA
近年来,国内外已经建立了许多具有科研代表性的标本库[6,7],但多以肿瘤标本为主,结核病相关的较少,且多以菌株的形式收集。这种收集方式的前提是能够找到结核分枝杆菌,并且培养形成菌株后才能进行进一步的研究及针对性的治疗。然而临床上大量的病例未能如愿找到结核分枝杆菌。对于那些未能找到结核分枝杆菌且临床治疗效果欠佳的结核病患者,其研究及治疗则相对困难。既往结核病手术切除的组织标本多以石腊包埋组织块的形式保存。这种方式保存的组织块,其RNA/DNA含量和完整性以及相关重要信息已有丢失,使得在分子生物学基础上的许多研究无法开展[8]。而通过-80℃超低温冰箱保存的标本,其相关重要信息都得到了很好的保留,有利于结核病的科研研究[9]。我院结核病标本库收集的标本是组织标本和液体标本,无需局限于是否找到结核分枝杆菌。将标本进行规范化处理及保存,临床资料信息进行系统化管理。通过随机抽样,利用凝胶电泳实验进行质量监测。检测的组织标本显示,我院结核病标本库保存的标本质量稳定,可满足未来的科研实验要求,为结核病的研究提供了新的平台。
结核病标本库相对于其他标本库而言,所保存的标本有一定的传染性,在其保存及消毒隔离方面有特殊的要求。医护人员需提高防护意识,做好消毒隔离。严格执行进入标本库需戴口罩、穿隔离服、工作鞋,接触标本和操作前后洗手制度。严格执行清洁、无菌技术和隔离制度。尽量杜绝或减少职业危害的发生。
标本质量控制是规范化标本库建立的关键[10,11,12,13,14]。包括取材准确性、标本离体时间以及冻存时间等因素均影响研究结果和标本的质量。为了防止分子生物学信息降解,尽量在最短的时间内完成采集及保存(组织标本离体后30 min内)。我院结核病标本库标本的保存采用一人一盒制,将标本进行预处理及预分离,同一标本尽量分装在多个抗冻管中,每次需要实验时取1个抗冻管标本,而非整个标本,以减少标本反复冻融的次数。有研究显示标本反复冻融3次后RNA降解水平达到17.5%,5次冻融循环后RNA则广泛降解,不能用于临床或基因检测[15,16]。标本采集冻存后,随着冻存时间的延长,组织标本会出现缓慢的降解,需要进行定期标本抽样质量监测,了解其标本质量稳定性。有研究发现DNA在-80℃的环境保存9年以上,其完整性和含量没有显著的变化。但相对不稳定的RNA来说,低温冻存时间超过5年就会存在严重的降解。有的文献建议RNA进行纯化后再冻存,以提高标本质量的稳定性。
在数据库方面,将结核病标本临床资料、病理资料、随访数据及标本收集、制备、保存等信息联合起来,利用软件的强大功能把患者的信息全面化。建立功能完善的数据库,使标本库信息化,医疗资源共享化。
总之,建立规范化的结核病标本库可为结核病领域研究提供珍贵的临床样本资源,促进结核领域研究的发展,具有十分重要的医学意义。
无


























