
了解消化道症状人群幽门螺杆菌(Helicobacter Pylori,HP)感染的流行病学特点,并探讨血清中胃泌素-17(G-17)、胃蛋白酶原Ⅰ(PG-Ⅰ)和胃蛋白酶原Ⅱ(PG-Ⅱ)水平及病理改变与HP感染的相关性。
收集2016年12月至2018年5月因消化道症状在金华文荣医院消化内科住院治疗患者612例,根据是否感染HP分为HP感染阳性组(n=428)和HP感染阴性组(n=184)。所有患者进行病理组织学检查,并采用酶联免疫吸附实验检测血清G-17、PG-Ⅰ和PG-Ⅱ水平。分析HP感染与胃黏膜"血清学活检"指标及病理改变的相关性。采用SPSS 17.0软件对数据进行分析。
612例患者中,HP感染率为69.93%。农村地区、医务人员及农民、家庭成员数>4人的HP感染率更高(P<0.05)。HP感染阳性组患者G-17、PG-Ⅰ和PG-Ⅰ/PG-Ⅱ的阳性检出率均高于阴性组(P<0.01),两组PG-Ⅱ比较,差异无统计学意义(P>0.05)。病理学上浅表性胃炎组HP阳性感染率更低,萎缩性胃炎和肠上皮化生HP阳性感染率更高(P<0.05)。在HP感染患者中,与浅表性胃炎患者比较,萎缩性胃炎、肠上皮化生、上皮内瘤变患者的G17水平均升高,PG-Ⅰ/PG-Ⅱ水平均下降;上皮内瘤变患者的PG-Ⅰ和PG-Ⅰ/PG-Ⅱ水平均低于萎缩性胃炎及肠上皮化生患者;肠上皮化生患者的PG-Ⅰ/PG-Ⅱ水平低于萎缩性胃炎患者。
HP感染率与居住地区、职业、家庭人数有关;胃黏膜"血清学活检"指标G-17、PG-Ⅰ和PG-Ⅰ/PG-Ⅱ的阳性检出率与HP感染有一定的相关性;Hp是慢性萎缩、肠上皮化生发展的促进因素,胃黏膜"血清学活检"指标有助于评估胃黏膜萎缩、肠化的部位及程度的准确性。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
幽门螺杆菌(Helicobacter pylori,HP)是一种螺旋形、微厌氧且对生长条件要求十分苛刻的细菌,是迄今为止人类发现的唯一好发于胃部的病原菌,也是Ⅰ类致癌物质之一[1]。有学者认为,HP感染可触发胃黏膜阶梯式炎症反应,导致慢性浅表性胃炎、慢性萎缩性胃炎、肠上皮化生、上皮内瘤变(又称为不典型增生)、胃癌及胃黏膜相关组织淋巴瘤等,而萎缩性胃炎称为癌前疾病,肠上皮化生、上皮内瘤变称为癌前病变[2]。因此,HP感染后胃黏膜结构和功能的改变,受到越来越多学者的关注。HP胃炎是一种感染性疾病,根除HP的获益在不同个体之间存在差异[3]。有学者利用胃黏膜"血清学活检"指标胃泌素-17(Gastrin-17,G-17)、胃蛋白酶原Ⅰ(PePsinogen-Ⅰ,PG-Ⅰ)和胃蛋白酶原Ⅱ(PePsinogen-Ⅱ,PG-Ⅱ)联合HP检测等筛查早期胃癌及胃癌前疾病[4,5],进而确定需要治疗的人群。本研究主要针对有消化道症状住院治疗人群HP感染的流行病学特点、血清PG-Ⅰ、PG-Ⅱ、G-17水平及病理组织学检查进行研究,分析HP感染、血清学各指标水平及胃黏膜病理改变之间的相关性,为HP感染的诊断和抗HP治疗提供参考依据。
收集2016年12月至2018年5月因消化道症状在金华文荣医院消化内科住院治疗患者612例,其中男性310例,女性302例,年龄为(56.9±12.3)岁。根据HP检测结果分为HP感染阳性组(n=428)和HP感染阴性组(n=184)。其中慢性浅表性胃炎320例,慢性萎缩性胃炎患者178例,肠上皮化生患者76例,胃黏膜上皮内瘤变患者38例。入选标准:无严重的心脑血管疾病等胃镜检查禁忌证者;近2周未使用抑酸剂,近4周内未使用抗菌药物﹑铋剂和某些具有抗菌作用的中药者。排除标准:合并全身其他系统及器官恶性肿瘤,严重肝肾功能不全患者。该研究经金华市文荣医院伦理委员会审核通过(2017-3-024),且所有患者均签署知情同意书。
所有研究对象均在进行胃镜前,空腹12 h后取静脉血并进行呼气试验。使用真空采血管对患者取静脉血5.0 mL,血液离体后室温凝集10 min,1 000×g,离心约5 min,2~8℃冰箱储存送检。血清G-17、PG-Ⅰ和PG-Ⅱ水平用酶联免疫吸附实验(ELISA)法定量检测,试剂由北京美康公司提供,按试剂盒说明书进行操作检测。呼气试验采用14C尿素呼气试验(14C-UBT)进行HP感染检测,试剂由深圳市中核海德威生物科技有限公司提供,按试剂盒说明书进行操作检测。
胃镜检查时检查者应用一次性无菌活检钳在胃窦部、胃体部充血糜烂等炎症部位或溃疡边缘部位或息肉样隆起组织分别取活检2~6块,甲醛固定,石蜡包埋,HE染色,由病理科医师做出慢性浅表性胃炎、慢性萎缩性胃炎、肠上皮化生、上皮内瘤变(低级别上皮内瘤变、高级别上皮内瘤变)、胃癌及胃黏膜相关组织淋巴瘤的诊断。
HP感染以14C尿素呼气试验(14C-UBT)和内镜胃黏膜活检结果综合判断。14C尿素呼气试验以测试值>100 dpm为阳性;胃镜检查时取活检标本,甲醛固定石蜡包埋HE染色后,由病理科医师做出是否感染HP的诊断。两种方法均为阴性则判定为HP感染阴性,两种方法之一若为阳性,则结果判断为HP感染阳性。以标本血清中G-17<1.00 pmol/L或>15.00 pmol/L、PG-Ⅰ<70.00 μg/L或>165.00 μg/L、PG-Ⅱ<3.00或>15.00 μg/L、PG-Ⅰ/PG-Ⅱ<7.00或>20.0为阳性计数判断标准。
采用SPSS 17.0软件对数据进行分析。计量资料采用 ±s表示,多样本比较时,应用方差分析,两两比较应用q检验(Newman-Keuls法);计数资料采用例(百分数)表示,采用χ2检验。以P<0.05为差异具有统计学意义。
±s表示,多样本比较时,应用方差分析,两两比较应用q检验(Newman-Keuls法);计数资料采用例(百分数)表示,采用χ2检验。以P<0.05为差异具有统计学意义。
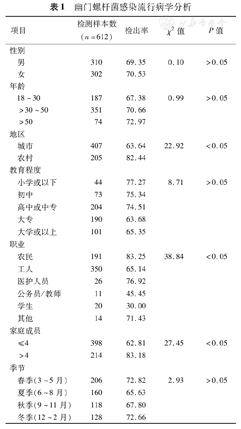
因消化道症状在我院住院治疗患者612例中,HP感染患者428例,感染率为69.93%。农村地区人群HP感染率明显高于城市地区人群(χ2=22.92,P<0.05);不同职业人群的HP感染率比较,差异具有统计学意义(χ2=38.84,P<0.05);家庭成员>4人HP感染率较高(χ2=27.45,P<0.05)。HP感染率在性别、年龄、受教育程度及季节方面比较,差异均无统计学意义(P值均>0.05)。见表1。
幽门螺杆菌感染流行病学分析
幽门螺杆菌感染流行病学分析
| 项目 | 检测样本数(n=612) | 检出率 | χ2值 | P值 | |
|---|---|---|---|---|---|
| 性别 | |||||
| 男 | 310 | 69.35 | 0.10 | >0.05 | |
| 女 | 302 | 70.53 | |||
| 年龄 | |||||
| 18~30 | 187 | 67.38 | 0.99 | >0.05 | |
| >30~50 | 351 | 70.66 | |||
| >50 | 74 | 72.97 | |||
| 地区 | |||||
| 城市 | 407 | 63.64 | 22.92 | <0.05 | |
| 农村 | 205 | 82.44 | |||
| 教育程度 | |||||
| 小学或以下 | 44 | 77.27 | 8.71 | >0.05 | |
| 初中 | 73 | 75.34 | |||
| 高中或中专 | 204 | 74.51 | |||
| 大专 | 190 | 63.68 | |||
| 大学或以上 | 101 | 65.35 | |||
| 职业 | |||||
| 农民 | 191 | 83.25 | 38.84 | <0.05 | |
| 工人 | 350 | 65.14 | |||
| 医护人员 | 26 | 76.92 | |||
| 公务员/教师 | 11 | 45.45 | |||
| 学生 | 20 | 30.00 | |||
| 其他 | 14 | 71.43 | |||
| 家庭成员 | |||||
| ≤4 | 398 | 62.81 | 27.45 | <0.05 | |
| >4 | 214 | 83.18 | |||
| 季节 | |||||
| 春季(3~5月) | 206 | 72.82 | 2.93 | >0.05 | |
| 夏季(6~8月) | 160 | 65.63 | |||
| 秋季(9~11月) | 118 | 67.80 | |||
| 冬季(12~2月) | 128 | 72.66 | |||
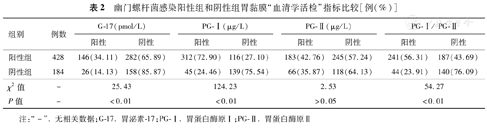
比较两组患者胃黏膜"血清学活检"指标,结果显示,HP感染阳性组G-17、PG-Ⅰ和PG-Ⅰ/PG-Ⅱ的阳性检出率均明显高于阴性组,差异具有统计学意义(χ2=25.43、124.23和54.27,P<0.01)。两组患者的PG-Ⅱ的阳性检出率比较,差异无统计学意义(χ2=2.53,P>0.05),见表2。
幽门螺杆菌感染阳性组和阴性组胃黏膜"血清学活检"指标比较[例(%)]
幽门螺杆菌感染阳性组和阴性组胃黏膜"血清学活检"指标比较[例(%)]
| 组别 | 例数 | G-17(pmol/L) | PG-Ⅰ(μg/L) | PG-Ⅱ(μg/L) | PG-Ⅰ/ PG-Ⅱ | ||||
|---|---|---|---|---|---|---|---|---|---|
| 阳性 | 阴性 | 阳性 | 阴性 | 阳性 | 阴性 | 阳性 | 阴性 | ||
| 阳性组 | 428 | 146(34.11) | 282(65.89) | 312(72.90) | 116(27.10) | 183(42.76) | 245(57.24) | 241(56.31) | 187(43.69) |
| 阴性组 | 184 | 26(14.13) | 158(85.87) | 45(24.46) | 139(75.54) | 66(35.87) | 118(64.13) | 44(23.91) | 140(76.09) |
| χ2值 | - | 25.43 | 124.23 | 2.53 | 54.27 | ||||
| P值 | - | <0.01 | <0.01 | >0.05 | <0.01 | ||||
注:"-".无相关数据;G-17.胃泌素-17;PG-Ⅰ.胃蛋白酶原Ⅰ;PG-Ⅱ.胃蛋白酶原Ⅱ
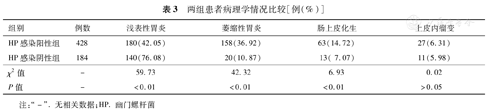
比较两组患者胃黏膜组织病理学情况,结果显示,HP感染阳性组浅表性胃炎的阳性检出率明显低于阴性组(χ2=59.73,P<0.01),萎缩性胃炎和肠上皮化生的阳性检出率均明显高于阴性组(χ2=42.32和6.93,P<0.01),两组患者的上皮内瘤变的阳性检出率比较,差异无统计学意义(χ2=0.02,P>0.05),见表3。
两组患者病理学情况比较[例(%)]
两组患者病理学情况比较[例(%)]
| 组别 | 例数 | 浅表性胃炎 | 萎缩性胃炎 | 肠上皮化生 | 上皮内瘤变 |
|---|---|---|---|---|---|
| HP感染阳性组 | 428 | 180(42.05) | 158(36.92) | 63(14.72) | 27(6.31) |
| HP感染阴性组 | 184 | 140(76.08) | 20(10.87) | 13( 7.07) | 11(5.98) |
| χ2值 | - | 59.73 | 42.32 | 6.93 | 0.02 |
| P值 | - | <0.01 | <0.01 | <0.01 | >0.05 |
注:"-".无相关数据;HP.幽门螺杆菌
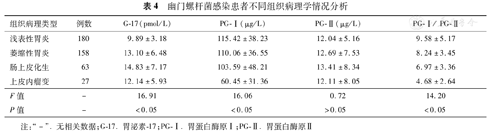
在HP感染患者中,与浅表性胃炎患者比较,萎缩性胃炎、肠上皮化生、上皮内瘤变患者的G17水平均升高(q=7.67、8.79和2.84,P<0.05),PG-Ⅰ/PG-Ⅱ水平均下降(q=4.12、5.98和7.97,P<0.05)。肠上皮化生患者G-17水平高于萎缩性胃炎患者(q=3.02,P<0.05)。上皮内瘤变患者的PG-Ⅰ和PG-Ⅰ/PG-Ⅱ水平均低于萎缩性胃炎(q=8.66和5.74,P<0.05)及肠上皮化生患者(q=6.82和3.34,P<0.05),PG-Ⅰ水平低于浅表性胃炎患者(q=9.69,P<0.05)。肠上皮化生患者的PG-Ⅰ/PG-Ⅱ水平低于萎缩性胃炎患者(q=2.86,P<0.05)。不同组织病理类型患者PG-Ⅱ水平比较,差异均无统计学意义(P>0.05),见表4。
幽门螺杆菌感染患者不同组织病理学情况分析
幽门螺杆菌感染患者不同组织病理学情况分析
| 组织病理类型 | 例数 | G-17(pmol/L) | PG-Ⅰ(μg/L) | PG-Ⅱ(μg/L) | PG-Ⅰ/ PG-Ⅱ |
|---|---|---|---|---|---|
| 浅表性胃炎 | 180 | 9.89±3.18 | 115.42±38.23 | 12.04±5.16 | 9.58±5.17 |
| 萎缩性胃炎 | 158 | 13.10±6.48 | 110.06±36.55 | 12.69±7.53 | 8.24±3.45 |
| 肠上皮化生 | 63 | 14.83±7.17 | 103.59±48.21 | 13.41±8.34 | 6.97±3.36 |
| 上皮内瘤变 | 27 | 12.14±5.93 | 60.45±31.36 | 12.11±8.05 | 4.68±2.64 |
| F值 | - | 16.91 | 16.06 | 0.72 | 14.20 |
| P值 | - | <0.05 | <0.05 | >0.05 | <0.05 |
注:"-".无相关数据;G-17.胃泌素-17;PG-Ⅰ.胃蛋白酶原Ⅰ;PG-Ⅱ.胃蛋白酶原Ⅱ
HP作为一种感染性微生物,易定植于胃黏膜表面,从而引起细胞损害、炎症反应,导致胃黏膜的慢性炎症,部分患者可发生胃黏膜萎缩、肠化生及不典型增生[6]。因此,针对HP感染的早诊断、早干预显得尤其重要,多年来一直受到人们关注。
我国HP感染率为40%~90%,平均为50%[7]。在我院住院治疗人群HP感染率为69.93%,提示有较高的HP感染率。流行病学调查资料显示农村地区、医务人员及农民、家庭成员数>4人的HP感染率更高,而在性别、年龄、季节、婚姻及教育程度方面,HP感染率差异无统计学意义(P>0.05)。具体原因分析如下:农村地区、农民HP感染率较高,可能因农村卫生条件差,自来水未完全普及,更易成为HP感染对象,与张万岱等[8]、李兴丰等[9]报道一致;医护人员因为长期接触HP感染者,特别是从事消化道内镜检查、胃肠道手术的医护人员,可能通过接触患者血液和消化道分泌液感染[10];家庭成员数>4人HP感染率更高,显示具有家庭的集聚性,提示人-人的传播是HP的重要传播途径,也与国内外的研究报道一致[10,11]。
本研究发现,HP感染阳性患者血清中G-17、PG -Ⅰ和PG-Ⅰ/PG-Ⅱ阳性检出率明显高于HP感染阴性组,提示血清中G-17、PG I和PG-Ⅰ/PG-Ⅱ的含量变化与HP感染有一定的相关性,与姜凤全等[11]、Tu等[12]报道一致,G-17、PG -Ⅰ和PG-Ⅰ/PG-Ⅱ水平的改变可反映胃黏膜腺体和细胞数量的变化[11]。原因可能为HP感染机体后能够穿透黏液层进而侵袭正常胃黏膜,在胃上皮细胞表面定居并且能够释放毒素因子等破坏胃内微生态环境,从而使胃黏膜的结构和功能受到损伤。G-17是一种重要的胃肠激素,主要由胃幽门部的黏膜G细胞分泌,进入血液后再作用于胃,主要功能是促进胃酸和胃蛋白酶的分泌;PG-Ⅰ主要由胃底腺主细胞和黏液颈细胞分泌;PG-Ⅱ由全胃腺(胃底腺、胃贲门腺和胃窦幽门腺)的黏液颈细胞合成分泌。G-17、PG-Ⅰ和PG-Ⅱ可间接反映胃黏膜不同部位的分泌功能[13]。
研究结果表明,与HP感染阴性组比较,HP感染阳性组浅表性胃炎的阳性检出率更低,萎缩性胃炎和肠上皮化生的阳性检出率均明显更高,提示HP是慢性胃炎发生的病因之一,是慢性萎缩、肠上皮化生发展的促进因素。在428例HP感染阳性患者进一步研究中,与慢性浅表性胃炎相比较,萎缩性胃炎、肠上皮化生、上皮内瘤变组HP感染率更高,G-17水平升高,PG-Ⅰ/PG-Ⅱ比值水平下降,而PG-Ⅱ水平不变或轻度升高,仅上皮内瘤变组PG-Ⅰ水平下降。提示在胃黏膜病理"慢性萎缩、肠上皮化生、异型增生"的演变过程与胃黏膜"血清学活检"有一定的相关性,与孙丽萍[14]报道结果一致,与杨志平等[15]研究结果发现胃黏膜病理改变支持"HP感染、炎症、肠上皮化生、异型增生及胃癌"的演变过程相似。但与谢曙文等[16]报道结果发现HP感染阳性组PG-Ⅱ阳性检出率明显高于阴性组(P<0.05),两组PG-Ⅰ阳性检出率无统计学意义(P>0.05)有所差异,考虑与所选取研究人群中的胃体或胃窦萎缩部位差异有关。原因分析如下:HP感染后患者胃局部发生微生态改变,被幽门腺或肠上皮化生代替,腺体和主细胞的数量减少,引起PG -Ⅰ分泌减少,同时胃酸分泌明显减少,胃内PH值上升,负反馈作用促使G细胞分泌功能亢进,促进胃窦部G-17升高,进而促使主细胞和黏液颈细胞分泌功能亢进,胃蛋白酶原分泌增加,最终导致PG-Ⅰ不同程度下降,当因分泌PG-Ⅱ的腺体细胞全胃分布,导致PG-Ⅱ水平不变或轻度升高,因此血清PG-Ⅰ/PG-Ⅱ比值水平显著下降。当萎缩进一步加重或者上皮内瘤变时,以G细胞和主细胞的数量减少为主,分泌功能的增强代偿不了其数量的减少,表现为G-17、PG-Ⅰ和PG-Ⅰ/PG-Ⅱ均有下降[17]。因此,HP是慢性萎缩、肠上皮化生发展的促进因素;胃黏膜"血清学活检"指标,有助于评估胃黏膜萎缩、肠化的部位及程度的准确性。
2015年日本京都共识意见:作为胃癌的一级预防,HP感染的患者均需进行根除HP治疗[18]。结合我国2017版"第五次全国幽门螺杆菌感染处理共识报告"根除治疗:目前推荐铋剂四联(PPI+铋剂+2种抗菌药物)作为主要的经验性根除HP治疗方案,方案的选择需根据当地的HP抗菌药物耐药率和个人药物使用史,权衡疗效、药物费用、不良反应和其可获得性[3]。但是对儿童及老年人(年龄>70岁)特殊人群,HP感染要个体化处理[3]。原因分析:老年人(年龄>70岁)对根除HP治疗药物的耐受性和依从性降低,发生抗菌药物不良反应的风险增加;非萎缩性胃炎或轻度萎缩性胃炎患者根除HP预防胃癌的潜在获益下降,根除HP获益各异[3]。因此,建议HP感染的普通人群均需进行根除HP治疗,对特殊人群HP感染应进行获益-风险综合评估后个体化处理。
综上所述,本地区消化道症状人群有较高的HP感染率,HP感染率与居住地区、职业、家庭人数有关;胃黏膜"血清学活检"指标G-17、PG-Ⅰ和PG-Ⅰ/PG-Ⅱ的阳性检出率与HP感染有一定的相关性;HP是慢性萎缩、肠上皮化生发展的促进因素,胃黏膜"血清学活检",有助于增加评估胃黏膜萎缩、肠化的部位及程度的准确性。HP感染的普通人群均需进行根除HP治疗,特殊人群在行根除HP获益-风险综合评估后,个体化处理。
所有作者均声明不存在利益冲突



























