
分析重症监护病房(ICU)老年感染性休克患者预后危险因素,为临床判断和治疗提供参考。
回顾性分析2015年11月至2019年3月宁波市医疗中心李惠利东部医院ICU收治的老年感染性休克患者,共113例,其中存活组73例,死亡组40例。分析两组患者的一般情况、基础疾病、实验室指标和侵入性操作,采用多因素Logistic回归分析感染性休克的预后危险因素,ROC曲线分析危险因素对死亡的预测价值。
多因素Logistic回归分析显示,急性生理和慢性健康状况(APACHEII)评分(OR=1.344,95%CI 1.187~1.520,P<0.01)和入住ICU时乳酸水平(OR=1.311,95%CI 1.075~1.599,P<0.01)为预后的独立危险因素,血小板计数(OR=0.986,95%CI 0.976~0.996,P<0.01)和白蛋白水平(OR=0.812,95%CI 0.697~0.945,P<0.01)为预后的保护因素。ROC曲线分析显示:APACHEII评分、入住ICU时乳酸水平、APACHEII评分联合入住ICU时乳酸水平的曲线下面积分别为0.861(95%CI 0.784~0.919,P<0.01)、0.752(95%CI 0.662~0.828,P<0.01)、0.904(95%CI 0.834~0.951,P<0.01)。APACHEII评分联合入住ICU时乳酸水平的预测价值优于APACHEII评分、入住ICU时乳酸水平(Z=2.175和2.879,P<0.05和P<0.01)。
降低APACHEII评分和乳酸水平、增加血小板计数、适当补充白蛋白有助于改善ICU老年感染性休克患者预后。APACHEII评分联合入住ICU时乳酸水平具有较好的死亡预测价值。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
尽管监护及治疗手段已有显著进步,但感染性休克的病死率仍然非常高[1,2]。有研究表明:重症监护病房(ICU)感染性休克的病死率超过40%[3,4]。一些研究表明,影响感染性休克死亡的因素很多,如早期不恰当地使用抗菌药物、延迟抗菌药物治疗、疾病的严重程度、低蛋白血症、持续的高乳酸血症和免疫缺陷等[5,6,7,8,9]。老年患者基础疾病多,如高血压病、糖尿病、冠心病、慢性肾脏疾病、慢性阻塞性肺疾病(COPD)、肿瘤等,器官功能容易出现异常,发生感染性休克时病情会更加严重,治疗也更加困难。对老年患者感染性休克的研究较少,因此本研究旨在分析ICU老年感染性休克患者的预后危险因素,为临床治疗提供帮助。
收集2015年11月至2019年3月入住医院ICU的老年感染性休克患者,共113例,其中男60例,女53例,年龄60~93岁,平均(74.3±8.7)岁。以确诊感染性休克后28 d死亡为观察终点,其中存活组73例,死亡组40例。纳入标准:(1)年龄≥60岁;(2)临床诊断为感染性休克;(3)临床资料完整。排除标准:(1)临床诊断为非感染因素的休克或不能确定为感染性休克者;(2)心肺复苏术后;(3)入住ICU时间<24 h;(4)恶性肿瘤晚期。该研究经医院伦理委员会审批通过(伦理批号:DYLL2018062)。
充分液体复苏后仍需升压药物以维持平均动脉压≥65 mmHg(1 mmHg=0.133 kPa),且血乳酸>2 mmol/L的脓毒症[10]。
采用回顾性分析方法,记录患者年龄、性别、急性生理与慢性健康状况(APACHEII)评分、序贯器官衰竭评分(SOFA)、血液透析、实验室指标、合并真菌血症、基础疾病(冠心病、慢性心力衰竭、脑血管疾病、高血压病、糖尿病、慢性肾病、慢性肝病、COPD、肿瘤、类风湿性关节炎、HIV感染、重症肌无力)、侵入性操作(中心静脉导管、动脉导管、头部引流管、胸腔引流管、腹腔引流管、心包引流管、胃管、尿管、气管插管或气管切开导管)。
使用SPSS 17.0软件进行统计分析。符合正态分布的计量资料用 ±s表示,应用t检验,非正态分布的计量资料用中位数(M)和上下四分位数间距(P25,P75)表示,应用Mann-Whitney U检验。计数资料用例(百分数)表示,采用χ2检验,等级计数资料应用Mann-Whitney U检验。对单因素分析P<0.05的变量,用向前逐步法进行多因素Logistic回归分析。应用MedCalc软件(V18.2.1)对预后的危险因素进行受试者工作特征(Receiver operating characteristic,ROC)曲线分析,并比较曲线下面积。在统计分析的过程中,P<0.05为差异具有统计学意义。
±s表示,应用t检验,非正态分布的计量资料用中位数(M)和上下四分位数间距(P25,P75)表示,应用Mann-Whitney U检验。计数资料用例(百分数)表示,采用χ2检验,等级计数资料应用Mann-Whitney U检验。对单因素分析P<0.05的变量,用向前逐步法进行多因素Logistic回归分析。应用MedCalc软件(V18.2.1)对预后的危险因素进行受试者工作特征(Receiver operating characteristic,ROC)曲线分析,并比较曲线下面积。在统计分析的过程中,P<0.05为差异具有统计学意义。
存活组与死亡组的预后单因素分析见表1。死亡组血液透析比例、APACHEII评分、SOFA评分、肌酐水平、入住ICU时乳酸水平、合并真菌血症的例数和基础疾病种类高于存活组,血小板计数(PLT)和白蛋白(Alb)水平低于存活组,两组间的差异均具有统计学意义(P<0.05或<0.01)。

ICU老年感染性休克患者存活组与死亡组单因素分析[M(P25,P75)]
ICU老年感染性休克患者存活组与死亡组单因素分析[M(P25,P75)]
| 相关因素 | 存活组(n=73) | 死亡组(n=40) | χ2/t/Z值 | P值 | |
|---|---|---|---|---|---|
年龄(岁, ±s) ±s) | 73.8±8.2 | 75.3±9.8 | -0.815 | >0.05 | |
| 性别[男[例(%)]] | 37(50.7) | 23(57.5) | 0.482 | >0.05 | |
| 血液透析[例(%)] | 13(17.8) | 19(47.5) | 11.223 | <0.01 | |
APACHEII评分( ±s) ±s) | 16.7±5.1 | 26.3±7.4 | -7.318 | <0.01 | |
SOFA评分( ±s) ±s) | 8.5±2.6 | 12.7±3.2 | -7.421 | <0.01 | |
白蛋白水平(g/L, ±s) ±s) | 28.4±4.1 | 25.6±4.0 | 3.429 | <0.01 | |
| 血小板计数(×109/L) | 142.0( 80.0,197.0) | 91.5(38.0,168.5) | -2.735 | <0.01 | |
| 肌酐(μmol/L) | 93.0( 67.5,158.7) | 174.3(84.5,309.9) | -3.380 | <0.01 | |
| CRP(mg/L) | 172.5(106.0,245.0) | 200.0(73.6,271.3) | -0.354 | >0.05 | |
| PCT(ng/mL) | 8.2( 2.6, 47.9) | 14.6( 3.6, 75.4) | -1.220 | >0.05 | |
| 入住ICU时乳酸水平(mmol/L) | 2.4( 2.2, 3.4) | 5.4( 2.8, 8.2) | -5.084 | <0.01 | |
| 合并真菌血症[例(%)] | 1( 1.4) | 5(12.5) | 4.346 | <0.05 | |
| 基础疾病[例(%)] | -2.191 | <0.05 | |||
| 无 | 22(30.1) | 4(10.0) | |||
| 1种 | 25(24.2) | 16(40.0) | |||
| 2种 | 17(23.3) | 12(30.0) | |||
| ≥3种 | 9(12.3) | 8(20.0) | |||
| 侵入性操作[例(%)] | -0.618 | >0.05 | |||
| ≤3种 | 14(19.2) | 2( 5.0) | |||
| 4种 | 14(19.2) | 10(25.0) | |||
| 5种 | 28(38.3) | 21(52.5) | |||
| 6种 | 17(23.3) | 7(17.5) | |||
注:ICU.重症监护病房;APACHEII评分.急性生理与慢性健康状况评分;SOFA.序贯器官衰竭评分;CRP.C-反应蛋白;PCT.降钙素原
将单因素分析中P<0.05的因素纳入多因素Logistic回归分析,结果显示:APACHEII评分和入住ICU时乳酸水平为预后的危险因素,PLT和Alb为预后的保护因素(表2)。
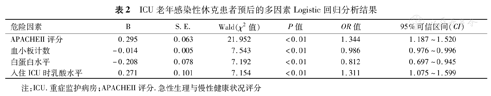
ICU老年感染性休克患者预后的多因素Logistic回归分析结果
ICU老年感染性休克患者预后的多因素Logistic回归分析结果
| 危险因素 | B | S.E. | Wald(χ2值) | P值 | OR值 | 95%可信区间(CI) |
|---|---|---|---|---|---|---|
| APACHEII评分 | 0.295 | 0.063 | 21.952 | <0.01 | 1.344 | 1.187~1.520 |
| 血小板计数 | -0.014 | 0.005 | 7.543 | <0.01 | 0.986 | 0.976~0.996 |
| 白蛋白水平 | -0.208 | 0.078 | 7.192 | <0.01 | 0.812 | 0.697~0.945 |
| 入住ICU时乳酸水平 | 0.271 | 0.101 | 7.154 | <0.01 | 1.311 | 1.075~1.599 |
注:ICU.重症监护病房;APACHEII评分.急性生理与慢性健康状况评分
APACHEII评分、入住ICU时乳酸水平、APACHEII评分+入住ICU时乳酸水平对ICU老年感染性休克患者死亡的预测ROC曲线详见图1。APACHEII评分+入住ICU时乳酸水平的预测模型为0.265×APACHEII评分+0.255×入住ICU时乳酸水平。APACHEII评分+入住ICU时乳酸水平的曲线下面积为0.904(95%CI 0.834~0.951),敏感度为82.5%,特异度为94.5%,优于APACHEII评分、入住ICU时乳酸水平单独的预测价值(Z=2.175和2.879,P<0.05和P<0.01),详见表3和表4。
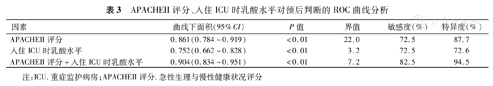
APACHEII评分、入住ICU时乳酸水平对预后判断的ROC曲线分析
APACHEII评分、入住ICU时乳酸水平对预后判断的ROC曲线分析
| 因素 | 曲线下面积(95%CI) | P值 | 界值 | 敏感度(%) | 特异度(%) |
|---|---|---|---|---|---|
| APACHEII评分 | 0.861(0.784~0.919) | <0.01 | 22.0 | 72.5 | 87.7 |
| 入住ICU时乳酸水平 | 0.752(0.662~0.828) | <0.01 | 3.2 | 72.5 | 72.6 |
| APACHEII评分+入住ICU时乳酸水平 | 0.904(0.834~0.951) | <0.01 | 7.2 | 82.5 | 94.5 |
注:ICU.重症监护病房;APACHEII评分.急性生理与慢性健康状况评分
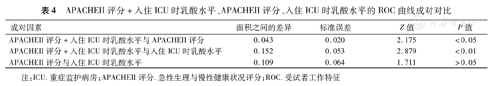
APACHEII评分+入住ICU时乳酸水平、APACHEII评分、入住ICU时乳酸水平的ROC曲线成对对比
APACHEII评分+入住ICU时乳酸水平、APACHEII评分、入住ICU时乳酸水平的ROC曲线成对对比
| 成对因素 | 面积之间的差异 | 标准误差 | Z值 | P值 |
|---|---|---|---|---|
| APACHEII评分+入住ICU时乳酸水平与APACHEII评分 | 0.043 | 0.020 | 2.175 | <0.05 |
| APACHEII评分+入住ICU时乳酸水平与入住ICU时乳酸水平 | 0.152 | 0.053 | 2.879 | <0.01 |
| APACHEII评分与入住ICU时乳酸水平 | 0.109 | 0.064 | 1.711 | >0.05 |
注:ICU.重症监护病房;APACHEII评分.急性生理与慢性健康状况评分;ROC.受试者工作特征
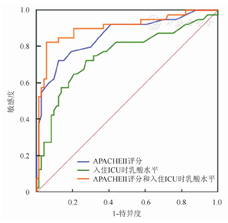

注:APACHEII评分.急性生理与慢性健康状况评分;ICU.重症监护病房
关于感染性休克的预后危险因素的研究已有较多报道,但单独分析老年感染性休克患者的研究较少,本研究对象年龄为60~93岁,老年感染性休克患者基础疾病更多,更易发生器官功能异常,病情更加严重,对老年感染性休克患者的预后危险因素进行研究对临床更有意义。本研究除了进行单因素、多因素分析,还进行了ROC曲线分析,是为了更好地评价预后因素的预测价值。ROC曲线下面积在0.5~0.7时准确性较低,在0.7~0.9时有一定准确性,在0.9以上时有较高准确性[11]。
APACHEII评分常常用来评估患者病情的严重程度,SOFA评分用来评价器官功能衰竭情况。本研究中,单因素分析显示存活组和死亡组APACHEII评分、SOFA评分差异具有统计学意义。文献报道[12],SOFA评分为感染性休克预后的独立危险因素,但本研究的多因素分析显示SOFA评分并不是感染性休克的危险因素,这与Song等[13]报道相似。多因素分析显示,APACHEII评分为死亡预测的独立危险因素。对APACHEII评分进行ROC曲线分析,其界值为22.0,提示APACHEII评分≥22.0分时能较好预测ICU老年感染性休克患者的预后,且敏感度为72.5%,特异度为87.7%。有文献报道[12],对141例严重感染和感染性休克患者进行预后危险因素分析,通过ROC曲线分析发现APACHEII评分的界值为17.0分,敏感度为92.3%,特异度为51.0%。结果不同原因主要是疾病严重程度、患者群体等有差别。
生理情况下,乳酸的生成和清除维持动态平衡,乳酸产生增多或乳酸清除减少将引起乳酸水平升高。感染性休克时有效循环血容量不足,导致组织、细胞缺氧,乳酸产生增加。因此,乳酸水平、乳酸清除率可反映感染性休克的严重程度。本研究中,死亡组患者乳酸水平高于存活组,差异具有统计学意义。多因素回归分析显示,入住ICU时乳酸水平为预测死亡的独立危险因素。有研究表明,乳酸水平>4 mmol/L与较高的病死率有关[14],另有研究显示,乳酸水平>4 mmol/L和乳酸清除率<20%与感染性休克的病死率有关[8],而本研究预测死亡的乳酸界值为3.2 mmol/L,可能与本研究选择的患者群体不同有关。
单因素分析显示,两组PLT计数差异具有统计学意义。严重感染和感染性休克可出现骨髓抑制、微血管内血栓形成,由于PLT寿命较短,常常导致短时间内PLT迅速下降,本研究显示死亡组PLT计数明显偏低,多因素分析发现PLT计数为感染性休克预后的保护因素,提示PLT计数适当升高可改善预后。临床检测中经常检测Alb,Alb对维持血管完整性和胶体渗透压非常重要,在血液中,Alb是很多内源性和外源性物质的重要载体,血清Alb水平的变化可能影响蛋白结合率较高的药物,因此,Alb下降可导致血浆胶体渗透压降低,同时明显影响治疗药物的效果。临床上有很多原因可导致低白蛋白血症,如严重感染、休克、烧伤、肾病综合征、肝硬化、营养不良等[15],危重症患者可能在数天内出现Alb水平明显下降。有研究表明[16],血清Alb水平与再入院患者的长期病死率密切相关,反复住院期间持续低白蛋白血症与长期死亡风险增加有关。另一项研究显示[17],对于低白蛋白血症住院患者,出院时Alb水平正常的存活率明显高于低白蛋白血症患者(82.4%比42.8%,P=0.004),因此,纠正低白蛋白血症或者保持Alb水平正常可能有助于提高存活率。本研究显示感染性休克死亡组Alb水平低于存活组,多因素分析提示Alb水平为老年感染性休克患者预后的保护因素。因此,对于伴有低白蛋白血症的感染性休克患者,血流动力学相对稳定后早期适当进行营养支持治疗,以及适当补充Alb可能有助于临床预后的改善。
本研究对预后的危险因素进行ROC曲线分析发现,APACHEII评分联合入住ICU时乳酸水平的曲线下面积最大,为0.904,大于APACHEII评分、入住ICU时乳酸水平单独的曲线下面积,且差异具有统计学意义(Z=2.175和2.879,P<0.05或<0.01)。因此,APACHEII评分联合入住ICU时乳酸水平对ICU老年感染性休克患者具有较好的死亡预测价值。
本研究的不足之处:(1)本研究为单中心、回顾性研究,且病例较少,如果为多中心、大样本研究,则对临床更有指导意义。(2)有研究表明,对于危重症或脓毒症患者ICU入住时淋巴细胞减少与病死率增加有关[18],早期自然杀伤细胞计数与严重脓毒症的预后有关[19],因此,淋巴细胞亚群对判断预后可能有一定价值,但回顾性分析时发现不是每个患者都检测了淋巴细胞亚群,无法纳入研究。(3)有研究分析初始、6、12、18和24 h乳酸水平对感染性休克患者有预测价值,死亡组12、18和24 h乳酸水平明显高于存活组,这项研究纳入103例感染性休克患者,但由于乳酸值的缺失剔除了53例患者,这对研究结果有明显的影响[20]。本研究由于入住ICU后24 h内有较多患者的乳酸值缺失,只是分析了入住ICU时乳酸水平,这对分析感染性休克的预后危险因素有一定的影响。
通过本研究可以得出,较高的APACHEII评分和入住ICU时乳酸水平、较低的血小板计数和白蛋白水平与ICU老年感染性休克患者的死亡有关,APACHEII评分联合入住ICU时乳酸水平具有较好的死亡预测价值。纠正组织缺氧、降低乳酸水平、及时纠正较低的PLT、适当补充Alb有助于改善预后。
所有作者均声明不存在利益冲突



























