
最新研究发现,肠道Akkermansia muciniphila(A. muciniphila)是调节人体免疫和代谢的重要功能菌,与人体的健康和疾病密切关联。本文对A. muciniphila的国内外研究进展进行详细综述,重点聚焦A. muciniphila的基本特性、定植影响因素及其维持肠道稳态的机制;系统阐述A. muciniphila与肥胖、动脉粥样硬化、糖尿病等慢性代谢疾病和感染性疾病的关联,及其成为新一代益生菌的临床应用前景和产业化过程中所面临的困难。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
随着厌氧培养技术的发展,2004年Derrien等[1]首次从健康人体粪便中分离出Akkermansia muciniphila (A.muciniphila) 。研究发现,A.muciniphila主要定植在胃肠道的外黏液层,以胃肠道的黏蛋白作为自身生长的碳和氮来源,其消耗黏蛋白与杯状细胞再生黏蛋白能够达到动态平衡,从而维持黏液层稳定。A.muciniphila以及其分泌物,如囊泡(Extracellular vesicles, EV)通过与结肠上皮细胞Toll受体(Toll-like receptor,TLR)结合及调节紧密连接蛋白的表达等来维持肠道稳态,从而改善高脂饮食诱导的肥胖和炎症性肠病(Inflammatory bowel disease, IBD)等疾病[2]。本文基于现有的国内外研究,对A.muciniphila的基本特性、定植情况、影响定植的因素,以及成为下一代益生菌所面临的难点等进行综述。
A. muciniphila是一种严格厌氧、非运动、没有内生孢子的卵圆形肠道细菌,其最适生长温度是37℃,最适生长pH为6.5,该菌的倍增时间大约是1.5 h[1]。A. muciniphila单独或者成对存在,很少成链生长,其代谢产物为乙酸盐、丙酸盐、1,2-丙二醇等。在提供蛋白源的基础培养基中,加入N-乙酰氨基葡萄糖、N-乙酰半乳糖胺和葡萄糖作为能源,A. muciniphila可以生长,但是在果糖和纤维二糖等其他糖类作为能源的培养基中A. muciniphila不能生长[1]。Ouwerkerk等[3]研究发现,A. muciniphila具有一定的耐氧性,其暴露在空气中24 h,仍然有1%以上的存活率。此外,研究还发现低氧气浓度(纳摩尔)下可以显著促进A. muciniphila的生长。纳摩尔浓度的氧气存在时,A. muciniphila可以使用细胞色素bd作为末端氧化酶进行呼吸,因为有氧呼吸产能高于发酵的能量产生,这可能是在低浓度氧气存在条件下A. muciniphila生长明显增加的原因。A. muciniphila最常用的培养基是脑心浸出液(Brain heartinfusion,BHI)培养基和以黏蛋白为基础营养底物的培养基,在加入黏蛋白的培养基中,菌株直径为640 nm,在BHI培养基中,该菌株直径为830 nm。但是,在黏蛋白培养基中A. muciniphila最终浓度是BHI的2倍,而且,在黏蛋白培养基上生长时产生微囊并且发生聚集,这种微囊结构和更小的直径可能有助于吸附和降解黏蛋白[1,4]。
通过细菌16S rRNA测序表明其属于疣微菌门(Verrucomicrobia),与Verrucomicrobium spinosum有92%序列相似性,是现在唯一已知的人类肠道疣微菌门成员[5]。其中文译名尚无统一,在文献中以阿克曼黏细菌、艾克曼黏细菌等名字出现[6]。在人类的胃肠道,至少有12个亚种。在Xing等[7]的研究中,根据DNA-DNA杂交(Digital DNA-DNA hybridiztion,dDDH)将23个Akkermansia属的菌株分为4种,分别为Akkermansia sp.CAG、Akkermansia sp.KLE、Akkermansia.muciniphila、Akkermansia. glycaniphila,23个菌株基因组的G+C含量为55%~58%。研究还发现不同菌株具有不同的基因组长度,人源菌株基因组是由2.7×106~3.1×106 bp的环状染色体组成,与菌株A.muciniphila ATCC BAA-835亲缘关系较近的菌株具有更多黏蛋白降解相关的基因。此外,不同来源的菌株也存在差异。例如人源菌株(ATCC)与鼠源菌株相比,人源菌株表现出更强的抗炎效果,并且能够增加调节性T细胞(Regulatory T cells, Tregs)的分化[8,9,10] 。
目前A. muciniphila在人体内的定植数据仍十分有限。A.muciniphila存在于人乳汁中,并以乳汁作为载体,在婴儿胃肠道定植[11]。在健康成年人中,Derrien等[8]通过荧光原位杂交(Fluorescence in situ hybridization, FISH)结合流式细胞仪定量分析发现A. muciniphila约占肠道菌群的1%~3%。在动物实验中,发现给无菌小鼠灌胃A. muciniphila,主要定植在盲肠,其次是回肠和结肠,虽然主要定植在盲肠,但是对结肠中免疫调节的基因影响最显著[12]。Reunanen等[13]在体外粘附试验中,发现A. muciniphila吸附于人结肠细胞系Caco-2和HT-29,而不是吸附于人结肠黏液。尽管其降解黏蛋白,但是与人结肠黏蛋白没有结合。进一步研究发现A. muciniphila结合细胞外基质的层粘连蛋白,而不是结合胶原蛋白Ⅰ和Ⅳ、纤连蛋白和胎球蛋白。A. muciniphila吸附于人结肠细胞系显著增加跨上皮电阻(Transepithelial electrical resistancs,TER),增强肠上皮细胞屏障完整性。Lyra等[14]在做结肠活检时,通过qPCR定量分析,发现A.muciniphila在左右结肠黏膜中的数量没有差异。然而,在体外肠道模拟实验中,发现A.muciniphila在结肠的不同位置中的定植存在差异,表现为升结肠中少量定植,降结肠和横结肠中较丰富。目前体外模拟存在没有肠道黏膜结构等缺陷,其在结肠各肠段的定植情况需进一步研究[15]。
A. muciniphila通过多种机制维持肠道稳态(图1)。一方面,A. muciniphila在胃肠道的外黏液层中定植,以胃肠道的黏蛋白作为生长的碳源和氮源,A. muciniphila分解黏蛋白并刺激杯状细胞合成黏蛋白达到动态平衡,从而维持黏液层的稳定。除A. muciniphila外,链球菌属、螺杆菌属、双歧杆菌属、梭菌属、普氏菌属、螺杆菌属等细菌也能够分泌降解黏蛋白所需的部分酶。基因组测序发现,与其他细菌比较,在A. muciniphila相对较小的基因组(2.7×106bp)中,富含与糖苷酶、唾液酸酶、蛋白酶和硫酸酯酶等全套黏蛋白降解酶表达相关的基因[16,17,18]。并且A. muciniphila还能够通过上调紧密连接蛋白ZO-1(Zonula occludens proteins, ZO-1)和闭合蛋白的表达,进而影响肠道屏障功能,减少脂多糖(Lipopolysaccharides,LPS)进入机体循环,降低内毒素血症,改善机体炎症[19]。
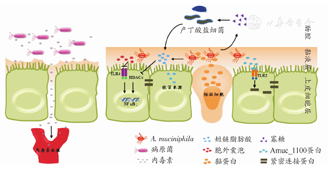

另一方面,A. muciniphila降解黏蛋白,释放可以被周围非黏液降解细菌利用的短链脂肪酸(Short chain fatty acids,SCFAs)、寡糖等代谢物。SCFAs是肠上皮细胞的直接能量来源,在维持肠道上皮细胞的正常功能中发挥重要作用[20,21]。而且SCFAs还能抑制组蛋白脱乙酰基酶(Histone deacetylases,HADCs),从而调节NF-κB通路,减少炎症因子的表达[22]。其中乙酸能够促进粪厌氧棒状菌(Anaerostipes caccae),霍氏真杆菌(Eubacterium hallii)和普拉梭菌(Faecalibacterium prausnitzi)等细菌产生丁酸盐[23]。丁酸可以促进Treg细胞的外周活化,增加结肠中Treg细胞亚群的数量,抑制促炎免疫细胞CD4+T淋巴细胞、CD8+T淋巴细胞活性[24,25]。此外,A. muciniphila的成分可以通过调节免疫而维持肠道的稳态。如A. muciniphila鞭毛中Amuc_1100蛋白是TLR2(Toll-like receptor 2, TLR2)的激活剂。研究发现该蛋白在巴氏灭菌的温度下稳定,并且能够诱导机体产生抗炎因子IL-10[26]。此外,A. muciniphila分泌的囊泡能够降低TLR4(Toll-like receptor 4, TLR4)的表达,从而调节NF-κB通路,减少促炎因子IL-6、IL-8的分泌[2,26]。
年龄和地理环境等因素影响人体A. muciniphila的数量。如Derrien等[27]研究发现,从婴幼儿时期开始A. muciniphila在人类胃肠道定植,并在一年后迅速接近成年人的水平(108个/g)。随着年龄增长A. muciniphila在人体内的数量逐渐降低。但与Derrien等研究不同,Guo等[9]发现>60岁人群A. muciniphila的数量升高。在Bárcena等[28]的研究中也发现,百岁老人中A. muciniphila数量显著增加,提示A. muciniphila水平的升高可能有助于延缓机体的衰老。另外,不同地理位置A. muciniphila在人群中定植也存在差别。如通过细菌16S rRNA分析发现,智利健康受试者粪便中的微生物菌群和巴布亚新几内亚受试者有明显不同;但与美国和阿根廷受试者接近;A. muciniphila在智利受试者的丰富度最高。中国南方的男性和女性定植率没有差异,但是中国南方人群的A. muciniphila定植率低于欧洲人群(51.71%比74.70%)[29]。
药物是影响肠道A.muciniphila丰度的重要因素之一。首先,抗菌药物作用后可以直接影响肠道A.muciniphila的数量。Hansen等[30]发现,在小鼠出生后早期用万古霉素进行干预可以有效预防1型糖尿病,显著降低小鼠血糖值以及减轻胰岛炎症;而对8周龄小鼠未见明显预防效果。万古霉素作用于幼儿时期的小鼠使A. muciniphila成为胃肠道优势菌群,该研究提示A. muciniphila可能是推迟1型糖尿病的关键菌群。Parker等[31]研究发现,对60例6~11个月的婴儿使用阿奇霉素治疗3 d后,婴儿A.muciniphila数量显著减少。此外Dubourg等[32]的研究中,2例成人患者经过抗生素(强力霉素、哌拉西林、羟氯喹、亚胺培南等)治疗后,A.muciniphila数量显著增加,在肠道菌群的比例均>40%。有趣的是,Han等[33]在小鼠模型中也发现类似现象,给小鼠灌胃四联抗生素(氨苄青霉素,万古霉素,新霉素和甲硝唑)可显著逆转免疫抑制剂导致的A.muciniphila数量减少。这些研究表明抗菌药物等药物使用会影响肠道内A.muciniphila数量的变化,其对人体代谢产生的影响需进一步研究。
最新的研究发现,代谢综合征相关治疗药物对A.muciniphila丰度的影响可能参与其作用机制。如二甲双胍通常用作治疗代谢综合征(如肥胖和2型糖尿病)的一线用药。在Cuesta-Zuluaga等[34]的研究中,对14例服用二甲双胍的糖尿病患者进行肠道菌群分析,与未服用二甲双胍的糖尿病患者以及健康受试者相比,A.muciniphila显著增加。在体外实验中,收集二甲双胍治疗组和对照组小鼠的粪便,发现二甲双胍培养组A.muciniphila的比例显著增加[35,36,37]。在Azevedo等[38]的研究中,使用另外一种代谢病治疗药物利拉鲁肽(Liraglutide)。对高脂饮食诱导的肥胖小鼠进行皮下注射给药,连续15 d给药后处死小鼠,收集肠道内容物进行菌群分析,发现治疗小鼠肠道中A.muciniphila显著增加。此外,抗肿瘤药物也可以影响肠道A.muciniphila的丰度。如Panebianco等[39]在胰腺导管腺癌(Pancreatic ductal adenocarcinoma, PDAC)异种移植的小鼠模型中发现,吉西他滨(Gemcitabine)治疗后使A.muciniphila在肠道中的数量显著增加(5%~33%)。
饮食对肠道A.muciniphila影响显著。Mu等[40]实验发现,与正常饮食组相比,高蛋白饮食显著降低大鼠肠道A.muciniphila。Schneeberger等[41]则发现小鼠A.muciniphila数量受到高脂饮食的强烈影响,高脂饮食三周后A.muciniphila丰度开始下降,并且A.muciniphila丰度与体质量呈负相关。Anhê等[42]发现,与高脂高糖饮食组相比,小鼠食用热带水果卡姆果8周后,可以显著增加A.muciniphila在胃肠道中的丰度;同时卡姆果干预后可以降低高脂高蔗糖饮食喂养小鼠的内毒素血症,改善其胰岛素敏感性。此外,丁酸钠和菊粉[43]、北极浆果提取物[44]、绿茶提取物和异麦芽寡糖[45]、膳食多酚[46]等这些益生元也能增加其丰度。
大量研究发现,代谢性疾病如肥胖、2型糖尿病和动脉粥样硬化病与肠道菌群的失衡有重要关系[47]。Schneeberger等[41]研究发现,在高脂饮食诱导的肥胖模型中,A.muciniphila数量显著减少,16周之后比初始水平低约10 000倍。Everard等[48]研究发现,在肥胖和糖尿病小鼠中A.muciniphila数量也显著降低;通过灌胃给肥胖小鼠补充A.muciniphila,显著逆转高脂饮食诱导的胰岛素抵抗、代谢性内毒素血症、改善脂肪堆积、空腹高血糖症,并且能够增加回肠中抗炎性的内源性大麻素的含量;但是热灭活(15 min,120 ℃,225 kPa)的A. muciniphila干预后效果不明显。
最近,Hänninen等[49]研究证明A. muciniphila与1型糖尿病的发生密切相关。他们先采用粪菌移植技术,将1型糖尿病低发病率的NOD小鼠的粪菌移植入1型糖尿病高发病率NOD小鼠,发现其发病率并未下降;进一步分析发现,粪菌移植未成功转移的肠道菌群中发现了A. muciniphila,用其对断奶高发病率NOD小鼠进行灌胃,15周时与对照组相比糖尿病发病率明显降低(4%比44%);研究发现补充A. muciniphila之后能够促使抗菌肽Reg3γ在结肠中的表达增加,降低血清中内毒素的含量和抑制胰岛TLR-2、TLR-4表达,推迟1型糖尿病在小鼠中发展。在Zhang等[50]链脲霉素和高脂饮食诱导的动物实验中,补充A.muciniphila治疗4周后,可改善链脲霉素和高脂饮食诱导的2型糖尿病大鼠中糖和脂质代谢,抑制氧化应激和炎症,并恢复肠道稳态,从而改善2型糖尿病;并且发现其经过巴氏灭菌之后具有更好的效果。Li等[19]进一步用A.muciniphila对载脂蛋白E缺陷Apoe(-/-)小鼠灌胃8周,能降低肠道通透性,减少巨噬细胞浸润和促炎细胞因子表达;降低循环LPS水平,进而逆转高脂饮食诱导的动脉粥样硬化病变的形成。这些研究表明,A. muciniphila可能是1型糖尿病、2型糖尿病等代谢性疾病防治新靶点。
研究表明A. muciniphila与免疫学疾病存在相关性。如在Van等[51]的研究中,给予早衰Ercc1-/Δ7模型小鼠A.muciniphila 10周,干预组比对照组小鼠的结肠黏液层厚度增加3倍,结肠和回肠炎症以及免疫相关的基因和通路表达下降,脾脏和肠系膜淋巴结中炎性细胞群减少。Png等[52]通过对46例IBD患者进行肠道黏膜组织活检,发现虽然疾病组肠道黏膜相关性黏蛋白降解菌总数增加1倍以上;但是在正常健康个体中占优势的黏蛋白降解菌A.muciniphila在IBD患者中显著减少了92倍以上。最近,Ban等[53]发现通过2%葡聚糖硫酸钠(Dextran sodium sulfate, DSS)灌胃建立的小鼠IBD模型中,肠道稳态被破坏;虽然灌胃A. muciniphila后发现加重IBD,但是口服A.muciniphila的囊泡,可明显减轻结肠壁的炎性细胞浸润,改善疾病活动指数,改善IBD。但是,与以上报道相反的是,在一项临床研究中发现湿疹婴儿粪便中有较高丰度的A muciniphila,这可能会降低肠屏障功能的完整性,增加患湿疹的风险;提示高丰度的A. muciniphila可能与婴儿湿疹存在相关性[54]。
Morffy Smith等[55]发现,疟疾感染孕小鼠模型中的寄生虫丰度与5种特定菌的含量呈负相关,包括A.muciniphila和其他如Allobaculum,Lactobacillus和S24-7;同时发现减少寄生虫丰度能降低孕产妇发病率和改善妊娠结局。在Deng等[56]的研究中,发现脆弱芽孢杆菌菌株ZY-312对艰难梭菌感染(Clostridium difficile infection,CDI)小鼠具有预防作用;有趣的是,A.muciniphila的相对丰度与脆弱类芽孢杆菌的治疗呈正相关,同时Sangster等[57]在CDI患者中也观察到了增加的A.muciniphila数量。Jenkins等[58]在曼氏裂体吸虫感染小鼠中发现,肠道微生物α多样性总体降低,但微生物β多样性显著增加,其特征是A. muciniphila和乳酸杆菌种群数量增加。以上结果提示A. muciniphila与感染性疾病存在负相关。但与此相反的是,Ganesh等[59]使用具有8个细菌种背景微生物群的限菌C3H小鼠模型,发现与单纯鼠伤寒沙门氏菌(S. Typhimurium)组相比,同时给予A.muciniphila和鼠伤寒沙门菌组的小鼠血清中促炎因子干扰素γ(IFNγ)、白细胞介素17(IL-17)、IL-12等mRNA水平升高,结肠和盲肠炎症加重,肠道稳态被破坏。但目前A. muciniphila与感染性疾病的相关研究仍十分有限。
近年来,A.muciniphila与其他疾病,如精神类和肿瘤疾病的相关性得到广泛关注。如Newell等[60]的最新研究发现,在自闭症谱系障碍(Autism spectrum disorder, ASD)的BTBR小鼠模型中A. muciniphila含量高于对照组;进行生酮饮食(Ketogenic diet, KD)可以重塑肠道的微生物群,降低A. muciniphila在盲肠中的数量,改善ASD的症状。但相关作用机制尚不明确。在Howe等[61]的研究中发现,肠道微生物尤其A. muciniphila的降低可减少肠上皮Pten基因缺陷肿瘤鼠(PtenΔIEC/ΔIEC)模型中肿瘤的形成;可能是因为小鼠中A. muciniphila及其他相关肠道菌群的变化,形成了一种预防肿瘤的微环境,从而抑制了肿瘤的形成。同样在条件性敲除APC(Adenomatous polyposis coli,APC)基因的肠道腺瘤模型小鼠中,发现A. muciniphila和H.typhlonius同时定植,可以显著减少肿瘤细胞数量,影响肠道肿瘤的发展[62]。
A. muciniphila与机体健康联系紧密,有潜力成为下一代益生菌。但目前A. muciniphila成为下一代益生菌,还有以下几点重要问题亟待解决:首先,需研发高效快速培养A. muciniphila的新技术。Ouwerkerk等[63]使用3 L血清瓶代替传统的锥形瓶对A. muciniphila进行培养,成功在实验室中获得1 L活性A. muciniphila,并且能够保存一年,存活率高达97.9%±4.5%,但是这只是实验室规模生产,大规模的工业生产仍是需要解决的问题。此外,实验室培养一般使用的是黏蛋白培养基,培养基中存在动物来源的蛋白质,对人体可能有过敏反应,工业化生产时需研发合理的工业化生产培养基。其次,需确定安全有效的治疗人群。目前研究发现A. muciniphila对于代谢性疾病效果显著,但是,在炎症性肠病、动脉粥样硬化等其他疾病中的干预,不同研究中存在不同的结果,其应用仍待商榷[53,60,64]。对于其作为药物面对的安全问题,研究发现,刺激肠上皮细胞产生等量IL-8,A.muciniphila所需细胞浓度比大肠杆菌高100倍,表明其激活上皮细胞炎症通路的能力非常低[13]。Plovier等[65]和Depommier等[66]已经证明有活性的A. muciniphila或者是巴氏消毒的A. muciniphila对人体是安全的,但目前A. muciniphila的临床研究较少,在临床上应用还需要更多的实验验证。最后,需要优化A. muciniphila的给药方式。Nugroho等[67]对其在胃肠道中的活性进行了优化。给出了双重乳液包封的方法,把A. muciniphila包裹在水包油包水的双重乳液中。在体外模拟胃肠道的释放实验中,发现包封的A. muciniphila活性比直接分散在模拟胃肠道的系统中活性更高,并且能够定向在肠道释放细菌,显著增加A. muciniphila对胃的抵抗力,对于实现在肠道的定向给药还需要更多的实验进行优化。此外,除了对活菌进行优化给药,还可以对其产物进行处理。例如,对其分泌的囊泡进行巴氏灭菌,对Amuc_1100蛋白进行包封,以达到优化A. muciniphila的治疗效果。
肠道微生物作为近年来研究的热点之一,大量研究成果证实:肠道微生物作为"内分泌器官"参与维持能量稳态和宿主免疫,是代谢疾病(例如肥胖、糖尿病)发生发展的重要因素[68]。最近大量的研究表明,A. muciniphila可改善机体的脂肪堆积、胰岛素抵抗及炎症,成为肥胖、糖尿病等代谢性疾病的新靶点。A. muciniphila将成为下一代有临床应用前景的益生菌。A. muciniphila作为肠道关键功能菌的重要成员,是介导外环境因素与宿主肠道上皮细胞相互作用的关键菌。但具体机制尚未明确,甚至有其危害健康的报道,因此亟待开展A. muciniphila参与人体健康和疾病的相关机制研究,促进A. muciniphila及其相关产物的临床应用转化。
感谢研究生郑志鹏和朱帅对本文提出的宝贵建议
所有作者均声明不存在利益冲突



























