
新型冠状病毒肺炎(COVID-19)是一种新发急性传染病,自2019年12月武汉出现首发病例以来,目前已波及我国其他地区及境外多个国家。目前该病的确诊依赖于患者呼吸道标本或血液标本病毒核酸检测或病毒基因测序。本文报道1例临床流行病学史明确、临床表现及CT影像学动态变化高度符合的疑似患者,连续3次咽拭子新型冠状病毒核酸检测均为阴性。由此分析,对于部分COVID-19病例,因缺乏咳嗽、咯痰等呼吸道症状,单纯咽拭子病毒核酸检测阴性不宜作为排除诊断的依据,应结合患者的流行病学史及临床表现做出综合判断,以免漏诊。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
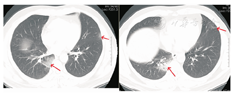
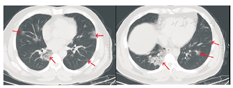
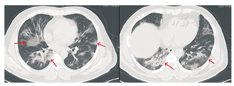
患者男,47岁,黑龙江省哈尔滨市人。因"发热5 d"于2020年1月21日收入我院发热留观病房。既往健康,否认慢性病史及传染病史。患者为火车司机,往返于哈尔滨——武汉区间。发病前两周曾两次随车到达武汉,并在武汉火车站站台逗留。2020年1月16日开始出现发热,体温在37.5~39 ℃,伴畏寒,无寒战。无咳嗽及咯痰,无喘息及呼吸困难。入院前1 d曾有轻微腹泻症状,排稀便两次,未见脓血。入院后查体:一般状态尚可,呼吸平稳,体温38.2 ℃,脉搏108次/min,呼吸16次/min,血压140/95 mmHg(1 mmHg=0.133 kPa)。球结膜轻度充血,双肺听诊呼吸音清,未闻及干湿啰音。入院当日在我院发热门诊行血常规检查:白细胞(WBC)6.14×109/L,中性粒细胞占比0.560,淋巴细胞占比0.337,淋巴细胞绝对计数2.07×109/L,单核细胞占比0.103,红细胞及血小板计数正常。胸部CT:左肺及右肺上下叶可见斑片影,边界模糊。影像学诊断:左肺及右肺上下叶炎性改变(图1)。入院当日市疾控中心行咽拭子2019-nCoV核酸检测阴性,其他相关检查结果:C-反应蛋白16.8 mg/L(参考值0~8 mg/L),红细胞沉降率38.00 mm/1 h(参考值0~15 mm/1 h),降钙素原0.10 ng/mL(参考值0~0.046 ng/mL),肌红蛋白203 ng/mL(参考值0~154.9 ng/mL),肌酸激酶1 149.60 U/L(参考值38~174 U/L),G-脂多糖、肝肾功能、凝血功能正常。相关病原学检查:甲型流感病毒、乙型流感病毒、副流感病毒-2型、嗜肺军团菌、肺炎支原体、肺炎衣原体、Q热立克次体、腺病毒、呼吸道合胞病毒、风疹病毒、单纯疱疹病毒、巨细胞病毒、弓形虫IgM抗体均阴性。EBV DNA定量<5.0×102拷贝/mL。入院当日开始静脉点滴盐酸莫西沙星氯化钠注射液(0.4 g/d),口服磷酸奥司他韦胶囊(75 mg/次,2次/d),补液对症治疗。1月23日,患者仍有间断高热,体温可达40 ℃。偶有轻微干咳,无痰。市疾控中心第2次咽拭子2019-nCoV核酸检测仍为阴性,我院复查血常规:WBC 4.89×109/L,中性粒细胞占比0.583,淋巴细胞占比0.319,淋巴细胞绝对计数1.56×109/L,单核细胞占比0.098。胸部CT:双肺可见斑片影及磨玻璃影,边界模糊。影像学诊断:双肺炎性改变(图2)。咽拭子细菌培养、血细菌+真菌培养未检出病原体。继续给予上述药物治疗,同时行物理降温,未应用退热药物。因两次2019-nCoV核酸检测阴性,建议患者回家中自行隔离治疗。1月24日患者仍有发热,咳嗽频繁,咯白痰,且患者配偶亦出现发热症状,即到我院急诊内科留观隔离,继续予盐酸莫西沙星氯化钠注射液静脉点滴、口服磷酸奥司他韦胶囊(两种药物剂量同上)。1月26日患者仍发热,体温最高达38.5 ℃,自觉胸闷、呼吸急促,查动脉血气分析:PaO2/FiO2:342 mmHg。血常规:WBC 4.37×109/L,中性粒细胞占比0.687,淋巴细胞占比0.197,淋巴细胞绝对计数0.86×109/L,单核细胞占比0.115。胸部CT:双肺可见淡片影,磨玻璃影,范围较前扩大,边界不清。影像学诊断:双肺炎症(图3)。1月27日我院组织院内专家会诊,认为该患者虽然两次2019-nCoV核酸检测阴性,但结合流行病学史及临床表现(高热,淋巴细胞计数进行性减少、肺部间质性病变且进行性加重),不能排除2019-nCoV感染,申请市疾控中心行第3次咽拭子2019-nCoV核酸检测,结果仍为阴性。患者仍维持原治疗方案治疗。1月28日患者体温趋于正常,自行离院,在家中继续隔离治疗。每3日对患者进行电话随访,患者未再出现发热,咳嗽、咯痰明显缓解,未出现呼吸困难。因疫情期间特殊情况,未到我院进行相关复查。



新型冠状病毒肺炎(COVID-19)是一种新发急性传染病,自2019年12月以来,由湖北省武汉市陆续发现多例患者,随着疫情的蔓延,该疾病已波及我国其他地区及境外多个国家和地区[1,2]。该病的病原体为一种新型冠状病毒,2020年1月12日被世界卫生组织命名为2019新型冠状病毒,即"2019-nCoV"。该病毒于β属的新型冠状病毒,有包膜,颗粒呈圆形或椭圆形,常为多形性,直径60~140 nm。其基因特征与SARS-CoV和MERS-CoV有明显区别[3]。感染者以发热、乏力、干咳为主要表现。重型病例多在一周后出现呼吸困难,严重者病情快速进展,出现急性呼吸窘迫综合征、继发感染、脓毒症休克、难以纠正的代谢性酸中毒和出凝血功能障碍等严重并发症[4]。国家卫生健康委员会现已将该病纳入《中华人民共和国传染病防治法》规定的乙类传染病,并采取甲类传染病的预防、控制措施。目前该病的传播仍呈现上升趋势,对疑似病例和确诊病例采取有效隔离是阻止疫情蔓延的关键所在。根据国家卫生健康委员会印发的《新型冠状病毒肺炎诊疗方案(试行第五版修正版)》[5],确诊病例需呼吸道标本或血液标本实时荧光RT-PCR检测2019-nCoV核酸阳性;或呼吸道标本或血液标本病毒基因测序,与已知的2019-nCoV高度同源。随着疫情的不断变化,COVID-19的确诊难度亦不断增大,有报道早期两次核酸检测阴性的患者,CT影像学高度疑似的COVID-19,最终重复核酸检测阳性确诊[6]。本文报道的患者,虽然3次病原学检测均为阴性,但流行病学史明确,临床表现及CT影像学的动态变化高度符合[7]。分析可能原因为:(1)检测手段的敏感性:实时荧光RT-PCR存在假阴性的可能;(2)检测误差:检测试剂盒本身质量、咽拭子采集是否规范以及标本送检储存、运送、检测操作等均会影响检测结果的可靠性;(3)样本采集的时机对检测结果的影响:既往关于SARS-CoV的研究显示,在发病前5 d内,鼻咽吸引器、咽拭子等上呼吸道标本的病毒核酸检出率较高,随病情进展,粪便标本核酸检测阳性率增高[8]。2019-nCoV是否有此趋势有待进一步验证;(4)标本采集部位的局限性:该患者因整个发病过程中缺乏咳嗽、咯痰等呼吸道症状,单纯咽拭子病毒核酸检测难以获取下呼吸道标本。既往的研究显示,对于多种呼吸道病毒核酸检测,下呼吸道标本无论从检出率或病毒载量方面均优于鼻咽拭子[9]。因此,对于无法获取痰标本的病例,行支气管肺泡灌洗液病毒核酸检测可能提高诊断的准确率。
随着COVID-19疫情的进展,临床不典型病例逐渐增多,核酸检测受多种外界因素干扰可能影响检测结果的准确性。这在一定程度上导致COVID-19的漏诊,结合胸部CT的动态变化和临床表现可作为确诊的有效补充。因此《新型冠状病毒肺炎诊疗方案(试行第五版修正版)》中,湖北省内诊断标准增加了临床诊断病例标准,并将CT影像学结果纳入标准中,但肺部CT能否代替核酸检测作为COVID-19的确诊标准仍有待探讨。对于传染性疾病而言,病原学检测是确诊金标准,单纯从CT影像学的角度,鉴别COVID-19与其他病毒感染性肺炎缺乏可靠的标准,应因时制宜、因地制宜地综合考虑这一问题。首先,对于一些早期呼吸道症状轻微、肺部CT无变化的患者,不能主观地排除COVID-19,忽略核酸检测的重要性;其次,对于疫情严重的地区,可参照湖北省临床诊断病例标准,注重CT影像学的结果。当患者有典型的肺部CT表现且病情进展迅速,即使核酸检测阴性,也应该高度警惕,按照COVID-19诊治指南的标准将其积极收入隔离治疗,定期反复检测病毒核酸,多部位取材,以最大程度地避免漏诊。
综上所述,在COVID-19的临床诊断过程中,应认真分析患者的流行病学史、临床表现及辅助检查的动态变化,综合判断。尤其是对于一些发病早期且呼吸道症状不明显的疑似病例,不宜单纯依赖于上呼吸道标本的核酸检测结果作为确诊病例的判别依据,从而导致漏诊,对患者盲目解除隔离,使疫情进一步扩散。
所有作者均声明不存在利益冲突



























