
分析新生儿感染病原菌和耐药情况。
收集2014年1月至2018年12月重庆市妇幼保健院新生儿感染分离的病原菌1 329株,采用BD phoenixl00全自动细菌鉴定仪或纸片扩散法进行菌株鉴定和药敏试验,观察新生儿感染病原菌情况,分析常见病原菌对抗菌药物的耐药性。采用SPSS 13.0对数据进行统计分析。
1 329株病原菌中,主要标本来源为咽拭子(36.64%,487/1 329)、血液(15.35%,204/1 329)和气管导管尖端(12.42%,165/1 329)。其中革兰阴性菌为60.27%(801/1 329),以肺炎克雷伯菌(20.54%,273/1 329)和大肠埃希菌(14.00%,186/1 329)为主;革兰阳性菌为36.34%(483/1 329),以金黄色葡萄球菌(20.84%,277/1 329)和表皮葡萄球菌(5.42%,72/1 329)为主;真菌为3.39%(45/1 329),以白假丝酵母菌为主(1.73%,23/1 329)。肺炎克雷伯菌分离率2014年最高(27.82%),2016年最低(11.71%),肺炎克雷伯菌对头孢唑啉、头孢噻肟和头孢吡肟的耐药率较高,均>50.00%;大肠埃希菌2014至2017年分离率相差不大,2018年最高(19.59%),2018年大肠埃希菌开始出现对哌拉西林/他唑巴坦耐药(2.08%),其他药物耐药率各年变化不大。产超广谱β-内酰胺酶(ESBLs)的肺炎克雷伯菌所占比例明显高于产ESBLs大肠埃希菌(13.47%比3.61%)。
新生儿感染病原菌以肺炎克雷伯菌、大肠埃希菌和金黄色葡萄球菌为主,临床应根据药敏结果合理选择抗菌药物,加强耐药防控措施。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
新生儿感染是新生儿死亡的高危因素,尤其是细菌感染,其预后取决于是否及时使用合适的抗菌药物进行治疗[1,2]。新生儿由于其免疫功能尚不健全,接受侵入性操作较多,抗菌药物使用较广泛,一直以来是医院感染防控的重点。导管相关血流感染、呼吸道感染等是新生儿科常见的医院感染[3]。近年来,多重耐药菌,尤其是泛耐药菌引起的医院感染日益严峻。不同地区、不同医院、不同科室的感染源谱存在较大差异,耐药菌的分布亦存在差异。而耐药监测是医院感染防控的重要举措[4,5]。本研究通过分析重庆市妇幼保健院新生儿科近5年来分离的病原菌及其耐药性,为医院感染防控提供数据支撑。
收集2014年1月至2018年12月重庆市妇幼保健院新生儿科住院感染患儿所有送检标本(包括血液、咽拭子、气管分泌物、气管导管尖端及脐分泌物等),并剔除重复菌株,共分离出1 329株菌株,来自于578例新生患儿,年龄为2~28 d。该研究符合《赫尔辛基宣言》,且所有患儿家属均签署知情同意书。
常见标本类型采集方法如下:(1)血液,按照规范对皮肤及血培养瓶进行消毒处理后,使用真空采血针采集血液注入血培养瓶中,轻轻颠倒混匀,2 h内送达实验室上机检测;(2)咽拭子,采样者用压舌板固定舌头,用采样拭子越过舌根到咽后壁及扁桃体隐窝、侧壁等处,反复擦拭3~5次,收集黏膜细胞,避免触及舌头、悬垂体、口腔黏膜和唾液,置于运送培养基,2 h内送检;(3)气管分泌物,通过气管内导管收集样本,置于无菌干燥管中,2 h内送检;(4)脐分泌物,无菌生理盐水清洗脐周围后用拭子取分泌物,置于运送培养基,2 h内送检。所有培养标本按照《全国临床检验操作规程》[6]进行细菌培养、分离、鉴定,采用BD phoenix-100全自动细菌鉴定仪及配套试剂进行细菌鉴定和药敏试验,药敏结果根据美国实验室标准化研究所(CLSI)2017年版[7]进行判定。质控菌株(卫生部临床检验中心):大肠埃希菌ATCC25922、铜绿假单胞菌ATCC27853、金黄色葡萄球菌ATCC25923、肺炎链球菌ATCC49619。根据病原菌分离部位、分离方法、染色结果、同部位分离出的其他病原体、患儿临床症状和感染类型等综合分析病原菌的感染、定植和污染[8]。
应用SPSS 13.0对数据进行统计分析,计数资料采用株(百分数)表示,采用χ2检验,以P<0.05为差异具有统计学意义。
1 329株病原菌中,以咽拭子标本最常见,共分离出487株,占36.64%,其次分别为血液标本(15.35%,204/1 329)、气管导管尖端标本(12.42%,165/1 329)及气管分泌物标本(8.58%,114/1 329)等。2014年以咽拭子标本分离的病原菌最多,其后明显减少,2015年仅占9.15%;2014年血液标本分离的病原菌为4.60%,从2015年起明显增加,均>15.00%;2014至2016年气管导管尖端和气管分泌物分离病原菌逐渐增多,而2017年起呈现逐渐下降的趋势;2014至2018年脐分泌物分离的病原菌逐年增多,2018年最高,为10.2%,见表1。
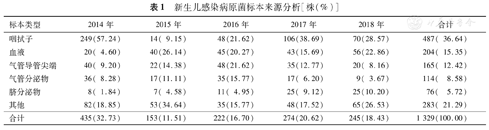
新生儿感染病原菌标本来源分析[株(%)]
新生儿感染病原菌标本来源分析[株(%)]
| 标本类型 | 2014年 | 2015年 | 2016年 | 2017年 | 2018年 | 合计 |
|---|---|---|---|---|---|---|
| 咽拭子 | 249(57.24) | 14( 9.15) | 48(21.62) | 106(38.69) | 70(28.57) | 487( 36.64) |
| 血液 | 20( 4.60) | 40(26.14) | 45(20.27) | 43(15.69) | 56(22.86) | 204( 15.35) |
| 气管导管尖端 | 40( 9.20) | 22(14.38) | 48(21.62) | 35(12.77) | 20( 8.16) | 165( 12.42) |
| 气管分泌物 | 36( 8.28) | 17(11.11) | 35(15.77) | 17( 6.20) | 9( 3.67) | 114( 8.58) |
| 脐分泌物 | 8( 1.84) | 7( 4.58) | 11( 4.95) | 25( 9.12) | 25(10.20) | 76( 5.72) |
| 其他 | 82(18.85) | 53(34.64) | 35(15.77) | 48(17.52) | 65(26.53) | 283( 21.29) |
| 合计 | 435(32.73) | 153(11.51) | 222(16.70) | 274(20.62) | 245(18.43) | 1 329(100.00) |
所有病原菌中,革兰阴性菌为801株(60.27%),主要为肺炎克雷伯菌(20.54%)、大肠埃希菌(14.00%)和流感嗜血杆菌(7.75%)等;革兰阳性菌为483株(36.34%),主要为金黄色葡萄球菌(20.84%)、表皮葡萄球菌(5.42%)和溶血性葡萄球菌(2.48%)等;真菌为45株(3.39%),主要为白假丝酵母菌(1.73%)和克柔假丝酵母菌(1.28%),见表2。
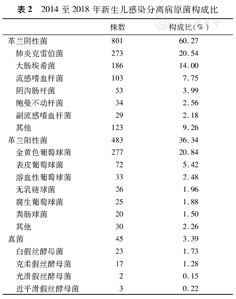
2014至2018年新生儿感染分离病原菌构成比
2014至2018年新生儿感染分离病原菌构成比
| 株数 | 构成比(%) | ||
|---|---|---|---|
| 革兰阴性菌 | 801 | 60.27 | |
| 肺炎克雷伯菌 | 273 | 20.54 | |
| 大肠埃希菌 | 186 | 14.00 | |
| 流感嗜血杆菌 | 103 | 7.75 | |
| 阴沟肠杆菌 | 53 | 3.99 | |
| 鲍曼不动杆菌 | 34 | 2.56 | |
| 副流感嗜血杆菌 | 29 | 2.18 | |
| 其他 | 123 | 9.26 | |
| 革兰阳性菌 | 483 | 36.34 | |
| 金黄色葡萄球菌 | 277 | 20.84 | |
| 表皮葡萄球菌 | 72 | 5.42 | |
| 溶血性葡萄球菌 | 33 | 2.48 | |
| 无乳链球菌 | 26 | 1.96 | |
| 腐生葡萄球菌 | 25 | 1.88 | |
| 粪肠球菌 | 20 | 1.50 | |
| 其他 | 30 | 2.26 | |
| 真菌 | 45 | 3.39 | |
| 白假丝酵母菌 | 23 | 1.73 | |
| 克柔假丝酵母菌 | 17 | 1.28 | |
| 光滑假丝酵母菌 | 2 | 0.15 | |
| 近平滑假丝酵母菌 | 3 | 0.22 | |
对主要病原菌进行趋势分析发现,2014至2016年金黄色葡萄球菌的分离率均<20.00%,2017至2018年明显上升,分别为24.09%和33.06%;2014年肺炎克雷伯菌分离率最高(27.82%),2016年最低(11.71%);2014至2017年大肠埃希菌分离相差不大,2018年最高(19.59%);鲍曼不动杆菌2014年分离率最高(6.67%),其他年份分离率均较低,2015年未分离到,见表3。
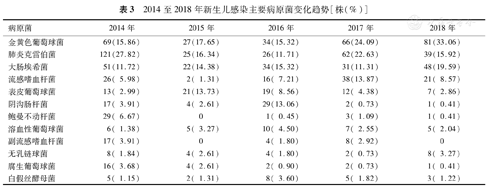
2014至2018年新生儿感染主要病原菌变化趋势[株(%)]
2014至2018年新生儿感染主要病原菌变化趋势[株(%)]
| 病原菌 | 2014年 | 2015年 | 2016年 | 2017年 | 2018年 |
|---|---|---|---|---|---|
| 金黄色葡萄球菌 | 69(15.86) | 27(17.65) | 34(15.32) | 66(24.09) | 81(33.06) |
| 肺炎克雷伯菌 | 121(27.82) | 25(16.34) | 26(11.71) | 62(22.63) | 39(15.92) |
| 大肠埃希菌 | 51(11.72) | 22(14.38) | 34(15.32) | 31(11.31) | 48(19.59) |
| 流感嗜血杆菌 | 26( 5.98) | 2( 1.31) | 16( 7.21) | 38(13.87) | 21( 8.57) |
| 表皮葡萄球菌 | 13( 2.99) | 21(13.73) | 19( 8.56) | 12( 4.38) | 7( 2.86) |
| 阴沟肠杆菌 | 17( 3.91) | 4( 2.61) | 29(13.06) | 2( 0.73) | 1( 0.41) |
| 鲍曼不动杆菌 | 29( 6.67) | 0 | 1( 0.45) | 3( 1.09) | 1( 0.41) |
| 溶血性葡萄球菌 | 6( 1.38) | 5( 3.27) | 10( 4.50) | 7( 2.55) | 5( 2.04) |
| 副流感嗜血杆菌 | 17( 3.91) | 0 | 4( 1.80) | 8( 2.92) | 0 |
| 无乳链球菌 | 8( 1.84) | 4( 2.61) | 4( 1.80) | 2( 0.73) | 8( 3.27) |
| 腐生葡萄球菌 | 16( 3.68) | 4( 2.61) | 2( 0.90) | 2( 0.73) | 1( 0.41) |
| 白假丝酵母菌 | 5( 1.15) | 2( 1.31) | 8( 3.60) | 5( 1.82) | 3( 1.22) |
2014至2018年从新生儿感染患者中分离出的革兰阴性菌主要为肺炎克雷伯菌和大肠埃希菌,针对以上2种革兰阴性菌进行耐药性分析,结果见表4。2014至2018年,肺炎克雷伯菌均对阿米卡星敏感;对氨苄西林的耐药率均为100.00%;2014、2015及2017年对亚胺培南均敏感,2016和2018年耐药率均<10.00%;2015和2017年对美罗培南均敏感,2014年耐药率为0.83%,2016年和2018年耐药率均为7.69%;2015至2016年对左氧氟沙星均敏感,近两年耐药率明显上升,2018年已达61.54%;2014至2018年对头孢唑啉、头孢噻肟和头孢吡肟的耐药率均>50.00%,2017年耐药率分别为100.00%、100.00%和98.39%。2014至2018年,大肠埃希菌对阿米卡星、亚胺培南和美罗培南均敏感;2014至2017年对哌拉西林/他唑巴坦均敏感,2018年耐药率为2.08%;其他药物耐药率各年变化不大。
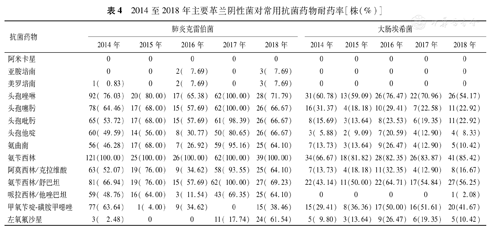
2014至2018年主要革兰阴性菌对常用抗菌药物耐药率[株(%)]
2014至2018年主要革兰阴性菌对常用抗菌药物耐药率[株(%)]
| 抗菌药物 | 肺炎克雷伯菌 | 大肠埃希菌 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 2014年 | 2015年 | 2016年 | 2017年 | 2018年 | 2014年 | 2015年 | 2016年 | 2017年 | 2018年 | |
| 阿米卡星 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 亚胺培南 | 0 | 0 | 2( 7.69) | 0 | 3( 7.69) | 0 | 0 | 0 | 0 | 0 |
| 美罗培南 | 1( 0.83) | 0 | 2( 7.69) | 0 | 3( 7.69) | 0 | 0 | 0 | 0 | 0 |
| 头孢唑啉 | 92( 76.03) | 20( 80.00) | 17( 65.38) | 62(100.00) | 28( 71.79) | 31(60.78) | 13(59.09) | 26(76.47) | 22(70.96) | 26(54.17) |
| 头孢噻肟 | 78( 64.46) | 17( 68.00) | 15( 57.69) | 62(100.00) | 26( 66.67) | 16(31.37) | 4(18.18) | 10(29.41) | 7(22.58) | 11(22.92) |
| 头孢吡肟 | 65( 53.72) | 17( 68.00) | 15( 57.69) | 61( 98.39) | 26( 66.67) | 8(15.69) | 3(13.64) | 8(23.53) | 6(19.35) | 11(22.92) |
| 头孢他啶 | 60( 49.59) | 14( 56.00) | 8( 30.77) | 50( 80.65) | 26( 66.67) | 3( 5.88) | 2( 9.09) | 7(20.59) | 4(12.90) | 4( 8.33) |
| 氨曲南 | 56( 46.28) | 17( 68.00) | 7( 26.92) | 59( 95.16) | 25( 64.10) | 7(13.73) | 3(13.64) | 9(26.47) | 4(12.90) | 5(10.42) |
| 氨苄西林 | 121(100.00) | 25(100.00) | 26(100.00) | 62(100.00) | 39(100.00) | 34(66.67) | 18(81.82) | 28(82.35) | 26(83.87) | 41(85.42) |
| 阿莫西林/克拉维酸 | 63( 52.07) | 19( 76.00) | 9( 34.62) | 58( 93.55) | 25( 64.10) | 7(13.73) | 4(18.18) | 11(32.35) | 4(12.90) | 8(16.67) |
| 氨苄西林/舒巴坦 | 81( 66.94) | 19( 76.00) | 15( 57.69) | 62( 100.00) | 27( 69.23) | 22(43.14) | 11(50.00) | 22(64.71) | 17(54.84) | 27(56.25) |
| 哌拉西林/他唑巴坦 | 59( 48.76) | 16( 64.00) | 3( 11.54) | 43( 69.35) | 25( 64.10) | 0 | 0 | 0 | 0 | 1( 2.08) |
| 甲氧苄啶-磺胺甲噁唑 | 77( 63.64) | 1( 4.00) | 9( 34.62) | 0 | 15( 38.46) | 15(29.41) | 8(36.36) | 17(50.00) | 16(51.61) | 20(41.67) |
| 左氧氟沙星 | 3( 2.48) | 0 | 0 | 11( 17.74) | 24( 61.54) | 5( 9.80) | 3(13.64) | 9(26.47) | 6(19.35) | 5(10.42) |
金黄色葡萄球菌对万古霉素敏感,对青霉素耐药率逐年上升,2016和2017年达100.00%,而2018年有所下降;对苯唑西林和阿莫西林/克拉维酸耐药率较低,均<30.00%;对克林霉素和红霉素耐药率各年变动较大;2015年未分离出对环丙沙星耐药的菌株,其余各年耐药率均<10.00%(表5)。
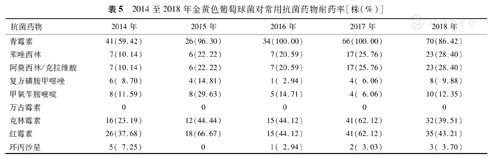
2014至2018年金黄色葡萄球菌对常用抗菌药物耐药率[株(%)]
2014至2018年金黄色葡萄球菌对常用抗菌药物耐药率[株(%)]
| 抗菌药物 | 2014年 | 2015年 | 2016年 | 2017年 | 2018年 |
|---|---|---|---|---|---|
| 青霉素 | 41(59.42) | 26(96.30) | 34(100.00) | 66(100.00) | 70(86.42) |
| 苯唑西林 | 7(10.14) | 6(22.22) | 7(20.59) | 17(25.76) | 23(28.40) |
| 阿莫西林/克拉维酸 | 7(10.14) | 6(22.22) | 7(20.59) | 17(25.76) | 23(28.40) |
| 复方磺胺甲噁唑 | 6( 8.70) | 4(14.81) | 1( 2.94) | 4( 6.06) | 8( 9.88) |
| 甲氧苄胺嘧啶 | 8(11.59) | 8(29.63) | 5(14.71) | 4( 6.06) | 10(12.35) |
| 万古霉素 | 0 | 0 | 0 | 0 | 0 |
| 克林霉素 | 16(23.19) | 12(44.44) | 15(44.12) | 41(62.12) | 32(39.51) |
| 红霉素 | 26(37.68) | 18(66.67) | 15(44.12) | 41(62.12) | 35(43.21) |
| 环丙沙星 | 5( 7.25) | 0 | 1( 2.94) | 2( 3.03) | 3( 3.70) |
2014至2018年共分离出多重耐药菌株284株(21.37%),其中产超广谱β-内酰胺酶(ESBLs)的肺炎克雷伯菌179株(13.47%)、产ESBLs的大肠埃希菌48株(3.61%)和耐甲氧西林金黄色葡萄球菌(MRSA)57株(4.29%)。
随着围产医学的不断发展,新生儿疾病也受到广泛重视。新生儿从宫内到宫外状态的急剧变化过程中,免疫力低下,易发生感染,院内感染亦不断增加,对新生儿健康和生命造成严重威胁[9,10,11],已成为国内外学者关注的热点。
母体疾病、分娩过程、有菌接触、机体状况以及侵入性操作等均可成为患儿院内感染的高危因素[12],分娩前、感染前使用抗菌药物或激素,新生儿内环境尚未形成稳定的有益菌群,过早、过量、不规律地使用抗菌药物等不仅会使菌群失调,引起内源性感染,也会增加病原体耐药性。本研究对2014至2018年新生儿感染标本来源分析发现,咽拭子、血液和气管导管尖端为主要的标本类型,表明呼吸道感染和血流感染是新生儿常见感染,与之前报道结果相符[3]。血液标本近年来分离菌逐渐增多,血流感染逐渐成为新生儿主要的感染。因此,呼吸机相关肺炎、导管相关血流感染仍是新生儿感染防控的重点。
2014至2018年细菌学分析结果提示,新生儿感染以革兰阴性菌感染为主,但革兰阳性菌有上升趋势。革兰阴性菌以肺炎克雷伯菌、大肠埃希菌和流感嗜血杆菌为主,革兰阳性菌以金黄色葡萄球菌、表皮葡萄球菌和溶血性葡萄球菌为主,与朱雯等[13]报道结果类似。2014、2016和2018年均出现耐碳青霉烯类肺炎克雷伯菌,头孢唑啉、头孢噻肟和头孢吡肟的耐药率均>50.00%,高于全国水平[14],应成为医院感染防控的重点。肺炎克雷伯菌是医院内常见的机会性致病菌,与多种感染相关,包括肺炎、血流感染、尿路感染等。而新生儿,尤其是早产儿,免疫功能不健全,部分需长时间使用有创呼吸机、深静脉置管等侵入性操作,同时广谱抗菌药物的使用等,导致多重耐药的肺炎克雷伯菌分离增加,已成为新生儿抗感染治疗的难题[15]。但2018年经院内感染防控和合理使用抗菌药物使肺炎克雷伯菌的感染及对部分抗菌药物的耐药率出现一定程度下降。产ESBLs肺炎克雷伯菌比例明显高于产ESBLs大肠埃希菌,但低于谭福燕等[16]报道的24.1%和李朝晖等[15]报道的39%,可能由于各个地区、各个医院用药习惯存在差异,细菌在不同抗菌药物选择性压力下生存状况不一致,从而导致耐药性不同。大肠埃希菌分离率2014至2017年相差不大,2018年最高(19.59%),可能与其母体水平传播存在相关,由于胎膜早破是新生儿感染的主要因素,而胎膜早破孕产妇胎膜培养主要的病原菌为大肠埃希菌,占59.7%[17]。然而新生儿感染分离的大肠埃希菌2018年开始出现对哌拉西林/他唑巴坦耐药,应引起临床重视,头孢噻肟耐药率均<40.00%,明显低于全国新生儿和儿童水平(均>50%)[15]。产ESBLs的大肠埃希菌分离率明显低于其他地区新生儿败血症中分离的大肠埃希菌[18]。
MRSA已成为影响新生儿重症监护病房早产儿和危重新生儿感染的主要原因,极低体质量出生儿、早产儿、多次妊娠、气管插管、经皮中心静脉导管、留院时间过长、袋鼠式护理等均为MRSA感染的危险因素[19]。近年来经过细菌耐药监测及合理使用抗菌药物,2018年金黄色葡萄球菌对青霉素、克林霉素和红霉素耐药率下降。2015年,金黄色葡萄球菌对环丙沙星敏感,而后耐药率出现上升趋势,可能与2015年分离的金黄色葡萄球菌主要来源于血液,而2016至2018年金黄色葡萄球菌主要来源于脐分泌物有关,脐部感染主要由于皮肤定植金黄色葡萄球菌引起,其耐药率更高。临床应积极主动开展MRSA筛查、去定植并进行预防隔离,减少不必要的置管引流,以减少MRSA定植和感染。
随着抗菌药物的广泛使用,病原菌的耐药率明显上升,不同地区、不同医院、不同科室耐药率存在差异。新生儿作为医院的特殊人群,受到多种因素影响而导致其为院内感染的高危人群,临床应高度重视其耐药性的变化,根据细菌耐药监测分析数据和微生物标本检测结果合理使用抗菌药物,指导临床诊疗。
所有作者均声明不存在利益冲突



























