
探讨慢性阻塞性肺疾病(COPD)合并侵袭性肺曲霉病(IPA)患者的临床特点、胸部CT影像学特征及其危险因素,为临床早期诊断和预防提供依据。
收集浙江大学医学院附属第一医院和浙江省人民医院2015年1月至2019年9月COPD合并IPA的90例患者作为病例组,并按1∶2配对原则,选取同年入院、性别一致、年龄±5岁的COPD未合并IPA的180例患者为对照组,对病例组和对照组患者的一般情况和临床资料进行回顾性分析,采用χ2检验比较两组患者的肺部影像学特征,采用多因素条件Logistic回归分析探讨COPD合并IPA的危险因素。
COPD合并IPA的90例患者中,下呼吸道标本培养出烟曲霉78例、黄曲霉6例、烟曲霉合并黄曲霉1例、土曲霉1例、黑曲霉1例;1例痰脱落细胞学找到曲霉菌丝,2例血清半乳甘露聚糖试验阳性。病例组患者胸部CT影像学表现为片状浸润影(87.8%)、胸腔积液(36.7%)、结节(33.3%)、空洞(18.9%)、实变影(17.8%)、晕轮征(14.4%)和空气新月征(2.2%),且片状浸润影、实变影、晕轮征以及空洞的发生率较对照组高(P <0.05或<0.01)。多因素条件Logistic回归分析显示,住院时间长( OR=1.183,95%CI 1.047~1.336)、两种抗菌药物联用(OR=5.391,95%CI 1.241~23.421)、抗菌药物使用时间≥14 d(OR=5.275,95%CI 1.586~17.541)、抗菌药物累计使用品种数多(OR=2.270,95%CI 1.406~3.664)是COPD合并IPA的危险因素(P<0.05或<0.01)。
若COPD患者存在住院时间较长、两种抗菌药物联合使用、抗菌药物治疗≥14 d、抗菌药物使用种类较多这些危险因素,应进行病原学、血清学检查和胸部CT动态监测,以便于临床早期诊断和预防IPA的发生。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
慢性阻塞性肺疾病(Chronic obstructive pulmonary disease, COPD)是一种以气流阻塞为特征的慢性支气管炎和/或肺气肿,可进一步发展为肺心病和呼吸衰竭的常见慢性疾病。大多数COPD患者需反复使用糖皮质激素和广谱抗菌药物来缓解支气管痉挛和全身炎症反应,导致侵袭性肺曲霉病(Invasive pulmonary aspergillosis,IPA)发生的概率增加[1]。Gao等[2]对COPD急性加重期患者的研究显示,这些患者发生IPA的概率约为1.91%(5/261)。COPD合并IPA患者早期临床表现和影像学特征缺乏特异性,容易误诊,病死率高。本研究对浙江大学医学院附属第一医院和浙江省人民医院90例COPD合并IPA患者的临床资料进行了回顾性分析,探讨其临床特征和危险因素,以帮助临床早期诊断和减少IPA的发生。
选取2015年1月至2019年9月浙江大学医学院附属第一医院和浙江省人民医院呼吸科、感染科以及重症监护病房(ICU)的住院患者中符合COPD合并IPA诊断标准的90例患者纳入病例组,其中男性72例,女性18例,年龄56~91岁,平均(74.9±8.4)岁。对照组以同年入院、性别一致、年龄±5岁为配对因素,按1∶2比例随机抽取COPD未合并IPA的患者180例。病例组和对照组COPD患者均处于急性加重期。所有患者均签署知情同意书,该研究符合《赫尔辛基宣言》。
COPD诊断根据《慢性阻塞性肺疾病诊治指南(2013年修订版)》[3],吸入支气管扩张剂以后,第一秒用力呼气容积(FEV1)占用力肺活量(FVC)百分比<70%,同时有慢性咳嗽、咳痰以及持续性加重的呼吸困难的症状和体征。
IPA分级诊断标准参照欧洲癌症研究和治疗组织/侵袭性真菌感染协作组织、美国国立变态反应和感染病研究院真菌病研究组(EORTC/MSG)共同制定的《侵袭性真菌病修改定义》[4]的专家共识和2016年美国感染病学会的临床实践指南《曲霉病的诊断和管理(更新版)》[5],主要由宿主因素、临床特征、微生物学证据和组织病理学四部分组成。(1)确诊:在患者肺病变组织穿刺活检标本中检出曲霉菌丝;同时存在曲霉感染的宿主因素和临床特征;以及出现下呼吸道标本曲霉培养阳性、标本直接镜检发现曲霉菌丝或血清半乳甘露聚糖(GM)试验阳性。(2)临床诊断:无肺部曲霉感染的病理学证据,但存在曲霉感染的宿主因素,出现影像学表现进行性加重或特征性影像学证据,并伴有下呼吸道标本曲霉培养阳性、显微镜检查出曲霉菌丝、GM试验连续2次阳性中的任何一条。
(1)合并肺结核、肺栓塞等疾病患者;(2)合并严重心、肝、肾功能异常者;(3)既往已存在自身免疫性疾病或其他原因免疫缺陷者;(4)器官移植后或其他原因需使用免疫抑制剂患者。
对病例组和对照组患者的临床资料进行回顾性分析,包括:(1)一般情况:入院日期、性别、年龄、COPD病史、吸烟史、住院时间、临床症状和体征;(2)实验室检查:包括血红蛋白计数、白蛋白计数、血氧饱和度以及微生物检查,成年男性血红蛋白<120 g/L、成年女性(非妊娠)血红蛋白<110 g/L诊断为贫血;血清白蛋白<30 g/L诊断为低白蛋白血症;(3)胸部影像学检查;(4)诊疗措施:入住ICU的情况,侵入性操作(气管插管或气管切开),糖皮质激素以及抗菌药物的使用情况等。
采用SPSS 23.0软件进行数据处理,偏态分布的计量资料用中位数(M)和上下四分位数间距(Q25,Q75)表示,采用秩和检验。计数资料以例(百分比)表示,采用χ2检验和Fisher精确概率检验。危险因素采用多因素条件Logistic回归分析,计算相应的比值比(OR)与95%可信区间(CI),以P<0.05为差异具有统计学意义。
病例组90例患者中,1例肺组织穿刺病理学检出曲霉菌丝确诊为IPA,其微生物培养为烟曲霉,其余89例均为临床诊断。90例患者中,下呼吸道标本培养出烟曲霉78例、黄曲霉6例、烟曲霉合并黄曲霉1例、土曲霉1例、黑曲霉1例;1例痰脱落细胞学找到曲霉菌丝;2例血清GM试验阳性。病例组中15例患者检出曲霉合并细菌感染,其中鲍曼不动杆菌5例、肺炎克雷伯菌3例、嗜麦芽窄食单胞菌3例、金黄色葡萄球菌2例和铜绿假单胞菌2例。对照组180例患者中,20例合并细菌感染,其中铜绿假单胞菌10例、肺炎克雷伯菌4例、鲍曼不动杆菌2例、嗜麦芽窄食单胞菌1例、金黄色葡萄球菌1例、洋葱伯克霍尔德菌1例和弗式柠檬酸杆菌1例。
病例组90例患者均出现咳嗽、咳痰,气促83例(92.2%),发热54例(60.0%),胸痛4例(4.4%);对照组180例患者均出现咳嗽、咳痰,气促170例(94.4%),发热46例(25.6%),胸痛3例(1.7%),两组在咳嗽、咳痰、气促和胸痛上差异均无统计学意义(P>0.05),病例组发热患者比例增加(χ2=12.172,P<0.01)。胸部CT影像学表现显示,病例组片状浸润影、实变影、晕轮征以及空洞发生率较对照组高(P<0.05或P<0.01)(表1)。
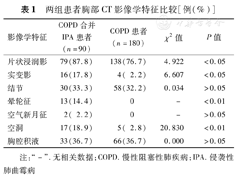
两组患者胸部CT影像学特征比较[例(%)]
两组患者胸部CT影像学特征比较[例(%)]
| 影像学特征 | COPD合并IPA患者(n=90) | COPD患者(n=180) | χ2值 | P值 |
|---|---|---|---|---|
| 片状浸润影 | 79(87.8) | 138(76.7) | 4.922 | <0.05 |
| 实变影 | 16(17.8) | 4( 2.2) | 6.607 | <0.05 |
| 结节 | 30(33.3) | 58(32.2) | 0.034 | >0.05 |
| 晕轮征 | 13(14.4) | 0 | - | <0.01 |
| 空气新月征 | 2( 2.2) | 0 | - | >0.05 |
| 空洞 | 17(18.9) | 5( 2.8) | 20.830 | <0.01 |
| 胸腔积液 | 33(36.7) | 66(36.7) | 0.000 | >0.05 |
注:"-".无相关数据;COPD.慢性阻塞性肺疾病;IPA.侵袭性肺曲霉病
两组患者在COPD病程≥10年、吸烟史、贫血、合并基础疾病、肺功能分级GOLD 3/4级、既往曲霉感染史、COPD合并细菌感染、氧饱和度上比较差异均无统计学意义(P>0.05)。和对照组相比,病例组低白蛋白血症、住院时间、入住ICU、抗菌药物使用≥14 d、两种抗菌药物联用、抗菌药物累计使用品种数多、糖皮质激素使用总剂量>700 mg、有创机械通气患者的比例均高于对照组,差异具有统计学意义(P<0.05或<0.01)(表2)。
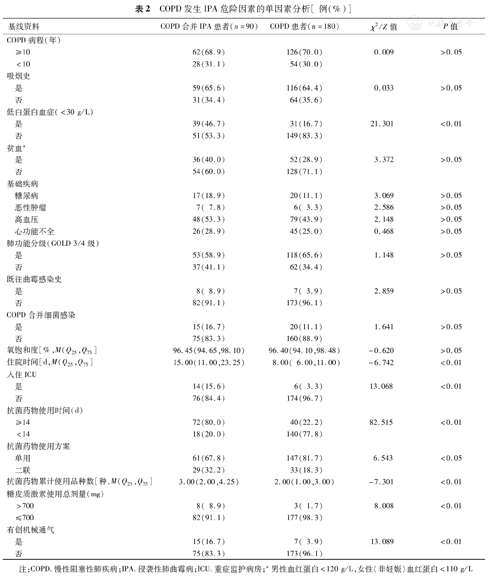
COPD发生IPA危险因素的单因素分析[例(%)]
COPD发生IPA危险因素的单因素分析[例(%)]
| 基线资料 | COPD合并IPA患者(n=90) | COPD患者(n=180) | χ2 /Z值 | P值 | |
|---|---|---|---|---|---|
| COPD病程(年) | |||||
| ≥10 | 62(68.9) | 126(70.0) | 0.009 | >0.05 | |
| <10 | 28(31.1) | 54(30.0) | |||
| 吸烟史 | |||||
| 是 | 59(65.6) | 116(64.4) | 0.033 | >0.05 | |
| 否 | 31(34.4) | 64(35.6) | |||
| 低白蛋白血症(<30 g/L) | |||||
| 是 | 39(46.7) | 31(16.7) | 21.301 | <0.01 | |
| 否 | 51(53.3) | 149(83.3) | |||
| 贫血a | |||||
| 是 | 36(40.0) | 52(28.9) | 3.372 | >0.05 | |
| 否 | 54(60.0) | 128(71.1) | |||
| 基础疾病 | |||||
| 糖尿病 | 17(18.9) | 20(11.1) | 3.069 | >0.05 | |
| 恶性肿瘤 | 7( 7.8) | 6( 3.3) | 2.586 | >0.05 | |
| 高血压 | 48(53.3) | 79(43.9) | 2.148 | >0.05 | |
| 心功能不全 | 26(28.9) | 45(25.0) | 0.468 | >0.05 | |
| 肺功能分级(GOLD 3/4级) | |||||
| 是 | 53(58.9) | 118(65.6) | 1.148 | >0.05 | |
| 否 | 37(41.1) | 62(34.4) | |||
| 既往曲霉感染史 | |||||
| 是 | 8( 8.9) | 7( 3.9) | 2.859 | >0.05 | |
| 否 | 82(91.1) | 173(96.1) | |||
| COPD合并细菌感染 | |||||
| 是 | 15(16.7) | 20(11.1) | 1.641 | >0.05 | |
| 否 | 75(83.3) | 160(88.9) | |||
| 氧饱和度[%,M(Q25,Q75] | 96.45(94.65,98.10) | 96.40(94.10,98.48) | -0.620 | >0.05 | |
| 住院时间[d,M(Q25,Q75] | 15.00(11.00,23.25) | 8.00( 6.00,11.00) | -6.742 | <0.01 | |
| 入住ICU | |||||
| 是 | 14(15.6) | 6( 3.3) | 13.068 | <0.01 | |
| 否 | 76(84.4) | 174(96.7) | |||
| 抗菌药物使用时间(d) | |||||
| ≥14 | 72(80.0) | 40(22.2) | 82.515 | <0.01 | |
| <14 | 18(20.0) | 140(77.8) | |||
| 抗菌药物使用方案 | |||||
| 单用 | 61(67.8) | 147(81.7) | 6.543 | <0.05 | |
| 二联 | 29(32.2) | 33(18.3) | |||
| 抗菌药物累计使用品种数[种,M(Q25,Q75] | 3.00(2.00,4.25) | 2.00(1.00,3.00) | -7.301 | <0.01 | |
| 糖皮质激素使用总剂量(mg) | |||||
| >700 | 8( 8.9) | 3( 1.7) | 8.008 | <0.01 | |
| ≤700 | 82(91.1) | 177(98.3) | |||
| 有创机械通气 | |||||
| 是 | 15(16.7) | 7( 3.9) | 13.089 | <0.01 | |
| 否 | 75(83.3) | 173(96.1) | |||
注:COPD.慢性阻塞性肺疾病;IPA.侵袭性肺曲霉病;ICU.重症监护病房;a男性血红蛋白<120 g/L,女性(非妊娠)血红蛋白<110 g/L
将两组患者单因素分析中差异有统计学意义的变量进行多因素条件Logistic回归分析发现,住院时间长、两种抗菌药物联用、抗菌药物使用时间≥14 d、抗菌药物累计使用品种多是COPD合并IPA的独立危险因素(P<0.05或<0.01)(表3)。
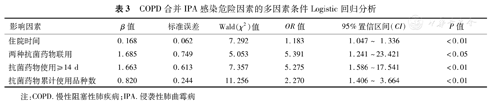
COPD合并IPA感染危险因素的多因素条件Logistic回归分析
COPD合并IPA感染危险因素的多因素条件Logistic回归分析
| 影响因素 | β值 | 标准误差 | Wald(χ2)值 | OR值 | 95%置信区间(CI) | P值 |
|---|---|---|---|---|---|---|
| 住院时间 | 0.168 | 0.062 | 7.292 | 1.183 | 1.047~ 1.336 | <0.01 |
| 两种抗菌药物联用 | 1.685 | 0.749 | 5.053 | 5.391 | 1.241~23.421 | <0.05 |
| 抗菌药物使用≥14 d | 1.663 | 0.613 | 7.357 | 5.275 | 1.586~17.541 | <0.01 |
| 抗菌药物累计使用品种数 | 0.820 | 0.244 | 11.256 | 2.270 | 1.406~ 3.664 | <0.01 |
注:COPD.慢性阻塞性肺疾病;IPA.侵袭性肺曲霉病
IPA是曲霉侵入气管、支气管以及肺部,引起气道黏膜炎症和肺部炎症肉芽肿的真菌感染性疾病,严重者可引起肺组织坏死,病死率较高。有研究表明,全球约1%~2%的COPD患者死于IPA[6],COPD合并IPA大部分患者因高龄、肺功能差不能耐受支气管镜检查及肺活检,导致该病确诊困难,并容易漏诊及延误治疗。因此,了解COPD合并IPA的危险因素,早期识别高危患者并进行干预显得很重要。
据文献报道,IPA患者典型的影像学特征为:(1)结节及其周围晕轮征;(2)空洞和空气半月征;(3)楔形实变[7]。本研究发现COPD合并IPA患者的胸部CT影像学表现多为片状浸润影、胸腔积液、结节、空洞、实变影、晕轮征和空气新月征,与有关文献报道较为相似[8],但影像学上空气新月征的发生率明显低于该报道,这可能与患者基础疾病、机体免疫反应以及CT检查时机不同有关。
有研究发现[9],低白蛋白血症是COPD患者发生IPA的危险因素,当患者出现低白蛋白血症时,机体免疫力下降,正常定植在人体口咽部的真菌就有机会侵袭至身体其他部位引起感染。Guinea等[10]研究还发现入院前3个月泼尼松累计使用>700 mg、入住ICU是COPD合并IPA的独立危险因素。COPD患者大剂量使用糖皮质激素(>700 mg),削弱了细胞的吞噬功能,降低了机体防御能力,因而更容易发生IPA。而入住ICU的患者由于长时间滥用广谱抗菌药物,使得病原菌耐药加重,微生态平衡被破坏,进而增加了曲霉感染的风险。此外,有研究显示[11],机械通气时间≥5 d是COPD合并IPA的危险因素,有创机械通气破坏了人体完整的正常生理屏障,使得曲霉更容易侵入机体并进行繁殖。本研究单因素分析发现这些因素与COPD患者发生IPA有关,但多因素分析却未发现是其发生IPA的危险因素。进一步分析发现,相关研究[9]中纳入了长期使用糖皮质激素以及使用激素≥14 d作为危险因素进行分析,但并未统计糖皮质激素使用总剂量的影响;而Guinea等[10]的研究中虽统计了累计激素使用总剂量,但与本研究统计的使用激素时间不同。此外,相关研究[11]中统计了有创机械通气时间≥5 d的影响,而本研究只纳入了有创机械通气这一因素但未分析通气时间长短。由于本研究收集的样本量有限,也可能会对结果产生一定的影响,需要扩大样本量进行研究证实,以更全面分析COPD合并IPA的危险因素。
本研究多因素分析显示,长期住院是COPD合并IPA的独立危险因素(OR=1.183),住院时间越长,IPA感染率越高。COPD大部分患者年龄都较大,机体免疫力下降,长期住院易发生机会性致病真菌感染。而且长期住院的患者在治疗上使用了更多的抗菌药物和激素,发生IPA的风险亦增加。因此,缩短患者住院时间在一定程度上对减少IPA的发生有积极意义。此外,抗菌药物联用(OR=5.391)、抗菌药物使用时间≥14 d(OR=5.275)以及抗菌药物累计使用品种数多(OR=2.270)是COPD合并IPA的独立危险因素。杜俊凤等[12]研究显示,抗菌药物使用时间≥14 d是COPD并发IPA的危险因素,本研究与该报道一致。此外,还有一些研究发现,COPD患者在住院治疗之前使用广谱抗菌药物易发生IPA,使用3种及以上抗菌药物为COPD患者合并IPA的另一个危险因素[13,14]。COPD患者大多数病程反复,住院时需长期使用高效广谱抗菌药物,抗菌药物使用疗程长、联合用药、品种多、更换频繁,使得正常菌群受到抑制,导致大量定植真菌繁殖并侵袭感染。因此,对COPD患者应尽早采集标本送检,根据药敏试验结果选择窄谱抗菌药物,尽量缩短抗菌药物使用时间,以及选择单一足量的抗菌药物,以减少IPA的发生。
综上所述,IPA起病隐匿,临床表现缺乏特异性,易被COPD急性期症状所掩盖而漏诊,确诊困难。COPD患者若经过抗菌药物治疗后,病情短时间内加重,如果存在以上危险因素,结合CT出现晕轮征、新月征或实变病灶内空洞形成等特征性影像学证据,需警惕IPA的发生,应留取相关标本进行微生物学检查、GM试验以及组织病理学检查,同时尽快给予经验性抗曲霉菌治疗。
所有作者均声明不存在利益冲突



























