
通过体外药物代谢动力学(PK)/药物效应动力学(PD)研究,比较国产和原研替加环素对细菌的抗菌与杀菌效果。
利用体外PK自动模拟系统PASS400模拟不同剂量替加环素给药方案(100 mg,1次/d;50 mg,12 h/d;100 mg,12 h/d),观察国产与原研替加环素对大肠埃希菌标准株(ATCC25922)、耐碳青霉烯类肺炎克雷伯菌标准株(ATCC BAA-1706)和多重耐药鲍曼不动杆菌临床菌株(AB-16703)时间杀菌曲线以及相关PD参数。应用GraphPad Prism 7统计软件对数据进行分析。
在模拟不同给药剂量PK条件下,国产与原研替加环素具有相似的抗菌效果,但均表现较弱的抗菌效果。两者的时间杀菌曲线几乎重叠,最大杀菌量均<2 log,在24 h内,细菌都恢复生长到细菌的生长平台期。在PD参数比较中,原研与国产替加环素(100 mg,1次/12 h)对大肠埃希菌ATCC25922最大杀菌量分别为(-1.101±0.147)lg CFU/mL和(-1.105±0.208)lg CFU/mL;对肺炎克雷伯菌ATCC BAA-1706最大杀菌量分别为(-1.999±0.187)lg CFU/mL和(-1.865±0.066)lg CFU/mL;对鲍曼不动杆菌AB-16703最大杀菌量分别为(-0.240±0.209)lg CFU/mL和(-0.230±0.187)lg CFU/mL。不同给药方案下,两种药物对三种菌的最大杀菌量、细菌再生至初始菌量时间、24 h杀菌量和杀菌与恢复生长曲线与空白对照曲线面积差比较,差异均无统计学意义(P>0.05)。
替加环素在体外模拟人体药物代谢过程条件下不能表现出良好的抗菌活性;原研与国产替加环素体外PK/PD效果相似。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
替加环素是第一个甘氨酰四环素类抗生素,具有超广谱抗菌活性,对包括革兰阳性和革兰阴性需氧菌及厌氧菌等临床分离的致病菌具有抗菌作用,包括对各种多重耐药菌具有抗菌效果,如甲氧西林耐药金黄色葡萄球菌、碳青霉烯类耐药肠杆菌和鲍曼不动杆菌等。美国于2005年批准替加环素用于治疗复杂的腹腔内感染,复杂的皮肤和皮肤结构感染,并于2008年批准用于治疗社区获得性肺炎[1,2]。随着临床日益严重的多重耐药菌感染,替加环素常用于治疗多重耐药菌感染,如医院获得性肺炎、血流感染等[3,4,5]。原研替加环素(商品名:泰阁,辉瑞公司生产)在我国于2011年批准上市,其后有多种国内仿制药品获批上市。
与原研药品相比较,仿制药物具有价格低廉的优势。按照我国药政管理部门要求,仿制药和原研药需要具有药品质量、临床效果和安全性的一致性,开展药品一致性评价已经成为仿制药品注册的基本要求[6]。作为仿制抗菌药物,在一致性评价中除药效和药品质量比较外,对其体外抗菌活性和杀菌特征进行比较也十分必要,特别是通过药物代谢动力学(PK)/药物效应动力学(PD)研究,比较二者的杀菌行为与杀菌效果,能更加准确地评价仿制药物与原研产品的异同,为临床药物选择提供依据。
我们前期已经开展国产替加环素(商品名:泽坦,江苏豪森药业股份有限公司产品)和原研替加环素(泰阁)的体外抗菌活性比较,结果显示两者具有类似的抗菌效果[7]。为了进一步评估基于药物代谢过程的杀菌效果,本研究借助体外抗菌药物PK/PD模型,评估两种药物在模拟人体内药物浓度动态变化情况下对目标细菌的抗菌效果,特别是对多重耐药菌的抗菌效果,以明确两者是否具有药物一致性,为临床药物选择提供依据。
原研替加环素(泰阁,Wyeth Parenterals Division of Wyeth Holding Corporation,临床用品,效期至2019年6月);国产替加环素(泽坦,江苏豪森药业集团生产,批号170604,效期至2019年5月)均为市场销售产品。Mueller-Hinton肉汤(MHB)购于英国OXOID公司;Mueller-Hinton琼脂(MHA)购于英国OXOID公司。替加环素标准品购自大连美伦药品有限公司(批号D0901AS,纯度>99%)。
大肠埃希菌标准菌株ATCC25922,耐碳青霉烯类肺炎克雷伯菌标准菌株ATCC BAA-1706,临床分离血流感染多重耐药鲍曼不动杆菌AB-16703为本实验室保存菌株。
参照美国实验室标准化协会(CLSI)推荐方法[8],应用微量肉汤稀释法测定替加环素对3株细菌的MIC值。
从2018年9月至2019年7月利用体外PK自动模拟系统PASS400(Dainippon seiki)模拟人体替加环素PK过程。该仪器由控制系统、中央室、储液室、废液室组成,由灭菌的三通管路和注射泵相互连接,形成一个密闭体系。中央室是一个500 mL的贮液瓶,利用持续的磁力搅拌器使整个体系性质均一。在实验过程中,中央室一直处于37℃的恒温水浴中。通过控制系统模拟药物在人体代谢过程,将事先配好的药液以恒定速度在0.5 h内泵入中央室,之后以不同的消除速度将培养基泵出中央室,再以相同速度将新鲜的基质(无菌MHB)通过注射泵泵入中央室,确保实验过程中央室体积恒定,模拟出不同给药剂量后的药物浓度时间曲线。
细菌接种到中央室(初始浓度在106 CFU/mL)后,在预定时间点(0、1、2、4、6、8、10、12、24 h)收集1.5 mL样品,在接种前用0.9%生理盐水稀释,利用螺旋涂布仪将稀释菌液接种到MHA平板,37℃下孵育18 h后进行计数。每种给药方案重复模拟3次,各时间点细菌量取平均值。
参考文献报道的健康人替加环素静脉注射给药后的PK参数,模拟体内药物代谢过程(表1)[2,9]。在本次实验中,共设计了三个给药方案:100 mg,1次/d;50 mg,1次/12 h;100 mg,1次/12 h。
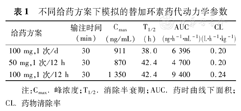
不同给药方案下模拟的替加环素药代动力学参数
不同给药方案下模拟的替加环素药代动力学参数
| 给药方案 | 输注时间(min) | Cmax(ng/mL) | T1/2(h) | AUC(ng·h-1·mL-1) | CL(L·h-1·kg-1) |
|---|---|---|---|---|---|
| 100 mg,1次/d | 30 | 911 | 38.0 | 6 396 | 0.20 |
| 50 mg,1次/12 h | 30 | 870 | 42.4 | 4 700 | 0.20 |
| 100 mg,1次/12 h | 30 | 1 350 | 42.4 | 9 400 | 0.24 |
注:Cmax.峰浓度;T1/2.消除半衰期;AUC.药时曲线下面积;CL.药物清除率
依据不同时间点的菌落计数获得杀菌效果曲线,计算PD参数,包括:最大杀菌量(Maximum kill down,MKD)、再生至初始菌量时间(Bacterial growth recovery time,RT)、下降1 log、2 log和3 log细菌量的持续时间(T90%、T99%、T99.9%)、24 h杀菌量(ΔlogN24)、药物杀菌曲线与细菌生长空白对照曲线面积差(IE)(图1)。其中IE用作积分参数评估抗菌作用。IE是使用GraphPad Prism 6程序通过梯形法积分计算。这些PD参数中,RT和IE被认为目前反应抗菌药物药效的主要指标,尤其是IE,能更为全面、无偏倚地评估各个抗菌药物不同给药方案下的治疗效果[10]。
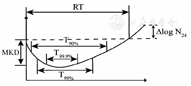

注:MKD.最大杀菌量;RT.再生至初始菌量时间;ΔlogN24. 24 h杀菌量;T90%.下降1 log菌量所需时间;T99%.下降2 log菌量所需时间;T99.9%.下降3 log菌量所需时间
应用GraphPad Prism 7统计软件对数据进行分析。计量资料以 ±s表示,采用独立样本t检验,P<0.05为差异具有统计学意义。
±s表示,采用独立样本t检验,P<0.05为差异具有统计学意义。
替加环素标准品对三株细菌的MIC分别为:大肠杆菌ATCC25922 0.06 μg/mL,耐碳青霉烯肺炎克雷伯菌ATCC BAA 1706为0.50 μg/mL,临床分离血流感染菌株多重耐药鲍曼不动杆菌AB-16703为1.00 μg/mL。
原研与国产替加环素的药物杀菌曲线接近。不同给药方案对三株细菌均无法取得理想的杀菌效果,最终细菌都恢复生长到空白对照组。从模型中看出,两种药物对大肠埃希菌ATCC25922与耐碳青霉烯肺炎克雷伯菌ATCC BAA-1706在初始时可使细菌浓度下降(1~2)log,然而在24 h内细菌仍然到达了生长平台期。而对于多重耐药鲍曼不动杆菌AB-16703,模型中细菌浓度无下降(图2,图3,图4)。
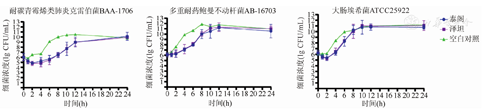

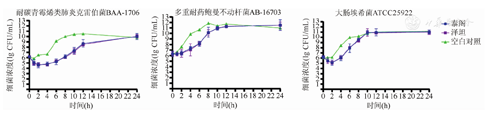

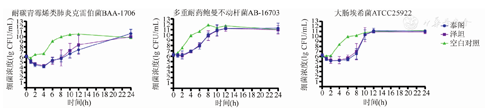

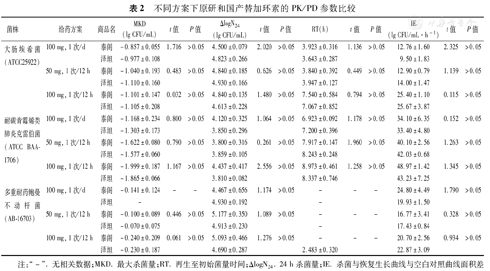
针对耐碳青霉烯类肺炎克雷伯菌ATCC BAA-1706,两种药物的MKD比较,差异无统计学意义(P>0.05),其中100 mg,1次/d的方案抗菌效果较弱,弱于50 mg,1次/12 h方案和100 mg,1次/12 h方案。各方案的IE值比较,差异无统计学意义。对于大肠埃希菌ATCC25922,两种药物的PD参数比较,差异也均无统计学意义,但100 mg,1次/12 h的给药方案,尽管在MKD上与其他两种方案相差不大,但RT长于另外两种方案。对多重耐药的鲍曼不动杆菌AB-16703,两种药物均未显示有明显的杀菌效果,在100 mg,1次/12 h的方案中,原研与国产替加环素的MKD仅为(-0.240±0.209)lg CFU/mL和(-0.230±0.187)lg CFU/mL,差异无统计学意义(P>0.05)。不同给药方案,两种药物的MKD、ΔlogN24、RT和IE比较,差异均无统计学意义(P>0.05)(表2)。
不同方案下原研和国产替加环素的PK/PD参数比较
不同方案下原研和国产替加环素的PK/PD参数比较
| 菌株 | 给药方案 | 商品名 | MKD(lg CFU/mL) | t值 | P值 | ΔlogN24(lg CFU/mL) | t值 | P值 | RT(h) | t值 | P值 | IE(lg CFU/mL·h-1) | t值 | P值 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 大肠埃希菌(ATCC25922) | 100 mg, 1次/d | 泰阁 | -0.857±0.055 | 1.716 | >0.05 | 4.500±0.079 | 2.020 | >0.05 | 3.923±0.316 | 1.136 | >0.05 | 12.76±1.60 | 2.325 | >0.05 |
| 泽坦 | -0.977±0.108 | 4.823±0.266 | 3.643±0.287 | 9.50±1.83 | ||||||||||
| 50 mg, 1次/12 h | 泰阁 | -1.040±0.193 | 0.483 | >0.05 | 4.840±0.185 | 0.626 | >0.05 | 3.840±0.392 | 0.449 | >0.05 | 12.90±0.79 | 1.139 | >0.05 | |
| 泽坦 | -1.110±0.160 | 4.930±0.166 | 3.947±0.127 | 14.00±1.47 | ||||||||||
| 100 mg, 1次/12 h | 泰阁 | -1.101±0.147 | 0.032 | >0.05 | 4.840±0.135 | 1.480 | >0.05 | 7.540±0.584 | 0.794 | >0.05 | 25.40±1.10 | 0.115 | >0.05 | |
| 泽坦 | -1.105±0.208 | 4.613±0.228 | 7.067±0.852 | 25.67±3.87 | ||||||||||
| 耐碳青霉烯类肺炎克雷伯菌(ATCC BAA-1706) | 100 mg, 1次/d | 泰阁 | -1.168±0.234 | 0.800 | >0.05 | 4.120±0.325 | 1.064 | >0.05 | 6.923±0.092 | 1.178 | >0.05 | 34.10±6.35 | 0.152 | >0.05 |
| 泽坦 | -1.303±0.173 | 3.850±0.296 | 7.200±0.396 | 33.40±4.80 | ||||||||||
| 50 mg, 1次/12 h | 泰阁 | -1.622±0.080 | 0.790 | >0.05 | 3.800±0.316 | 0.261 | >0.05 | 7.917±0.147 | 1.960 | >0.05 | 40.10±2.56 | 1.263 | >0.05 | |
| 泽坦 | -1.577±0.060 | 3.859±0.105 | 8.243±0.248 | 42.03±0.68 | ||||||||||
| 100 mg, 1次/12 h | 泰阁 | -1.999±0.187 | 1.167 | >0.05 | 4.437±0.417 | 2.556 | >0.05 | 8.973±0.461 | 1.258 | >0.05 | 48.97±1.42 | 1.345 | >0.05 | |
| 泽坦 | -1.865±0.066 | 3.810±0.082 | 8.337±0.746 | 43.23±7.25 | ||||||||||
| 多重耐药鲍曼不动杆菌(AB-16703) | 100 mg, 1次/d | 泰阁 | -0.141±0.124 | - | - | 4.467±0.656 | 1.174 | >0.05 | - | - | - | 24.80±4.49 | 1.790 | >0.05 |
| 泽坦 | - | 4.930±0.192 | - | 19.93±1.50 | ||||||||||
| 50 mg, 1次/12 h | 泰阁 | -0.100±0.089 | 0.446 | >0.05 | 5.177±0.350 | 1.089 | >0.05 | - | - | - | 16.77±3.41 | 0.328 | >0.05 | |
| 泽坦 | -0.070±0.075 | 4.913±0.230 | - | 17.43±0.84 | ||||||||||
| 100 mg, 1次/12 h | 泰阁 | -0.240±0.209 | 0.061 | >0.05 | 5.093±0.466 | 1.276 | >0.05 | - | - | - | 20.70±2.56 | 0.934 | >0.05 | |
| 泽坦 | -0.230±0.187 | 4.690±0.287 | 2.483±0.320 | 22.87±3.09 |
注:"-".无相关数据;MKD.最大杀菌量;RT.再生至初始菌量时间;ΔlogN24. 24 h杀菌量;IE.杀菌与恢复生长曲线与空白对照曲线面积差
仿制药由于其价格便宜、易于研发的特点,能够减少患者的医药费用,对我国这样人口基数巨大的国家在缓解社会药物费用负担,以及降低药物供应压力方面显得格外重要。然而,据文献报道[11],在日本有17.2%的医师和37.2%的患者不愿意使用仿制药,其原因在于担心仿制药的安全性及药效与原研药之间的差距。日本曾对仿制药品进行调查研究分析[11],发现仿制的万古霉素和替考拉宁的抗菌疗效较原研药分别降低了14.6%和17.3%。2015年国务院印发的《关于改革药品医疗器械审评审批制度的意见》[12],将"提高仿制药质量,加快仿制药质量一致性评价"作为改革药品审评审批制度的五大目标之一。因此,进行仿制药的一致性评价显得尤为重要,有助于明确国产药品与原研药质量和疗效上的差别,确认具有相同效果仿制药供临床选用。替加环素为临床治疗多重耐药菌感染的药物之一,原研药物价格较高,开展原研与仿制替加环素对照研究具有重要价值。
按照药物管理部门要求,对药品注射制剂一致性评价主要考察相关药学参数,包括药品质量与稳定性等。抗菌药物有别于其他药物,其通过抗菌作用发挥治疗效果,并非药物直接与人体发生相互作用。有鉴于此,通过比较原研与国产药物的抗菌效果,更能反映两者异同,如体外MIC测定、动物感染模型及临床研究的比较。本研究所使用的体外PK/PD模拟,弥补了单纯体外抗菌活性测定的不足,能够模拟抗菌药物在人体内的PK过程及其动态杀菌效果,用该方法研究抗菌药物对病原菌的效果比常规的测定病原菌的MIC及进行静态杀菌试验更符合药物在体内的情况。同时,相比动物研究也具有一定的优点,操作简便,可重复性好[13]。
本研究发现替加环素主要体现为抑菌效果,无法彻底清除模拟体系中的细菌。原研与国产替加环素的PK/PD时间杀菌曲线无较大差距,两者几乎重叠,在PD参数比较上同样无统计学意义。结合本课题组之前发表的研究,国产替加环素与泰阁对临床上常规分离的病原菌的敏感性几乎相同。国产替加环素在一定情况下可以替代泰阁进行抗感染治疗。另外,蒋明彦等[14]在2016年报道的非对照临床病例回顾性研究显示,在应用国产替加环素后对泛耐药鲍曼不动杆菌引起的肺炎的临床症状及炎症指标得到改善,病原菌清除率达61.9%,不良反应发生率低。针对国内巨大的仿制药市场,需要更多的研究来填补相关仿制药物在治疗上的优劣。
尽管体外多数细菌对替加环素保持着较高的敏感性,但在体内的抗菌疗效并不确切,尤其是在血流感染等重症感染中,效果上不确定,可能与其特有的PK参数有关,即组织分布广,血药浓度低。本研究发现替加环素即使对于敏感的大肠埃希菌ATCC25922也难以取得理想的杀菌效果。这可能与替加环素为抑菌剂,杀菌作用需要体内免疫系统清除作用相关。类似的结果同样出现在蔡学究[9]进行的针对多重耐药鲍曼不动杆菌的体外PD模型中,替加环素标准剂量50 mg,1次/12 h与高剂量100 mg,1次/12 h单用对MIC为0.125 mg/L、0.5 mg/L的菌株几乎没有显示出抗菌活性。因此,有必要开展替加环素治疗多重耐药菌感染的临床研究,确定有效的给药方式与隔离药剂量,应避免替加环素单药的应用。国内《广泛耐药革兰阴性菌感染的实验诊断、抗菌治疗及医院感染控制:中国专家共识》[15]指出:对于泛耐药细菌,尽量根据药敏结果选择敏感抗菌药物或选择呈中介或接近中介敏感或有较小抑菌圈的抗菌药物,大剂量联合治疗,推荐替加环素可与头孢哌酮舒巴坦钠、碳青霉烯类、氨基糖苷类、多粘菌素等药物联合应用,加强彼此的协同杀菌作用,但实际情况尚待考察。
本研究作为体外PK/PD研究存在着不足之处,目前没有相关文献报道泽坦在人体内的PK参数,因此泽坦的参数同样来源于泰阁,如能参考各自PK参数进行研究更能体现两者异同;对于替加环素这类抑菌剂,单纯体外PK/PD模拟,缺乏机体免疫系统参与,无法确认其对感染的治疗效果,有必要进行动物和人体PK/PD研究加以确认。
综上所述,国产仿制替加环素(泽坦)与原研替加环素(泰阁)在PD特性上具有相似性,泽坦的抗菌疗效并不弱于泰阁,两者在临床上可能取得相似治疗效果,但对重症感染治疗效果需要进一步研究,同时应避免替加环素单独使用。
所有作者均声明不存在利益冲突



























