
评估Xpert MTB/RIF、荧光PCR熔解曲线和基因芯片技术用于快速筛查利福平耐药结核病的临床价值。
收集2016年9月3日至2019年8月11日在浙江省中西医结合医院收治的经Bactec MGIT 960液体培养药敏确诊为结核病,且具有Xpert MTB/RIF和基因芯片技术结果的150例患者临床资料,对所有患者分离培养菌株行荧光PCR熔解曲线检测。以Bactec MGIT 960液体培养药敏结果为金标准,分析Xpert MTB/RIF、荧光PCR熔解曲线和基因芯片技术对利福平耐药结核病的诊断效能。绘制受试者工作曲线(ROC)评估三种方法在利福平耐药结核病诊断中的价值。
以Bactec MGIT 960药敏结果为金标准,Xpert MTB/RIF、荧光PCR熔解曲线和基因芯片技术检测利福平耐药的敏感度分别为88.89%(16/18)、94.44%(17/18)、88.89%(16/18),特异度分别为96.21%(127/132)、96.21%(127/132)、95.45%(126/132)。三种检测方法的敏感度和特异度比较,差异均无统计学意义(P>0.05)。三种分子方法检测利福平耐药与Bactec MGIT 960药敏结果的一致性Kappa值分别为0.794、0.827、0.770。ROC曲线分析显示,Xpert MTB/RIF、荧光PCR熔解曲线和基因芯片技术的ROC曲线下面积分别为0.926、0.953、0.922。三种检测方法对利福平耐药均具有较好的诊断价值(P<0.01),但三种方法比较,差异均无统计学意义(P>0.05)。三种方法检测利福平耐药与Bactec MGIT 960药敏不一致结果共8例。
Xpert MTB/RIF、荧光PCR熔解曲线和基因芯片技术三种分子方法对利福平耐药性检测能力相当,均具有较高的敏感度和特异度,适合快速筛查利福平耐药结核病。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
结核病是危害人类健康的重大传染病之一。利福平是治疗结核最重要的一线药物,利福平耐药是结核治疗失败最常见的因素。2018年,全球范围内结核病新发病例约有1 000万,约有48.4万人出现利福平耐药结核病,其中78%为耐多药结核病(MDR-TB)。MDR-TB病例中,估计有6.2%存在广泛耐药结核病(XDR-TB)[1]。MDR-TB的产生和广泛传播是结核病防控工作的巨大挑战,主要因为缺乏快速和准确诊断,且MDR-TB需要长期二线抗结核药物治疗,成本高,药物毒性作用明显。及时确诊耐药结核病对结核病的防控及治疗均具有十分重要的意义[2]。
传统的罗氏药物敏感性试验(L-J药敏试验)以培养为基础,经3~8周分离培养菌株后仍需4周左右才能获得药敏试验结果,耗时较长,不能快速提供可靠的药敏试验依据。即便选用Bactec MGIT 960快速培养技术,分离培养菌株后仍需约2周才能得到药敏结果[3]。因此,建立更加快速高效的结核菌耐药的诊断方法是当前耐药结核病防控的迫切需要。Xpert MTB/RIF是以半巢式实时荧光定量PCR技术为基础的分子检测技术,该技术被世界卫生组织(WHO)推荐为诊断结核病和耐利福平结核病的方法[4]。荧光PCR熔解曲线技术是一种基于单核苷酸熔解温度不同而形成不同形态熔解曲线的基因分析技术,是在实时荧光定量PCR仪上根据靶序列熔点的变化,检测靶序列是否含有突变从而获得耐药信息[5]。基因芯片技术是CapitalBio™ DNA微阵列方法,在特定的核苷酸位置掺入特定核苷酸rpoB基因,通过检测标本中结核分枝杆菌(MTB)rpoB基因的突变情况,从而判定对利福平的耐药性[6]。由于大多数耐利福平的分离菌株也表现出对异烟肼的耐药性,因此检测利福平耐药可作为MDR-TB的替代标记[1]。近几年,Xpert MTB/RIF、荧光PCR熔解曲线及基因芯片技术检测利福平耐药的分子方法在我国得到了较大的推广与认可,但对于此三种分子检测方法优劣并无定论。本研究通过比较Xpert MTB/RIF、荧光PCR熔解曲线、基因芯片技术对利福平耐药性检测效能,评估三种分子技术在快速筛查利福平耐药结核病中的临床价值和意义。
收集2016年9月3日至2019年8月11日在浙江省中西医结合医院收治的Bactec MGIT 960液体培养药敏确诊为结核病,且具有Xpert MTB/RIF、基因芯片结果的150例患者资料,对纳入所有患者痰液、支气管肺泡灌洗液分离的培养菌株均进行荧光PCR熔解曲线检测。该研究经医院伦理委员会审批(伦理批号:浙江省中西医结合医院伦理临审201610号),且所有患者均签署知情同意书。
Bactec MGIT 960液体培养系统及试剂(美国BD公司,批号:7166829和7144979等)。Xpert MTB/RIF实时荧光PCR检测仪(美国Cepheid公司),Xpert MTB/RIF检测试剂盒(美国Cepheid公司,批号:1000102388、1000095447等)。实时荧光定量检测仪(SLAN-96S Real-Time PCR System厦门致善生物科技有限公司)。利福平耐药突变检测试剂盒(实时荧光PCR熔解曲线法,批号:10110401)。Lab-Aid 824型自动核酸提取仪购于厦门致善生物科技股份有限公司。BioMixer™Ⅱ芯片杂交仪(中国北京博奥生物有限公司);LuxScan™10K-B微阵列芯片杂交仪;SlideWasger™8芯片干洗仪;TC96 PCR扩增仪(美国伯乐生物有限公司)。晶芯结核分枝杆菌耐药基因检测试剂盒(批号:20180102、20180601等)。
按照《结核病实验室标准化操作与网络建设》[7]中的操作程序进行。取处理好的标本0.5 mL加入MGIT液体培养管中,放入Bactec MGIT 960液体培养系统中进行培养,培养阳性的标本进一步行药敏试验。Bactec MGIT 960系统药敏试验是将从结核病患者分离得到的MTB在已知浓度的检测药物存在的条件下进行体外培养,观察其生长状况,同时与不加任何药物的对照管进行比较,若菌株在对照及药物培养管中均生长,则认为该菌株对该药物耐药;若只在对照管中生长,则认为该菌株对该药物敏感。
取1 mL痰液或其他标本加入有螺旋盖的前处理管中,然后加入2 mL标本体积的SR处理液(氢氧化钠、异丙醇),涡旋振荡15~30 s,静置15 min~1 h,使标本充分液化。打开反应盒,取2 mL处理后样品从加样孔缓慢加入反应盒,然后将反应盒置于检测模块。仪器开始进行自动化检测,2 h后系统可自动读出MTB检测结果与利福平耐药结果。
取1.0 mL标本消化液加入1.5 mL EP管中并以12 000 g/min离心5 min,弃上清液后加1 mL生理盐水混匀,12 000 g/min离心5 min,弃上清液加入50 μL核酸提取液并混匀,然后移入核酸提取管中,旋涡振荡15 s,12 000 g/min离心10 s,95℃金属浴10 min,12 000 g/min离心1 min备用。PCR扩增、芯片杂交、芯片洗涤干燥、芯片扫描和结果判读均按试剂盒操作说明进行。
按照荧光PCR熔解曲线法结核分枝杆菌利福平耐药突变检测试剂盒(厦门致善生物科技有限公司)说明书操作。结果分析:当样品的熔解温度值(Tm)与阳性对照的Tm值一致(误差不超过1℃)时判定为野生型(敏感);样品的Tm值低于阳性对照Tm值2℃或2℃以上时判定为突变型(耐药)。
采用SPSS 19.0和Medcalc 15.2.2软件进行统计分析,三种检测方法间的敏感度及特异度比较采用χ2检验,如理论频数<5的单元格超过1/5,采用Fisher精确检验。三种分子检测方法与Bactec MGIT 960液体药敏结果一致性分析采用Kappa检验,Kappa≥0.75说明一致性较好,Kappa<0.4说明一致性较差,0.75>Kappa≥0.4说明一致性一般。计算各检测方法诊断效能采用ROC曲线分析。以P<0.05为差异具有统计学意义。
150例患者中,利福平耐药18例,Xpert MTB/RIF检出16例,荧光PCR熔解曲线检出17例,基因芯片技术检出16例。利福平敏感132例,Xpert MTB/RIF检出127例,荧光PCR熔解曲线检出127例,基因芯片技术检出126例。以Bactec MGIT 960药敏结果为金标准,Xpert MTB/RIF检测利福平耐药的敏感度和特异度分别为88.89%和96.21%。荧光PCR熔解曲线检测利福平耐药的敏感度和特异度分别为94.44%和96.21%。基因芯片技术检测利福平耐药的敏感度和特异度分别为88.89%和95.45%。三种检测方法的敏感度比较,差异无统计学意义(P>0.05)。三种检测方法间的特异度比较,差异无统计学意义(χ2=0.130,P>0.05)。三种分子检测方法与Bactec MGIT 960液体药敏结果一致性分析均较好(Kappa=0.794、0.827、0.770,均>0.75)(表1)。
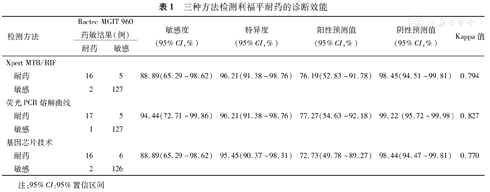
三种方法检测利福平耐药的诊断效能
三种方法检测利福平耐药的诊断效能
| 检测方法 | Bactec MGIT 960药敏结果(例) | 敏感度(95%CI,%) | 特异度(95%CI,%) | 阳性预测值(95%CI,%) | 阴性预测值(95%CI,%) | Kappa值 | ||
|---|---|---|---|---|---|---|---|---|
| 耐药 | 敏感 | |||||||
| Xpert MTB/RIF | ||||||||
| 耐药 | 16 | 5 | 88.89(65.29~98.62) | 96.21(91.38~98.76) | 76.19(52.83~91.78) | 98.45(94.51~99.81) | 0.794 | |
| 敏感 | 2 | 127 | ||||||
| 荧光PCR熔解曲线 | ||||||||
| 耐药 | 17 | 5 | 94.44(72.71~99.86) | 96.21(91.38~98.76) | 77.27(54.63~92.18) | 99.22 (95.72~99.98) | 0.827 | |
| 敏感 | 1 | 127 | ||||||
| 基因芯片技术 | ||||||||
| 耐药 | 16 | 6 | 88.89(65.29~98.62) | 95.45(90.37~98.31) | 72.73(49.78~89.27) | 98.44(94.47~99.81) | 0.770 | |
| 敏感 | 2 | 126 | ||||||
注:95%CI:95%置信区间
根据不同检测方法检测样本在选择的各点上的灵敏度和特异度,绘成ROC曲线,以Bactec MGIT 960药敏结果为状态变量拟和对利福平耐药诊断效能的ROC曲线。分别以Xpert MTB/RIF、荧光PCR熔解曲线和基因芯片技术为检验变量时,ROC曲线下面积分别为0.926、0.953、0.922。三种检测方法对利福平耐药均具有较好的诊断价值(P值均<0.01),但三种方法比较,差异无统计学意义(Z=1.00、1.00、1.13,P值均>0.05)(图1,表2)。
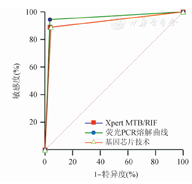

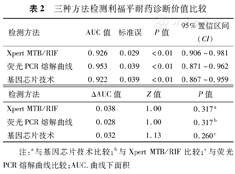
三种方法检测利福平耐药诊断价值比较
三种方法检测利福平耐药诊断价值比较
| 检测方法 | AUC值 | 标准误 | P值 | 95%置信区间(CI) |
|---|---|---|---|---|
| Xpert MTB/RIF | 0.926 | 0.029 | <0.01 | 0.906~0.981 |
| 荧光PCR熔解曲线 | 0.953 | 0.039 | <0.01 | 0.871~0.962 |
| 基因芯片技术 | 0.922 | 0.039 | <0.01 | 0.867~0.959 |
| 检测方法 | ΔAUC值 | Z值 | P值 |
|---|---|---|---|
| Xpert MTB/RIF | 0.038 | 1.00 | 0.317a |
| 荧光PCR熔解曲线 | 0.028 | 1.00 | 0.317b |
| 基因芯片技术 | 0.032 | 1.13 | 0.260c |
注:a与基因芯片技术比较;b与Xpert MTB/RIF比较;c与荧光PCR熔解曲线比较;AUC.曲线下面积
三种方法检测利福平耐药与Bactec MGIT 960药敏不一致结果共8例:在药敏结果为敏感病例中,应用三种方法检测发现5例rpoB区域突变,1例Xpert MTB/RIF和荧光PCR熔解曲线耐药位点为野生型但基因芯片技术为突变型。1例三种方法检测均为野生型,1例Xpert MTB/RIF和基因芯片技术检测为野生型但荧光PCR熔解曲线为双峰(既有野生型峰又有突变峰)(表3)。在150例患者中,三种方法共同检测出rpoB 531位点突变14例,12例药敏结果耐药;rpoB 533位点突变3例,1例药敏结果耐药;rpoB 526位点突变2例,1例药敏结果耐药。
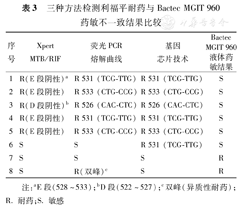
三种方法检测利福平耐药与Bactec MGIT 960药敏不一致结果比较
三种方法检测利福平耐药与Bactec MGIT 960药敏不一致结果比较
| 序号 | Xpert MTB/RIF | 荧光PCR熔解曲线 | 基因芯片技术 | Bactec MGIT 960液体药敏结果 |
|---|---|---|---|---|
| 1 | R(E段阴性)a | R 531 (TCG-TTG) | R 531 (TCG-TTG) | S |
| 2 | R(E段阴性) | R 533 (CTG-CCG) | R 533 (CTG-CCG) | S |
| 3 | R(D段阴性)b | R 526 (CAC-CTC) | R 526 (CAC-CTC) | S |
| 4 | R(E段阴性) | R 531 (TCG-TTG) | R 531 (TCG-TTG) | S |
| 5 | R(E段阴性) | R 533 (CTG-CCG) | R 533 (CTG-CCG) | S |
| 6 | S | S | R 531 (TCG-TTG) | S |
| 7 | S | S | S | R |
| 8 | S | R(双峰)c | S | R |
注:aE段(528~533);bD段(522~527);c双峰(异质性耐药);R.耐药;S.敏感
与耐万古霉素肠球菌、耐甲氧西林金黄色葡萄球菌等其他细菌相比,MTB耐药机制较单一,其耐药与染色体相关基因突变有关,与进入休眠期使得药物的摄入减少、药物外排泵活性增加、前体药物活化酶减少、质粒耐药基因等因素几乎无关,基因突变的存在被认为是该菌最重要的耐药机制[8]。
利福平的耐药机制特点尤其适合快速分子检测,因为所有利福平耐药菌株>95%包含位于细菌RNA聚合酶rpoB基因的81 bp核心区域内的突变。通过检测靶向rpoB基因突变,利福平耐药性的检测敏感度为98%,而敏感株几乎总是具有相同的野生型核苷酸序列。此外,相比异烟肼的耐药与多基因突变相关及单抗较普遍的特点,利福平耐药更适合作为MDR-TB的指标[9]。因此,针对利福平耐药检测的分子方法均选择以rpoB基因为分子靶标。Xpert MTB/RIF检测是WHO推荐的用于检测结核病和利福平耐药的方法。自从问世以来,其简便、快速、准确检测结核病及利福平耐药受到国内外广泛关注。随着MTB耐药分子机制的不断深入,我国自主研发的检测结核病和利福平耐药的分子方法也得到了较大发展。本研究以Bactec MGIT 960药敏检测方法为标准,分析了Xpert MTB/RIF、荧光PCR熔解曲线和基因芯片技术对利福平耐药的检测效能,以期对临床诊断提供依据。
以往的研究[10,11,12]显示,Xpert MTB/RIF检测利福平耐药的敏感度为96.71%~97.6%,特异度为96.2%~98.25%,本研究中敏感度和特异度分别为88.89%和96.21%,敏感度低于以往研究结果,特异度较一致。考虑原因主要集中在两方面:一方面是本研究纳入的利福平耐药样本例数较少;另一方面,本研究中出现1例异质性耐药,在后续的实验中证实了Xpert MTB/RIF不易检测到低比例的异质性耐药,这可能是造成敏感度较低的原因。荧光PCR熔解曲线检测利福平耐药的敏感度和特异度分别为94.44%和96.21%。这与王峰等[13]的研究结果(97.8%和97.1%)较一致。在另一项研究[14]中显示,表型药敏检测为耐药的18例菌株中,荧光PCR熔解曲线检出15例,敏感度为83.33%,通过与DNA测序进行比对,证实其余3例rpoB核心区均为野生型,3例耐药可能为rpoB核心区之外区域突变或其他机制引起。在不同的研究中,虽然荧光PCR熔解曲线的敏感度存在一定的差异,但对rpoB核心区有准确的检测效能。另外,与Xpert MTB/RIF和基因芯片技术相比,在18例耐药的样本中,荧光PCR熔解曲线检出17例,Xpert MTB/RIF和基因芯片技术各检出16例,虽然三者相比,并无统计学上的意义,但是仍能显示荧光PCR熔解曲线在异质性耐药检测方面的存在一定优势。基因芯片技术检测利福平耐药的敏感度和特异度分别为88.89%和95.45%,这与吴联朋和吴双辽[15]的研究结果(敏感度和特异度为89.8%和93.1%)一致。三种分子检测方法之间比较,敏感度和特异度差异均无统计学意义。Kappa一致性分析显示,三种分子方法与Bactec MGIT 960药敏结果的一致性分别为0.794、0.827、0.770,提示三种分子检测方法对利福平耐药均有较好的诊断价值。ROC曲线分析结果显示,以Bactec MGIT 960药敏为金标准,Xpert MTB/RIF、荧光PCR熔解曲线、基因芯片技术检测利福平耐药的曲线下面积分别为0.926、0.953、0.922。三种检测方法对利福平耐药的诊断价值比较,差异无统计学意义。
本研究显示,三种方法检测利福平耐药与Bactec MGIT 960药敏不一致结果共8例。在药敏结果为敏感的病例中,应用三种方法检测发现5例rpoB区域突变,2例rpoB 531(TCG-TTG),2例rpoB 533(CTG-CCG),1例rpoB 526(CAC-CTC)。考虑3种耐药位点突变为沉默突变,未引起蛋白表达及相应生物学功能改变。其中1例病例经追溯,芯片信号值较低,可能与分子杂交过程出现非特异信号所致。1例考虑为利福平rpoB突变区以外部位突变或其他耐药机制引起。1例荧光PCR熔解曲线检测为双峰(既有野生型峰又有突变峰),经全基因组测序(迅敏康生物科技有限公司)鉴定,此病例存在异质性耐药。在后续工作中,我院实验室对三种分子检测方法检测异质性耐药进行了验证。将敏感菌与耐药菌进行混合,配制5%、10%、20%、30%、40%五个浓度各四份。荧光PCR熔解曲线可以检测>10%(耐药菌/所有菌)异质性耐药,Xpert MTB/RIF和基因芯片技术可以检测出>20%异质性耐药。研究显示荧光PCR熔解曲线在检测异质性耐药方面优于Xpert MTB/RIF和基因芯片技术。
在150例患者中,耐药水平分析显示:rpoB 531位点突变病例共14例,12例药敏结果耐药,为高水平耐药;rpoB 533位点突变共3例,1例耐药,为低水平耐药;rpoB 526位点突变共2例,1例耐药,为中水平耐药。单个耐药位点在引起菌株耐药的所有耐药位点中,18例耐药菌株中,rpoB 531位点突变12例;rpoB 533、rpoB 526位点突变各1例。综上,研究显示rpoB 531位点突变与利福平耐药相关度较高,和Zhang等[16]研究相似,表现为高水平、高频耐药位点。rpoB 533突变与利福平耐药相关性较低,rpoB 526相关性中等,二者均为低频耐药位点,研究与Hillemann等[17]报道一致。研究显示,三种分子方法对检测利福平耐药位点均具有较好的诊断效能,对不同耐药位点的耐药水平及发生频率分析,可以为临床诊疗提供更详细的耐药信息。Xpert MTB/RIF检测均在密闭的小盒子中,操作简单,对实验室及实验人员要求较低,检测时间短,可在2 h内报告,对细菌浓度要求较低(10~300 CFU/mL)[9]。荧光PCR熔解曲线、基因芯片技术可以检测到位点突变,需要较为复杂的处理步骤,更多的实际操作时间和手动工作量,对实验室有较高的要求,并且均对细菌浓度要求较高(>104 CFU/mL)。因此,与荧光PCR熔解曲线、基因芯片技术相比,Xpert MTB/RIF检测利福平耐药具有便利、快速等优势。因为本研究选择耐药病例较少,不能体现出引起三者差异的其他情况,比如Xpert MTB/RIF拷贝低会引起耐药判读误差[18];Xpert MTB/RIF与荧光PCR熔解曲线覆盖突变区范围大于基因芯片,可以检测更多的位点,也可能因为检测更多无意义突变引起判读差异。这些均需要更多的病例加以研究,以便更好的对三种分子的结果进行解读。
综上所述,虽然三种分子检测方法检测利福平耐药的原理、实验操作及对异质性耐药检测等方面存在差异,但是三种分子方法对利福平耐药的检测性能比较无明显差异,均可作为常规临床实验室中检测利福平耐药的有效选择。
所有作者均声明不存在利益冲突



























