
分析核苷(酸)类似物[Nucleoside (acid) analogues,NAs]抗病毒治疗中乙型肝炎肝硬化(乙肝肝硬化)进展为原发性肝细胞癌(Hepatocellular carcinoma,HCC)的危险因素。
回顾性分析浙江省人民医院2014年11月至2019年10月接受NAs抗病毒治疗的253例乙肝肝硬化及进展为HCC患者的临床资料,并分为肝硬化组137例和HCC组116例。采用多因素Logistic回归分析NAs抗病毒治疗中乙肝肝硬化进展为HCC的危险因素。
多因素Logistic回归分析显示,年龄(OR=1.094,95%CI 1.034~1.158,P<0.01)、吸烟史(OR=5.056,95%CI 1.453~17.594,P<0.05)、乙肝肝癌家族史(OR=6.763,95%CI 1.253~36.499,P<0.05)、拉米夫定耐药史(OR=6.097,95%CI 1.370~27.134,P<0.05)、空腹血糖水平(Fasting blood glucose,FBG)(OR=7.219,95%CI 3.716~14.024,P<0.01)为乙肝肝硬化进展为HCC的独立危险因素;HBV DNA阴转率(OR=0.028,95%CI 0.006~0.137,P<0.01)为乙肝肝硬化进展为HCC的保护因素。
乙肝肝硬化患者抗病毒治疗应密切监测是否耐药、HBV DNA及FBG水平,同时采取戒烟、选用高耐药基因屏障的NAs抗病毒药物预防HCC的发生。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
乙型肝炎病毒(Hepatitis B virus,HBV)感染是我国肝癌发生的最主要病因,患者常经历慢性乙型肝炎(Chronic hepatitis B,CHB)-肝硬化-肝癌三部曲。据世界卫生组织报道,由HBV感染及其相关的肝病,如肝硬化和原发性肝细胞癌(Hepatocellular carcinoma,HCC),每年在全世界造成约88.7万人死亡[1]。长期使用核苷(酸)类似物[Nucleoside (acid) analogues,NAs]抗HBV治疗可改善肝脏炎症活动,阻断肝硬化进程,降低HCC发生率[2],提高患者生存率,但NAs治疗并不能完全阻断乙型肝炎肝硬化(简称乙肝肝硬化)向肝癌进展[3]。部分乙肝肝硬化患者即使长期使用NAs抗病毒治疗仍不能阻断其进展为HCC,有的患者发现时已为HCC晚期,失去手术切除机会。本研究回顾性分析NAs抗病毒治疗中乙肝肝硬化进展为HCC的相关临床特点及危险因素,为临床早期阻断乙肝肝硬化进展为HCC的风险提供理论依据。
选取2014年11月至2019年10月浙江省人民医院门诊及住院已接受NAs治疗的乙肝肝硬化患者和乙肝肝硬化进展为HCC患者共253例为研究对象,分为肝硬化组(n=137)和HCC组(n=116),采用回顾性横断面研究方法进行分析。乙肝肝硬化的诊断符合中华医学会肝病学分会和感染病学分会制定的《慢性乙型肝炎防治指南(2015更新版)》[4],HCC的诊断符合《原发性肝癌诊疗规范(2011年版)摘要》[5]中的标准。病例纳入标准:(1)年龄>18岁;(2)接受NAs,包括拉米夫定(LAM)、阿德福韦酯(ADV)、替比夫定(LDT)、恩替卡韦(ETV)和替诺福韦酯(TDF)治疗至少6个月。排除标准:(1)合并HCV、HDV、HIV感染的患者;(2)自身免疫性肝炎和药物性肝炎患者;(3)HCC发生在抗病毒治疗前;(4)有药物成瘾、吸毒、精神病患者。本研究经浙江省人民医院伦理委员会批准(2020QT155)。
收集乙肝肝硬化和HCC组患者的临床资料[6,7],包括年龄、性别、吸烟史、饮酒史、乙肝肝癌家族史(一级亲属:父母、兄弟姐妹和子女的HCC家族史)、抗病毒治疗史(用药种类、用药治疗时间、用药是否规律、是否产生耐药等)、生化学、肝脏影像学(B超、肝脏CT或MR增强)、凝血酶原时间(PT)、HBV DNA水平、HBV血清学标志物等。其中HBV DNA阴转率指在NAs抗病毒治疗6个月后,HBV DNA水平低于检测值下限。所有病例选用第1次入院时检查结果,选取连续两次(间隔3个月)结果进行分析统计。
HBV血清学标志物采用罗氏Cobas601全自动电化学发光免疫分析系统定量检测,美国雅培公司i2000免疫分析仪及配套试剂完成;HBV DNA采用罗氏LightCycler480检测仪检测,HBV DNA试剂盒为中国深圳匹基生物工程股份有限公司生产,采用日本日立公司7600生化分析仪测定生化指标;凝血功能采用希森美康生产试剂。
采用SPSS 20.0软件对数据进行统计分析。计量资料以Kolmogorov-Smirnov检验进行正态性检验,正态分布的数据以 ±s表示,采用t检验;偏态分布的数据采用中位数(M)和四分位数间距(Q25,Q75)表示,采用Mann-WhitneyU检验;计数资料采用例(百分数)表示,采用χ2检验。采用Logstic回归进行危险因素分析,以相对危险度(OR)及其95%可信区间(CI)表示,P<0.05为差异具有统计学意义。
±s表示,采用t检验;偏态分布的数据采用中位数(M)和四分位数间距(Q25,Q75)表示,采用Mann-WhitneyU检验;计数资料采用例(百分数)表示,采用χ2检验。采用Logstic回归进行危险因素分析,以相对危险度(OR)及其95%可信区间(CI)表示,P<0.05为差异具有统计学意义。
253例患者男性184例,女性69例,平均年龄(56.8±10.7)岁。HCC组男性比例、吸烟史、饮酒史、乙肝肝癌家族史、LAM耐药史、Child-Pugh分级B和C级比例高于肝硬化组(P<0.01或<0.05),且年龄、NAs抗病毒时间、血清丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、γ-谷氨酰转肽酶(GGT)、碱性磷酸酶(ALP)、空腹血糖(FBG)、总胆红素(TBil)水平亦较肝硬化组升高(P<0.01或<0.05);但肝硬化组抗病毒治疗后HBV DNA阴转率高于HCC组(P<0.05),见表1。
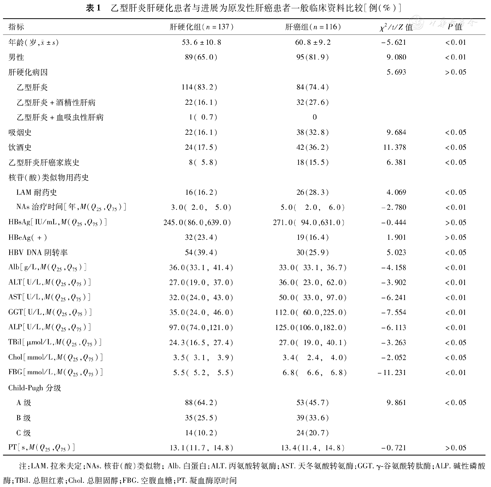
乙型肝炎肝硬化患者与进展为原发性肝癌患者一般临床资料比较[例(%)]
乙型肝炎肝硬化患者与进展为原发性肝癌患者一般临床资料比较[例(%)]
| 指标 | 肝硬化组(n=137) | 肝癌组(n=116) | χ2/t/Z值 | P值 | |
|---|---|---|---|---|---|
年龄(岁, ±s) ±s) | 53.6±10.8 | 60.8±9.2 | -5.621 | <0.01 | |
| 男性 | 89(65.0) | 95(81.9) | 9.080 | <0.01 | |
| 肝硬化病因 | 5.693 | >0.05 | |||
| 乙型肝炎 | 114(83.2) | 84(74.4) | |||
| 乙型肝炎+酒精性肝病 | 22(16.1) | 32(27.6) | |||
| 乙型肝炎+血吸虫性肝病 | 1( 0.7) | 0 | |||
| 吸烟史 | 22(16.1) | 38(32.8) | 9.684 | <0.05 | |
| 饮酒史 | 24(17.5) | 42(36.2) | 11.378 | <0.05 | |
| 乙型肝炎肝癌家族史 | 8( 5.8) | 18(15.5) | 6.381 | <0.05 | |
| 核苷(酸)类似物用药史 | |||||
| LAM耐药史 | 16(16.2) | 26(28.3) | 4.069 | <0.05 | |
| NAs治疗时间[年,M(Q25,Q75)] | 3.0( 2.0,5.0) | 5.0(2.0,6.0) | -2.780 | <0.01 | |
| HBsAg[IU/mL,M(Q25,Q75)] | 245.0(86.0,639.0) | 271.0( 94.0,631.0) | -0.444 | >0.05 | |
| HBeAg(+) | 32(23.4) | 19(16.4) | 1.901 | >0.05 | |
| HBV DNA阴转率 | 54(39.4) | 30(25.9) | 5.023 | <0.05 | |
| Alb[g/L,M(Q25,Q75)] | 36.0(33.1, 41.4) | 33.0( 33.1, 36.7) | -4.158 | <0.01 | |
| ALT[U/L,M(Q25,Q75)] | 27.0(19.0, 37.0) | 36.0( 23.0, 62.0) | -3.902 | <0.01 | |
| AST[U/L,M(Q25,Q75)] | 32.0(24.0, 43.0) | 50.0( 33.0, 97.0) | -6.241 | <0.01 | |
| GGT[U/L,M(Q25,Q75)] | 35.0(24.0, 46.0) | 112.0( 60.0,225.0) | -7.554 | <0.01 | |
| ALP[U/L,M(Q25,Q75)] | 97.0(74.0,121.0) | 125.0(106.0,182.0) | -6.113 | <0.01 | |
| TBil[μmol/L,M(Q25,Q75)] | 24.3(16.5, 27.4) | 27.0( 19.0, 40.1) | -3.263 | <0.05 | |
| Chol[mmol/L,M(Q25,Q75)] | 3.5( 3.1,3.9) | 3.4(2.4,4.0) | -2.052 | <0.05 | |
| FBG[mmol/L,M(Q25,Q75)] | 5.5( 5.2,5.5) | 6.8(6.6,6.8) | -11.231 | <0.01 | |
| Child-Pugh分级 | |||||
| A级 | 88(64.2) | 53(45.7) | 9.861 | <0.05 | |
| B级 | 35(25.5) | 39(33.6) | |||
| C级 | 14(10.2) | 24(20.7) | |||
| PT[s,M(Q25,Q75)] | 13.1(11.7, 14.8) | 13.4(11.4, 14.8) | -0.721 | >0.05 | |
注:LAM.拉米夫定;NAs.核苷(酸)类似物;Alb.白蛋白;ALT.丙氨酸转氨酶;AST.天冬氨酸转氨酶;GGT.γ-谷氨酰转肽酶;ALP.碱性磷酸酶;TBil.总胆红素;Chol.总胆固醇;FBG.空腹血糖;PT.凝血酶原时间
将上述有统计学意义的指标使用逐步向前法纳入Logistic多因素回归方程,结果显示年龄(OR=1.094,95%CI 1.034~1.158,P<0.01)、吸烟史(OR=5.056,95%CI 1.453~17.594,P<0.05)、乙肝肝癌家族史(OR=6.763,95%CI 1.253~36.499,P<0.05)、LAM耐药史(OR=6.097,95%CI 1.370~27.134,P<0.05)、FBG(OR=7.219,95%CI 3.716~14.024,P<0.01)为乙肝肝硬化NAs抗病毒治疗过程中进展为HCC的独立危险因素;HBV DNA阴转率(OR=0.028,95%CI 0.006~0.137,P<0.01)为乙肝肝硬化进展为HCC的保护因素(表2)。
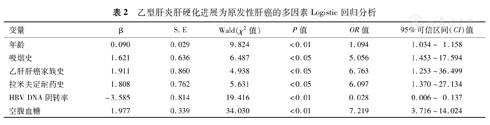
乙型肝炎肝硬化进展为原发性肝癌的多因素Logistic回归分析
乙型肝炎肝硬化进展为原发性肝癌的多因素Logistic回归分析
| 变量 | β | S.E | Wald(χ2值) | P值 | OR值 | 95%可信区间(CI)值 |
|---|---|---|---|---|---|---|
| 年龄 | 0.090 | 0.029 | 9.824 | <0.01 | 1.094 | 1.034~ 1.158 |
| 吸烟史 | 1.621 | 0.636 | 6.487 | <0.05 | 5.056 | 1.453~17.594 |
| 乙肝肝癌家族史 | 1.911 | 0.860 | 4.938 | <0.05 | 6.763 | 1.253~36.499 |
| 拉米夫定耐药史 | 1.808 | 0.762 | 5.631 | <0.05 | 6.097 | 1.370~27.134 |
| HBV DNA阴转率 | -3.585 | 0.814 | 19.416 | <0.01 | 0.028 | 0.006~ 0.137 |
| 空腹血糖 | 1.977 | 0.339 | 34.030 | <0.01 | 7.219 | 3.716~14.024 |
肝癌是全球第二大癌症相关死亡原因,中国肝癌病例约占全世界肝癌病例的一半[8]。NAs抗病毒可以降低乙肝肝硬化并发HCC的发生率,但部分乙肝肝硬化患者即使接受NAs抗病毒治疗仍发生HCC,因此研究乙肝肝硬化进展为HCC的相关危险因素具有重要临床意义。
乙肝肝硬化患者血清HBV DNA水平与HCC的发生相关,只要患者血清HBV DNA可以被检测出,就有HCC发生的危险[9]。有研究报道[10],即使乙肝肝硬化患者血清HBV DNA维持在较低水平(<2 000 IU/mL),发生HCC的危险仍较高。Chen等[11]研究也发现HCC的发病率与基线血清HBV DNA水平呈剂量-反应关系,从HBV DNA水平<300拷贝/mL时108例/10万人-年HCC累积发病率为1.3%,到HBV DNA水平为≥100万拷贝/mL时1 152例/10万人-年HCC累积发病率为14.9%。上述研究表明,HBV DNA水平与HCC的发生具有相关性。本研究结果显示,HBV DNA阴转是乙肝肝硬化NAs抗病毒治疗中进展为HCC的保护因素。因此,针对HBV DNA可检测出的乙肝肝硬化患者,应尽早行有效抗病毒治疗,快速降低HBV DNA水平至检测值下限,同时加强HBV DNA水平的监测,降低HCC的发生风险。
近年来研究报道,我国肝癌平均发病年龄呈上升趋势,全国22个肿瘤登记点连续性的监测数据结果显示,我国肝癌平均发病年龄男性由58.80岁上升为62.35岁,女性由64.02岁上升为68.99岁[12]。本研究同样发现高龄是NAs抗病毒治疗中乙肝肝硬化进展为HCC的独立危险因素(P<0.01)。因此,针对老年乙肝肝硬化患者,应当密切监测肿瘤标志物、肝脏影像学等变化,以便早期发现HCC,早期干预,提高生存质量。同时,研究发现吸烟为NAs抗病毒治疗中乙肝肝硬化进展为HCC独立危险因素。相较于不吸烟的乙肝肝硬化患者,吸烟患者HCC的发生增加了4.056倍。这可能与吸烟产生的烟雾对机体有直接毒性作用及致癌作用有关[13],如烟雾中具有致癌的化学物质苯并芘,为有机物不完全燃烧形成的多环芳烃类,通过作用于相关通路及基因致癌[14]。此外,吸烟还增加促炎因子的产生并促进肝细胞损伤[13]。因此,建议肝硬化吸烟患者应当尽早戒烟,减少HCC发生的危险。
多项流行病学调查发现,肝癌的发生有家族聚集性现象,Yang等[15]研究显示,有肝癌病史的一级亲属患肝癌的概率是无家族史患者的2倍,有母亲受累的风险尤其高,风险比为5.35(95%CI 3.10~9.21)。遗传或共有环境暴露或两者联合都与肝癌发生有关[16],但遗传在肝癌发生中起作用的具体机制尚未完全明确;家庭聚集环境暴露也可增加HCC的发生风险,如使用酒精和烟草等行为因素,摄入黄曲霉毒素污染的食物等饮食因素。本研究多因素分析表明,有肝癌家族史的乙肝肝硬化患者进展为HCC的风险更高(95%CI 1.253~36.499)。因此,建议有一级亲属为HCC的乙肝肝硬化患者即使接受抗病毒治疗也应定期行全面HCC筛查,避免接触不良环境及纠正不良饮食习惯。
NAs抗HBV治疗主要作用于病毒逆聚合酶区,通过取代病毒复制过程中延长聚合酶链所需结构相似的核苷,终止延长链的延长,从而抑制病毒复制。但是,NAs无法减少肝细胞核内由松弛环状DNA(rcDNA)形成的共价闭合环状DNA(cccDNA),而cccDNA的持续存在是乙肝肝硬化进展为HCC的基础[17]。LAM在中国已有20余年的临床应用史,长期使用LAM抗病毒治疗可延缓疾病进展、降低肝功能失代偿及HCC的发生率,但随着LAM治疗时间的延长,HBV易发生耐药突变[18]。研究报道LAM相关的YMDD变异在LAM治疗开始后8~44个月(中位数21.5个月)发生,66.6%病例在12~24个月内出现YMDD突变,治疗5年后突变率高达70%[19,20]。即使LAM抗病毒治疗出现耐药后联合ADV挽救治疗、换用ETV或TDF序贯治疗,仍有部分患者HBV DNA未持续应答,致肝脏反复炎症活动。本研究结果显示,对LAM耐药的乙肝肝硬化患者更易发展为HCC。因此,对乙肝肝硬化抗病毒治疗宜选择国内外指南[4,21]推荐的高耐药基因屏障的NAs,如ETV、TDF、富马酸丙酚替诺福韦(TAF)抗病毒治疗,以增加抗病毒治疗持续应答,最大限度地长期抑制HBV DNA复制,减轻肝细胞炎症坏死和肝硬化失代偿,降低HCC的发生。
肝脏作为机体重要代谢器官在维持葡萄糖稳态中起关键作用。Gao等[22]通过动物实验证实缺失核受体辅助活化因子5(Nuclear receptor coactivator 5,NCOA5)会导致小鼠早发性糖耐量减退,增加葡萄糖耐量异常和肝癌发生的易感性。流行病学研究发现肝硬化患者出现糖耐量受损及确诊糖尿病的比例要远高于正常人群,其中患有2型糖尿病肝硬化患者发生HCC的风险更高[23]。另外,有学者发现降糖药物可以降低2型糖尿病患者肝癌发生的风险[24]。本研究亦发现HCC组FBG水平高于乙肝肝硬化组,且多因素分析示FBG升高是NAs抗病毒治疗中乙肝肝硬化进展为HCC的独立危险因素。因此,控制乙肝肝硬化患者FBG水平可作为降低其发生HCC风险的一种可能途径。
综上所述,年龄、吸烟、乙肝肝癌家族史、LAM耐药及FBG水平升高为NAs抗病毒治疗中乙肝肝硬化进展为HCC的独立危险因素,HBV DNA阴转率为乙肝肝硬化进展为HCC的保护因素。因此,建议HBV相关肝硬化患者抗病毒药物选择高耐药基因屏障的一线NAs,定期行生化、甲胎蛋白、肝脏影像学检查,控制血糖水平。加强患者健康宣教,戒烟戒酒,以减少HCC发生风险,并早期发现HCC进行干预。本研究仍存在一定的局限性,未将吸烟、饮酒对HCC影响的模式具体展开;同时,本研究采用回顾性分析方法,且属于单中心研究,后续仍需进一步行多中心、大样本深入研究以提高本研究独立危险因素的临床参考价值。
所有作者均声明不存在利益冲突



























