
本文报道1例危重型艾滋病合并暴露型结核免疫重建炎症综合征(TB-IRIS)病例。患者启动抗反转录病毒治疗2个月后出现结核病相关临床表现,确诊肺结核及淋巴结核。在抗结核治疗取得疗效时(结核菌培养阴性),患者病情仍持续进展,呈现过度的炎症反应,出现全身广泛淋巴结脓肿、腰大肌脓肿、肺弥漫性病变(双侧反复气胸),以及脑实质病灶。经过强效抗结核治疗以及抗炎治疗,患者病情逐渐恢复。该案例强调了启动抗反转录病毒治疗前筛查和治疗潜在结核感染的重要性,为危重型暴露TB-IRIS的处理提供了一定借鉴经验。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
结核病是艾滋病患者常见的机会性感染及主要死亡原因之一,早期诊断和抗结核治疗,以及适当时机高效抗反转录病毒治疗(HAART)是提高其生存率的关键[1]。结核相关免疫重建炎症反应综合征(TB-IRIS)是一种复杂并发症[2],主要机制是免疫激活后产生的异常炎症反应,总发病率约为18%,病死率约2%,主要可表现为矛盾TB-IRIS和暴露TB-IRIS两种形式。目前关于暴露TB-IRIS报道较少,现报道1例HAART过程中发生严重的TB-IRIS。
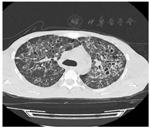
患者男,36岁,因"发现HIV抗体阳性5个月,发热、咳嗽、淋巴结肿痛3个月"于2019年3月15日入院。患者2018年11月10日确诊抗-HIV(+),查CD4+T淋巴细胞计数25个/μL,血浆HIV载量未检测,当时颈部有数枚淋巴结肿大,约1 cm×1 cm大小,无疼痛及不适,未作检查明确病因及给予特殊治疗。11月15日当地医院予拉米夫定(0.3 g/d)、替诺福韦(0.3 g/d)和依非韦伦(0.6 g/d)联合ART,12月15日患者开始出现发热,热峰40 ℃,咳嗽,少量白黏痰,颈部淋巴结进行性增大,并出现全身多处淋巴结肿痛。2019年1月10日当地医院淋巴结穿刺脓液以及肺泡灌洗液GeneXpert MTB/RIF检测阳性(无利福平耐药),诊断为"艾滋病合并肺结核、淋巴结核"。1月14日启动"异烟肼、乙胺丁醇、莫西沙星以及利福平"抗结核治疗2月余。1月15日测血浆HIV载量为200拷贝/mL。治疗后患者淋巴结肿痛仍进行性加重,咳嗽无明显好转,反复发热,遂来我院就诊。既往体健。入院体格检查:体温36.5 ℃,呼吸20次/min,脉搏120次/min,血压89/68 mmHg(1 mmHg=0.133 kPa),耳下、颌下、颈部、锁骨上、腋窝淋巴结肿大,伴触痛,部分有波动感。口腔无白斑,双肺呼吸音粗,未闻及干湿性啰音,心律齐,各瓣膜区未闻及杂音,腹软,无压痛及反跳痛,肝脾肋缘下未及肿大,肠鸣音正常,双下肢无水肿。入院后立即完善相关检查,血常规示白细胞(WBC)8.33×109/L,中性粒细胞占比0.852,血红蛋白(Hb)137 g/L,血小板360×109/L。C-反应蛋白(CRP)73.2 mg/L,降钙素原(PCT)0.12 ng/L,红细胞沉降率60 mm/1 h。CD4+T淋巴细胞计数162个/μL,血浆HIV载量低于检测值下限。血清1,3-β-D-葡聚糖104.0 pg/mL,半乳甘露聚糖0.25,隐球菌抗原阴性。痰抗酸染色阳性,GeneXpert MTB/RIF检测阳性(无利福平耐药),痰细菌培养阴性。淋巴结穿刺脓液抗酸染色阳性,GeneXpert MTB/RIF检测阳性(无利福平耐药),脓液细菌培养阴性。结核分枝杆菌耐药基因检测示异烟肼、利福平、乙胺丁醇、莫西沙星以及阿米卡星均敏感。3月15日查胸部CT:肺部弥漫性病变,示蜂窝状高密度影,支气管壁增厚,呈囊状或柱状扩张,间有多发小片状、粟粒状高密度影,边界欠清,密度欠均(图1)。患者无中枢神经系统症状,3月22日常规筛查颅脑磁共振示:颅内多发病灶,右侧脑室旁及基底节区小片状T2高信号,增强后可见结节样强化及环形强化(图2)。3月23日完善脑脊液检查:WBC 2×106个/L,总蛋白344.2 mg/L,乳酸脱氢酶(LH) 14 IU/L,葡萄糖2.8 mmol/L,氯122 mmol/L,腺苷脱氨酶0.3 U/L;抗酸染色阴性,GeneXpert MTB/RIF阴性,隐球菌抗原阴性,脑脊液细菌培养阴性;干扰素γ 12 ng/L。

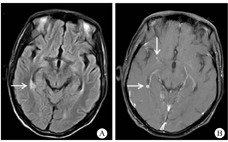

注:A.右侧脑室旁及基底节区小片状T2高信号(箭头示);B.增强后可见结节样强化及环形强化(箭头示),周围水肿带未见强化
入院初步诊断:"艾滋病合并播散性结核病(累及中枢神经系统、呼吸系统以及淋巴系统),暴露型TB-IRIS"。3月15日予异烟肼(0.9 g/d)、利福平(0.6 g/d)、乙胺丁醇(1.0 g/d)、吡嗪酰胺(1.5 g/d)、莫西沙星(0.4 g/d),以及阿米卡星(0.4 g/d)强化抗结核治疗,拉米夫定(0.3 g/d)、替诺福韦(0.3 g/d)和依非韦伦(0.6 g/d)抗-HIV治疗,复方磺胺甲噁唑(0.48 g/d)预防肺孢子菌肺炎治疗,静脉滴注地塞米松(5 mg/次,1次/d)抗炎以及多处浅表淋巴结切开引流治疗。患者病情未见明显改善,反复高热,精神极度萎靡,食欲差。4月5日突发气胸,需要双侧胸腔闭式引流;破溃淋巴结难以愈合,大量脓液分泌;腹胀、腹痛难以忍受(严重时需要使用地佐辛止痛治疗)。因患者病情危重,4月6日遂加用复方磺胺甲噁唑(1.44 g/次,4次/d)联合卡泊芬净(第1天70 mg,第2天开始50 mg/d,1次/d,静脉滴注)经验性抗肺孢子菌肺炎治疗,在此基础上予甲基泼尼松龙(40 mg/次,1次/12 h,静脉滴注;逐渐减量)联合沙利度胺(50 mg/次,3次/d)抗炎治疗。考虑到药物相互作用问题,停用利福平,改为利奈唑胺(0.6 g/次,1次/12 h,静脉滴注)抗结核治疗。ART方案调整为拉米夫定(0.3 g/d)、替诺福韦(0.3 g/d)和多替拉韦(50 mg/d)。4月18日查增强CT示广泛淋巴结脓肿:颈部、锁骨、双侧腋窝、肝门部、腹膜后、右侧盆壁内侧淋巴结肿大,中心坏死,环形强化;部分淋巴结融合成团,分界不清,右侧腰大肌脓肿形成。住院期间出现的主要不良反应为骨髓抑制(血常规中WBC最低1.4×109/L,Hb最低55 g/L)。经过综合治疗,患者病情缓慢改善,胸腔闭式引流维持时间约1个月拔除引流管。5月10复查胸部CT较前改善。6月13日查颅脑MRI右侧颞叶侧脑室旁结节有所增大(图3),考虑与免疫重建相关,因患者无明显中枢神经系统症状,继续巩固治疗1个月后出院。7月13日出院时患者抗结核方案调整为异烟肼(0.6 g/次,1次/d),乙胺丁醇(1.0 g/d),吡嗪酰胺(1.5 g/d),莫西沙星(0.4 g/d)以及利奈唑胺(0.6 g/次,2次/d),抗炎药物为甲泼尼松龙(12 mg/d,每2周减量1片)和沙利度胺(50 mg/次,3次/d;每2周减量1片)。8月20日随访颅脑磁共振示原病灶明显吸收。继续随访3个月,患者病情稳定,无不适主诉。
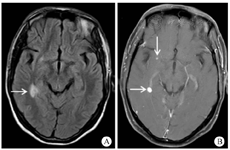

注:A.右侧脑室旁及基底节区小片状T2高信号(箭头示), B.增强后可见下结节样强化及环形强化(箭头示),周围水肿带未见强化
TB-IRIS是指部分HIV合并结核分枝杆菌感染的患者在接受ART后,原有结核病症状反常恶化或者潜在结核分枝杆菌感染在ART后出现活动[3]。
根据ART启动与结核治疗之间的时间关系[4],HIV相关的TB-IRIS可分为矛盾型TB-IRIS和暴露型TB-IRIS。矛盾型TB-IRIS是指患者在ART前被诊断为结核病,经治疗结核病相关的症状已经改善,在启动ART后,出现临床症状复发或加重。暴露型TB-IRIS[5]是指患者在开始ART之前存在未明确的潜伏结核感染或结核病亚临床表现,启动ART后,在免疫重建过程中发展成活动性结核。暴露型TB-IRIS发病时间多在ART启动后7~79 d,临床表现以淋巴结炎、脓肿形成最为常见,同时易并发全身病变,包括浆膜炎和肺浸润、中枢神经系统受累[6]。主要诊断标准有[4]:在启动ART前患者未接受抗结核治疗,且在启动ART后3个月内患者出现活动性结核相关表现,并满足以下条件之一:临床表现有明显的炎症成分参与,如结核性淋巴结炎或结核脓肿伴随显著急性炎症特征。启动抗结核治疗后,临床情况因严重的变态反应变得复杂。同时需排除结核菌耐药、合并新的机会性感染。
本例患者有以下特点:(1)启动ART治疗后复查CD4+T淋巴细胞明显上升,HIV载量明显下降,抗病毒疗效佳。(2)患者ART治疗前颈部有散在小淋巴结肿大,无其他不适,未得到重视及进一步明确,启动ART治疗2个月后出现发热、颈部淋巴结进行性肿大及全身淋巴结肿大,后确诊为肺结核及淋巴结核。考虑患者启动ART治疗前即存在结核病亚临床症状,但未得到明确。(3)患者入院后脓液找到抗酸杆菌,GeneXpert阳性,但多次查脓液、血液、痰液结核分枝杆菌培养均阴性,结核菌耐药基因检测示未见耐药,提示抗结核治疗有效,病原学检测无其他机会性感染依据,病情危重时治疗亦广覆盖细菌、真菌,但患者病情仍持续进展,出现全身广泛淋巴结脓肿、腰大肌脓肿、肺弥漫性病变(双侧反复气胸)以及脑实质病灶,呈现过度的炎症特征。根据以上特征,本病例符合暴露型TB-IRIS。这种以全身播散性脓肿以及肺弥漫性病变为表现,危及生命的暴露TB-IRIS临床较为罕见。
TB-IRIS相关的炎症反应一般是暂时的,不需要特别干预,然而对于炎症反应特别严重的TB-IRIS,可能会导致死亡[7]。目前HIV相关的TB-IRIS的治疗方案无明确的指南可循,主要的观点有[8]:(1)加强抗结核治疗,减轻抗原负荷,继续ART治疗,并根据药物之间的相互作用,优化抗病毒治疗方案。该患者入院后在原标准抗结核方案基础上加用莫西沙星以及阿米卡星强化抗结核分枝杆菌治疗,后期因药物相互作用将利福平改为利奈唑胺,依非韦伦改为多替拉韦,病原学治疗已尽量优化及全面。(2)该患者入院后表现出明显炎症特征,糖皮质激素仍然是唯一经RCT试验验证的干预措施,对中重度患者,短期(4~8周)使用糖皮质激素[9] (强的松1.5 mg/kg持续2周,0.75 mg/kg持续2周或等效剂量激素)治疗,可减轻症状,降低病死率。该患者入院后给予地塞米松(5 mg/d)治疗,临床症状仍加重,对于激素治疗效果较差的难治性免疫重建患者,国内外有个案报道沙利度胺(3~5 mg·kg-1·d-1)成功治疗结核及隐球菌相关IRIS的病例[10,11],本例患者在长期使用激素效果欠佳时改为甲泼尼松龙和沙利度胺联合抗炎,取得了良好疗效。
综上所述,该患者CD4+T淋巴细胞低下,在启动ART前未发现潜在的结核感染,导致免疫应答加重,病情危重,极大增加了后期治疗难度。为了降低HIV合并结核分枝杆菌感染患者IRIS的发生概率,ART治疗前对结核分枝杆菌感染进行排查,并给予有效的治疗,在抗病毒治疗3个月内,密切关注可能出现的免疫炎症反应。
所有作者均声明不存在利益冲突



























