
分析头孢他啶/阿维巴坦(CZA)治疗碳青霉烯类耐药革兰阴性菌(CRO)重症感染患者的临床特征及预后。
回顾性分析2019年12月至2020年10月浙江省人民医院重症医学科CRO感染并接受CZA治疗的63例患者临床资料。根据分离培养的细菌学种类将其分为碳青霉烯类耐药肺炎克雷伯菌(CRKP)感染组(40例)和碳青霉烯类耐药铜绿假单胞菌(CRPA)感染组(23例)。根据血培养结果将CRKP感染患者分为CRKP血培养阳性组(16例)和CRKP血培养阴性组(24例)。主要研究终点为14 d和28 d病死率,次要研究终点为病原体清除率。组间符合正态分布计量资料采用成组t检验或配对t检验进行比较;不符合正态分布计量资料采用Mann-Whitney U秩和检验进行比较。计数资料采用χ2检验进行比较。采用Kaplan-Meier法绘制CRKP血培养阳性组和阴性组患者接受CZA治疗后28 d生存曲线,并采用log-rank检验进行比较。P<0.05为差异有统计学意义。
CRKP感染组患者收缩压和舒张压分别为(108±28)和(56±12) mmHg,CRPA感染组分别为(122±20)和(64±14) mmHg,差异均有统计学意义(t=-2.11和-2.51,P均<0.05)。CRKP感染组血液、痰液和腹水阳性标本分别有16、20和4例,CRPA感染组分别为3、19和1例,差异有统计学意义(χ2=6.45,P<0.05)。CRKP感染组患者接受CZA治疗第1天收缩压、舒张压、最高体温、CRP、血乳酸及CRKP阳性比例分别为(108±28) mmHg、(56±12) mmHg、(38.1±0.8) ℃、98(48,162) mg/L、(3.5±2.5) mmol/L和100%,治疗后第7天分别为(122±19) mmHg、(63±12) mmHg、(37.0±0.6) ℃、48(24,86) mg/L、(2.1±1.5) mmol/L和0,差异均有统计学意义(t=-2.49、-2.65、6.09和2.97,Z=-3.20,χ2=80.00,P均<0.05)。CRPA感染组患者接受CZA治疗第1天最高体温、CRP、降钙素原和CRPA阳性比例分别为(38.3±0.7) ℃、106(56,196) mg/L、1.39(0.67,3.37) ng/mL和100%,治疗后第7天分别为(36.9±0.6) ℃、31(9,80) mg/L、0.42(0.19,2.01) ng/mL和0,差异均有统计学意义(t=6.76,Z=-3.07和-2.31,χ2=46.00,P均<0.05)。随访截至2021年2月28日,CRKP感染组接受CZA治疗后14 d和28 d病死率分别为42.5%和67.5%,CRPA感染组分别为30.4%和65.2%,差异均无统计学意义(χ2=0.90和0.03,P均>0.05)。CRKP血培养阳性组和阴性组患者收缩压分别为(97±31)和(116±23) mmHg,差异有统计学意义(t=-2.20,P<0.05)。CRKP血培养阳性组患者接受CZA治疗后14 d和28 d病死率分别为62.5%和87.5%,阴性组分别为29.1%和54.1%,差异均有统计学意义(χ2=4.17和6.51,P均<0.05)。
CRO重症感染患者病死率高,CRKP血培养阳性患者14 d和28 d病死率均高于阴性患者,CZA可改善CRO重症感染患者炎症指标,促进病原学转阴。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
细菌耐药问题已成为严重威胁人们健康的世界性公共卫生问题,国内耐碳青霉烯类抗菌药物肠杆菌科细菌分离率呈逐年上升趋势[1,2]。目前,多黏菌素被认为是碳青霉烯类耐药革兰阴性菌(Carbapenem-resistant gram-negative organisms,CRO)抗感染治疗的最后一道防线,但近年来多黏菌素相关耐药性报道也较多[1,3]。研究表明,在体外试验中头孢他啶/阿维巴坦(Ceftazidime/avibactam,CZA)对CRO具有较好的抗菌活性[4],尤其是碳青霉烯类耐药肺炎克雷伯菌(Carbapenem-resistantKlebsiella pneumoniae,CRKP)和碳青霉烯类耐药铜绿假单胞菌(Carbapenem-resistantPseudomonas aeruginosa,CRPA)。但近期一项小样本真实世界的观察性研究发现,CZA治疗多重耐药革兰阴性菌感染的挽救性治疗并不能明显改善患者预后[5]。本研究回顾性分析CZA治疗CRO重症感染的患者临床特征及药物疗效,总结CZA治疗临床CRO重症感染的临床经验,以期为后续开展CZA单药或多药联合治疗CRO重症感染提供一些借鉴与参考,现报道如下。
选取2019年12月至2020年10月浙江省人民医院重症医学科63例碳青霉烯类耐药革兰阴性菌引起的重症感染且使用CZA治疗的住院患者为研究对象,其中男性43例,女性28例,平均年龄(66±16)岁。根据分离培养的细菌学种类将患者分为CRKP感染组(40例)和CRPA感染组(23例)。CRKP感染组男性28例,女性12例,平均年龄(68±12)岁;根据血培养结果将CRKP感染患者分为CRKP血培养阳性组(16例)和CRKP血培养阴性组(24例)。CRPA感染组男性15例,女性8例,平均年龄(62±22)岁。主要研究终点为14 d和28 d病死率,次要研究终点为病原体清除率。纳入标准:(1)年龄≥18周岁;(2)使用CZA治疗至少3 d;(3)住院期间病原体培养明确诊断为CRO感染;(4)存在重症感染所致器官功能障碍,即序贯器官衰竭(Sequential organ failure assessment,SOFA)评分≥2分。排除标准:(1)年龄<18周岁;(2)使用CZA治疗不足3 d;(3)疾病处于终末期且存在严重不可逆的并发症;(4)CRKP和CRPA混合感染;(5)非CRKP或CRPA的CRO感染。根据患者症状、体征和实验室检查指标等确诊是否存在感染,再根据相应感染部位标本培养结果确诊为CRKP或CRPA感染[6]。本研究经浙江省人民医院伦理委员会审核通过(伦理审批号:2021QT223),患者均签署知情同意书。
采用病例报告表收集研究对象临床资料,包括:年龄、性别、身高、体质量、基础疾病、CRO类型、感染部位、急性生理功能及慢性健康状况评分系统(Acute physiology and chronic health evaluation,APACHE)Ⅱ评分、SOFA评分、使用CZA治疗后14 d和28 d病死率以及所有患者使用CZA治疗第1、7天体温、收缩压、舒张压、白细胞(WBC)、血小板、超敏C反应蛋白(C-reactive protein,CRP)、血清降钙素原(Procalcitonin,PCT)和血乳酸水平。CZA使用方法:采用微量泵持续静脉泵入,2.5 g/次,每8小时1次,每次持续2 h。同时根据患者血清肌酐清除率及药物使用说明书调整剂量,治疗时间至少3 d。
应用SPSS 22.0统计软件进行数据分析。符合正态分布的计量资料采用 ±s表示,采用成组t检验或配对t检验进行比较。不符合正态分布的计量资料采用中位数(M)和上下四分位数间距(P25,P75)表示,采用Mann-WhitneyU秩和检验进行比较。计数资料采用例(百分比)表示,采用χ2检验进行比较。采用Kaplan-Meier法绘制CRKP血培养阳性组和阴性组患者接受CZA治疗后28 d生存曲线,并采用log-rank检验进行比较。P<0.05为差异具有统计学意义。
±s表示,采用成组t检验或配对t检验进行比较。不符合正态分布的计量资料采用中位数(M)和上下四分位数间距(P25,P75)表示,采用Mann-WhitneyU秩和检验进行比较。计数资料采用例(百分比)表示,采用χ2检验进行比较。采用Kaplan-Meier法绘制CRKP血培养阳性组和阴性组患者接受CZA治疗后28 d生存曲线,并采用log-rank检验进行比较。P<0.05为差异具有统计学意义。
63例患者平均年龄(66±16)岁,平均体质指数(Body mass index,BMI)为(22±3) kg/m2,APACHE Ⅱ和SOFA评分分别为(21±7)和(6±3)分;其中痰液样本阳性39例(61.9%),腹水样本阳性5例(7.9%),血液样本阳性19例(30.2%)。CRKP感染组收缩压和舒张压分别为(108±28)和(56±12) mmHg(1 mmHg=0.133 kPa,下同),CRPA感染组分别为(122±20)和(64±14) mmHg,差异均有统计学意义(t=-2.11和-2.51,P均<0.05)。CRKP感染组血液、痰液和腹水阳性标本分别有16、20和4例,CRPA感染组分别为3、19和1例,差异有统计学意义(χ2=6.45,P<0.05)。两组患者年龄、性别、BMI及合并疾病等其他一般资料差异均无统计学意义(P均>0.05)。详见表1。
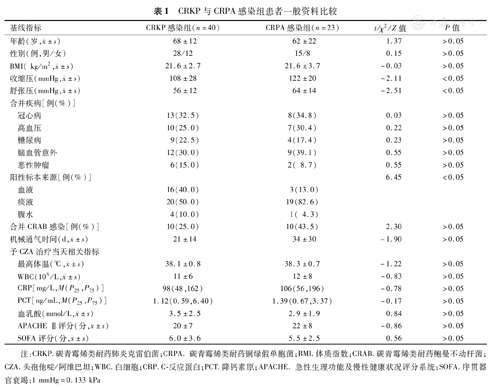
CRKP与CRPA感染组患者一般资料比较
CRKP与CRPA感染组患者一般资料比较
| 基线指标 | CRKP感染组(n=40) | CRPA感染组(n=23) | t/χ2/Z值 | P值 | |
|---|---|---|---|---|---|
年龄(岁, ±s) ±s) | 68±12 | 62±22 | 1.37 | >0.05 | |
| 性别(例,男/女) | 28/12 | 15/8 | 0.15 | >0.05 | |
BMI( kg/m2, ±s) ±s) | 21.6±2.7 | 21.6±3.7 | -0.03 | >0.05 | |
收缩压(mmHg, ±s) ±s) | 108±28 | 122±20 | -2.11 | <0.05 | |
舒张压(mmHg, ±s) ±s) | 56±12 | 64±14 | -2.51 | <0.05 | |
| 合并疾病[例(%)] | |||||
| 冠心病 | 13(32.5) | 8(34.8) | 0.03 | >0.05 | |
| 高血压 | 10(25.0) | 7(30.4) | 0.22 | >0.05 | |
| 糖尿病 | 9(22.5) | 4(17.4) | 0.23 | >0.05 | |
| 脑血管意外 | 12(30.0) | 9(39.1) | 0.55 | >0.05 | |
| 恶性肿瘤 | 6(15.0) | 2( 8.7) | 0.55 | >0.05 | |
| 阳性标本来源[例(%)] | 6.45 | <0.05 | |||
| 血液 | 16(40.0) | 3(13.0) | |||
| 痰液 | 20(50.0) | 19(82.6) | |||
| 腹水 | 4(10.0) | 1( 4.3) | |||
| 合并CRAB感染[例(%)] | 10(25.0) | 10(43.5) | 2.30 | >0.05 | |
机械通气时间(d, ±s) ±s) | 21±14 | 34±30 | -1.90 | >0.05 | |
| 予CZA治疗当天相关指标 | |||||
最高体温(℃, ±s) ±s) | 38.1±0.8 | 38.3±0.7 | -1.22 | >0.05 | |
WBC(109/L, ±s) ±s) | 11±6 | 12±8 | -0.83 | >0.05 | |
| CRP[mg/L,M(P25,P75)] | 98(48,162) | 106(56,196) | -0.78 | >0.05 | |
| PCT[ng/mL,M(P25,P75)] | 1.12(0.59,6.40) | 1.39(0.67,3.37) | -0.17 | >0.05 | |
血乳酸(mmol/L, ±s) ±s) | 3.5±2.5 | 2.9±1.9 | 0.84 | >0.05 | |
APACHE Ⅱ评分(分, ±s) ±s) | 20±7 | 22±8 | -0.86 | >0.05 | |
SOFA评分(分, ±s) ±s) | 6.0±3.6 | 5.5±2.5 | 0.56 | >0.05 | |
注:CRKP.碳青霉烯类耐药肺炎克雷伯菌;CRPA.碳青霉烯类耐药铜绿假单胞菌;BMI.体质指数;CRAB.碳青霉烯类耐药鲍曼不动杆菌;CZA.头孢他啶/阿维巴坦;WBC.白细胞;CRP.C-反应蛋白;PCT.降钙素原;APACHE.急性生理功能及慢性健康状况评分系统;SOFA.序贯器官衰竭;1 mmHg=0.133 kPa
CRKP感染组患者接受CZA治疗第1天收缩压、舒张压、最高体温、CRP、血乳酸及CRKP阳性比例分别为(108±28) mmHg、(56±12) mmHg、(38.1±0.8) ℃、98(48,162) mg/L、(3.5±2.5) mmol/L和100%,治疗后第7天分别为(122±19) mmHg、(63±12) mmHg、(37.0±0.6) ℃、48(24,86) mg/L、(2.1±1.5) mmol/L和0,差异均有统计学意义(t=-2.49、-2.65、6.09和2.97,Z=-3.20,χ2=80.00,P均<0.05);CRKP感染组患者接受CZA治疗第1、7天WBC和PCT差异均无统计学意义(P均>0.05),详见表2。CRPA感染组患者接受CZA治疗第1天最高体温、CRP、PCT和CRPA阳性比例分别为(38.3±0.7) ℃、106(56,196) mg/L、1.39(0.67,3.37) ng/mL和100%,治疗后第7天分别为(36.9±0.6) ℃、31(9,80) mg/L、0.42(0.19,2.01) ng/mL和0,差异均有统计学意义(t=6.76,Z=-3.07和-2.31,χ2=46.00,P均<0.05)。CRPA感染组患者接受CZA治疗第1、7天收缩压、舒张压、WBC和血乳酸差异均无统计学意义(P均>0.05)。详见表3。随访截至2021年2月28日,63例患者接受CZA治疗后28 d病死率为66.7%(42/63)。CRKP感染组接受CZA治疗后14 d和28 d病死率分别为42.5%和67.5%,CRPA感染组分别为30.4%和65.2%,差异均无统计学意义(χ2=0.90和0.03,P均>0.05)。
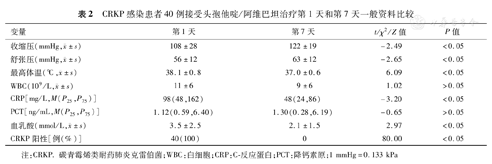
CRKP感染患者40例接受头孢他啶/阿维巴坦治疗第1天和第7天一般资料比较
CRKP感染患者40例接受头孢他啶/阿维巴坦治疗第1天和第7天一般资料比较
| 变量 | 第1天 | 第7天 | t/χ2/Z值 | P值 |
|---|---|---|---|---|
收缩压(mmHg, ±s) ±s) | 108±28 | 122±19 | -2.49 | <0.05 |
舒张压(mmHg, ±s) ±s) | 56±12 | 63±12 | -2.65 | <0.05 |
最高体温(℃, ±s) ±s) | 38.1±0.8 | 37.0±0.6 | 6.09 | <0.05 |
WBC(109/L, ±s) ±s) | 11±6 | 9±6 | 1.02 | >0.05 |
| CRP[mg/L,M(P25,P75)] | 98(48,162) | 48(24,86) | -3.20 | <0.05 |
| PCT[ng/mL,M(P25,P75)] | 1.12(0.59,6.40) | 1.30(0.28,6.19) | -0.65 | >0.05 |
血乳酸(mmol/L, ±s) ±s) | 3.5±2.5 | 2.1±1.5 | 2.97 | <0.05 |
| CRKP阳性[例(%)] | 40(100) | 0 | 80.00 | <0.05 |
注:CRKP.碳青霉烯类耐药肺炎克雷伯菌;WBC:白细胞;CRP:C-反应蛋白;PCT:降钙素原;1 mmHg=0.133 kPa
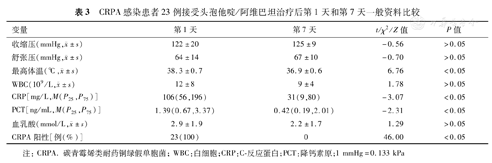
CRPA感染患者23例接受头孢他啶/阿维巴坦治疗后第1天和第7天一般资料比较
CRPA感染患者23例接受头孢他啶/阿维巴坦治疗后第1天和第7天一般资料比较
| 变量 | 第1天 | 第7天 | t/χ2/Z值 | P值 |
|---|---|---|---|---|
收缩压(mmHg, ±s) ±s) | 122±20 | 125±9 | -0.56 | >0.05 |
舒张压(mmHg, ±s) ±s) | 64±14 | 67±10 | -0.70 | >0.05 |
最高体温(℃, ±s) ±s) | 38.3±0.7 | 36.9±0.6 | 6.76 | <0.05 |
WBC(109/L, ±s) ±s) | 12±8 | 9±4 | 1.78 | >0.05 |
| CRP[mg/L,M(P25,P75)] | 106(56,196) | 31(9,80) | -3.07 | <0.05 |
| PCT[ng/mL,M(P25,P75)] | 1.39(0.67,3.37) | 0.42(0.19,2.01) | -2.31 | <0.05 |
血乳酸(mmol/L, ±s) ±s) | 2.9±1.9 | 2.2±1.7 | 1.29 | >0.05 |
| CRPA阳性[例(%)] | 23(100) | 0 | 46.00 | <0.05 |
注:CRPA.碳青霉烯类耐药铜绿假单胞菌;WBC:白细胞;CRP:C-反应蛋白;PCT:降钙素原;1 mmHg=0.133 kPa
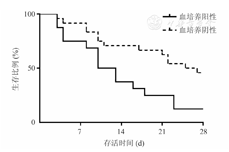
CRKP血培养阳性组和阴性组患者收缩压分别为(97±31)和(116±23)mmHg,差异有统计学意义(t=-2.20,P<0.05);两组患者年龄、性别、舒张压及接受CZA治疗当天相关指标差异均无统计学意义(P均>0.05),详见表4。CRKP血培养阳性组患者接受CZA治疗后14 d和28 d病死率分别为62.5%和87.5%,阴性组分别为29.1%和54.1%,差异均有统计学意义(χ2=4.17和6.51,P均<0.05),详见图1。
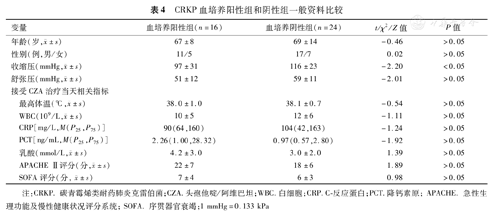
CRKP血培养阳性组和阴性组一般资料比较
CRKP血培养阳性组和阴性组一般资料比较
| 变量 | 血培养阳性组(n=16) | 血培养阴性组(n=24) | t/χ2/Z值 | P值 | |
|---|---|---|---|---|---|
年龄(岁, ±s) ±s) | 67±8 | 69±14 | -0.46 | >0.05 | |
| 性别(例,男/女) | 11/5 | 17/7 | 0.02 | >0.05 | |
收缩压(mmHg, ±s) ±s) | 97±31 | 116±23 | -2.20 | <0.05 | |
舒张压(mmHg, ±s) ±s) | 51±12 | 59±11 | -2.01 | >0.05 | |
| 接受CZA治疗当天相关指标 | |||||
最高体温(℃, ±s) ±s) | 38.0±1.0 | 38.1±0.7 | -0.54 | >0.05 | |
WBC(109/L, ±s) ±s) | 10±5 | 12±6 | -1.11 | >0.05 | |
| CRP[mg/L,M(P25,P75)] | 90(64,160) | 104(42,163) | -1.24 | >0.05 | |
| PCT[ng/mL,M(P25,P75)] | 2.26(1.00,28.32) | 0.97(0.57,2.80) | -1.92 | >0.05 | |
乳酸(mmol/L, ±s) ±s) | 4.2±3.0 | 3.0±2.0 | 1.39 | >0.05 | |
APACHE Ⅱ评分(分, ±s) ±s) | 22±7 | 18±6 | 1.89 | >0.05 | |
SOFA评分(分, ±s) ±s) | 7±4 | 6±3 | 0.98 | >0.05 | |
注:CRKP.碳青霉烯类耐药肺炎克雷伯菌;CZA.头孢他啶/阿维巴坦;WBC.白细胞;CRP.C-反应蛋白;PCT.降钙素原;APACHE.急性生理功能及慢性健康状况评分系统;SOFA.序贯器官衰竭;1 mmHg=0.133 kPa

既往碳青霉烯类抗生素是治疗革兰阴性菌感染的首选药物,但随着抗生素耐药性增加,越来越多的感染难以使用碳青霉烯类药物治疗[7]。中国2018年耐药细菌监测报告显示,较2005年,在肺炎克雷伯菌中CRKP的比例从3%升至26%;CRPA在铜绿假单胞菌中的比例达到了30%以上[1]。抗生素耐药已经成为严重危害人类健康的公共问题之一。幸运的是,近年来新研发的几种针对耐药基因的抗生素已被纳入抗感染治疗方案。这些新型抗生素的研发与应用、病原学快速诊断技术的进步以及我们对如何优化抗生素药代动力学/药效学的研究进展改变了CRO感染治疗前景。然而,尽管有新的抗生素问世,人类与细菌耐药性的斗争仍将继续。近年来,有关替加环素耐药的报道屡见不鲜,甚至多粘菌素也出现了耐药情况[3,8]。
CZA作为一种新研发的抗感染药物,对碳青霉烯类耐药菌株的体外实验研究发现,包括产碳青霉烯酶、含OXA-48基因的碳青霉烯类耐药肠杆菌株,CZA的敏感度达到了98%,甚至对同时产超广谱β-内酰胺酶、产C类头孢菌素酶的菌株也具抗菌活性[4]。本研究中CZA能够有效降低重症感染患者CRP、PCT和体温高峰,所有接受CZA抗感染治疗的患者7 d内CRKP或CRPA培养全部转阴。Temkin等[9]在一项CZA挽救性治疗CRO感染患者的研究中,发现73.7%(28/38)的患者达到临床治愈或微生物治愈标准。Chen等[10]开展的一项纳入10例肺移植术后CRKP感染患者(至少使用CZA抗感染3 d)的回顾性研究,发现CZA可有效降低患者体温高峰、WBC和PCT。上述研究提示CZA具有作为治疗CRO感染的潜力。然而,另有相关研究却提示了不同结论。van等[11]开展的一项关于多粘菌素和CZA治疗碳青霉烯类耐药肠杆菌感染方面的比较研究中,发现CZA治疗组患者14 d病死率为9%;而Jorgensen等[12]开展的一项纳入203例多重耐药革兰阴性杆菌患者的多中心、回顾性研究中,接受CZA治疗的患者30 d病死率为17.2%。本研究中CRO重症感染患者使用CZA治疗后的28 d病死率却高达66.7%。造成上述差异的可能原因包括:(1)本研究纳入患者血培养阳性率较高(30.2%),远超Jorgensen等[12]的研究(10.8%)。研究表明,血培养阳性是危重症患者90 d死亡的独立危险因素[13]。本研究中对CRKP患者进行亚组分析,发现血培养阳性患者病死率较高,Kuang等[5]对CZA挽救性治疗多重耐药革兰阴性杆菌感染的真实世界、观察性研究中血培养阳性比例35%(7/20),30 d病死率为55%,与本研究相近。(2)CZA细菌耐药性问题。一方面,部分革兰阴性杆菌已对CZA产生耐药性,最近一项关于CRKP流行病学的单中心研究报道中,有近20%的CRKP对CZA存在耐药性[14];Shields等[15]在一项CZA治疗碳青霉烯类耐药肠杆菌感染研究中,发现3例患者在接受CZA规范治疗后再次出现碳青霉烯类耐药肠杆菌感染,且对CZA产生耐药性。另一方面,对于产金属酶的革兰阴性杆菌的治疗,CZA效果欠佳[16],而根据2017年对我国碳青霉烯类耐药肠杆菌流行病学调查研究发现,31%的碳青霉烯类耐药肠杆菌具有产金属酶的耐药基因[17]。(3)严重感染引起的继发多脏器功能不全。本研究中患者SOFA评分将近6分,提示存在严重的脏器功能不全,而危重病患者脏器功能不全与其不良预后密切相关。
综上所述,CZA可有效改善CRO重症感染患者炎症指标,促进其病原学转阴。本研究也存在一定局限性:(1)本研究是一项回顾性、单中心研究,无法完全控制混杂因素,消除偏倚,且样本量较小。(2)本研究中CZA属于经验性用药,无相关药敏试验数据,且未严格规定药物开始使用时间,可能会对评估治疗效果造成一定的偏倚。上述原因使得本研究结论的可靠性受到一定影响。
所有作者均声明不存在利益冲突































