
比较富马酸替诺福韦酯(TDF)阻断乙型肝炎母婴传播在分娩时和产后12周停药对产后出现丙氨酸转氨酶(ALT)异常的影响。
采用前瞻性研究方法,选取2016年6月至2018年8月于杭州市第一人民医院就诊的HBsAg及HBeAg均阳性的妊娠妇女共84例,随机分为分娩时停药组(42例)和产后12周停药组(42例),最终完成产后24周随访共66例,分娩时停药组35例,产后12周停药组31例。所有患者均于孕24~28周开始服用TDF治疗,定期监测并比较两组患者的HBV DNA载量变化和ALT异常情况,通过多因素Logistic回归分析产后ALT异常的影响因素,采用SPSS 26.0软件进行统计分析。
两组患者在产后16周HBV DNA载量与基线值相比,差异无统计学意义(Z=-0.742和-1.891,P值均>0.05)。66例产妇中有21例产后出现ALT异常,其中分娩时停药组9例(25.71%,9/35),产后12周停药组12例(38.71%,12/31),两组差异无统计学意义(χ2=1.280,P>0.05),且ALT异常程度在两组间差异亦无统计学意义(χ2=0.527,P>0.05)。经二分类Logistic回归分析发现,孕期ALT异常与产后出现ALT异常独立相关(OR=13.75,95%CI 1.49~126.85,P<0.05)。
应用TDF阻断HBV母婴传播产后不同时间停药对产后肝功能无明显影响,孕期ALT异常是产后出现肝功能异常的一项危险因素,这类孕妇产后应谨慎停药并严密监测肝功能。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
在我国,约30%~50% HBV感染者来自母婴传播,母婴垂直传播为主要传播途径之一[1]。尽管应用抗病毒治疗药物可明显减少慢性HBV感染所致肝硬化和肝癌等的发生,但慢性乙型肝炎仍很难治愈。由此可见,阻断HBV母婴传播仍是目前控制慢性HBV感染的主要措施。近年来的研究,尤其是主动被动联合免疫的提出与实行,可以有效地减少产时感染及产后感染,使得HBV母婴传播的防治发生了质的飞跃,可使90%以上HBsAg阳性母亲的新生儿免于HBV感染,但仍有5%~7%的新生儿感染HBV[2]。高病毒载量是HBV母婴垂直传播的高危因素之一[3]。为保证妊娠期的母婴安全以及减少母婴传播,HBV感染高病毒载量孕妇妊娠期抗病毒治疗已越来越广泛的应用。母婴阻断的停药时机一直是较具有争议的一个问题,国内外指南对此的推荐意见也存在差异。欧洲肝病学会和美国肝病学会建议产后12周停药[4,5],我国台湾地区推荐产后1个月停药[6]。2019年中国《慢性乙型肝炎防治指南》[7]指出免疫耐受期口服核苷(酸)类似物的孕妇,可于产后即刻或服用1~3个月后停药。2020年世界卫生组织(WHO)制定的乙型肝炎母婴阻断管理指南中推荐抗病毒药物治疗至少用到分娩[8]。由于担心产后立即停药可能存在诱发产后肝炎活动的风险,临床上对于产后立即停药仍有顾虑。本文希望通过前瞻性研究,比较富马酸替诺福韦酯(TDF)用于阻断乙型肝炎母婴传播分娩时及产后12周停药对产后出现肝酶异常的影响,寻找对产后肝酶异常有意义的预测因子。
收集2016年6月1日至2018年8月31日于杭州市第一人民医院感染科门诊就诊的HBsAg及HBeAg均阳性的妊娠妇女共84例,患者均符合所有入选标准:(1)HBV感染免疫耐受期孕妇,年龄20~40岁,HBsAg及HBeAg阳性;(2)孕早期两次HBV DNA≥2×106 IU/mL;(3)孕前1年内未应用任何抗HBV治疗药物且孕前半年内及孕早期丙氨酸转氨酶(ALT)正常或仅1次升高且小于2倍正常值上限(ULN,40 U/L),未经治疗恢复正常。排除标准:(1)合并肝功能不全、肝硬化或肝细胞癌(HCC);(2)合并甲型肝炎、丙型肝炎、戊型肝炎等其他肝炎病毒或HIV感染;(3)妊娠前曾应用或妊娠中正在应用任何抗HBV治疗药物(1年前因母婴阻断应用小于半年者除外);(4)有合并其他用药,包括免疫调节剂、激素或细胞毒性药物;(5)有先兆流产或胎儿畸形的表现;(5)肌酐清除率(Ccr)<100 mL/min或存在低磷血症。患者在研究开始前签署知情同意书,本研究符合《赫尔辛基宣言》。
84例妊娠期妇女均于孕24~28周开始口服TDF治疗(葛兰素史克有限公司,300 mg/次、1次/d),按照简单随机化分组方法分为分娩时停药组和产后12周停药组,每组各42例。随访至产后24周,其中18例孕妇因失访或者随访时间不足等被排除,最终66例孕妇纳入研究,其中分娩时停药组35例,产后12周停药组31例。分别在治疗前、治疗4周、治疗8周、分娩时、产后4周、产后8周、产后12周、产后16周、产后24周监测患者的ALT及总胆红素(TBil),在治疗前,分娩时,产后4、12和16周监测患者HBV DNA载量。针对出现ALT和TBil明显异常患者,予以同步监测凝血功能。按照产后是否出现ALT异常分为ALT正常组和ALT异常组,分析产后ALT异常的危险因素。
产后根据自己意愿选择是否母乳喂养。新生儿出生12 h内接种高效价乙型肝炎免疫球蛋白(HBIG)100 IU,同时在不同部位接种10 μg重组酵母乙型肝炎疫苗,在出生1个月及6个月时分别接种第二针和第三针乙型肝炎疫苗。对所有新生儿,于出生后完成全程免疫接种1个月后(约7~12月龄)采集静脉血检测HBsAg、抗-HBs及HBV DNA载量,观察母婴阻断情况。
(1)母婴阻断成功率:新生儿在完成全程免疫接种程序1个月后检测HBsAg阴性、HBV DNA低于检测值下限,判定为HBV母婴阻断成功[9]。(2)产后ALT异常:产后24周内检测至少1次ALT≥2×ULN[10,11]。根据ALT升高水平分为[11] :①轻度异常:2×ULN≤ALT<5×ULN;②中度异常:5×ULN≤ALT<10×ULN;③重度异常:ALT≥10×ULN。
所有指标检测均由杭州市第一人民医院检验中心检测完成,其中生化指标应用日本贝克曼库尔特AU5800全自动生化分析仪(女性ALT正常值上限为40 U/L)、HBV血清学标志物应用美国雅培i2000SR化学发光微粒子免疫检测试剂盒、HBV DNA定量检测采用荧光定量PCR法,试剂购自中山大学达安基因股份有限公司,检测下限为l×102 IU/mL。
采用SPSS 26.0软件进行统计分析。正态分布的计量资料,以 ±s表示,采用t检验;非正态分布的计量资料用中位数(M)和上下四分位数间距(P25,P75)表示,采用秩和检验。计数资料用例(百分数)表示,采用χ2检验。危险因素筛选应用多因素Logistic回归,以P<0.05为差异具有统计学意义。
±s表示,采用t检验;非正态分布的计量资料用中位数(M)和上下四分位数间距(P25,P75)表示,采用秩和检验。计数资料用例(百分数)表示,采用χ2检验。危险因素筛选应用多因素Logistic回归,以P<0.05为差异具有统计学意义。
66例孕妇服药期间依从性良好。两组孕妇年龄、乙型肝炎家族史、分娩史、分娩方式、基线HBsAg水平、HBeAg水平、HBV DNA载量、ALT水平差异均无统计学意义(P值均>0.05),见表1。两组孕妇共分娩66名新生儿,均于出生后12 h内接种HBIG及第1针乙型肝炎疫苗,并于1月龄和6月龄时完成第2、3针乙型肝炎疫苗注射。所有新生儿在完成全程疫苗接种后检测HBsAg均为阴性,HBV DNA载量均低于检测值下限,抗-HBs均为阳性。
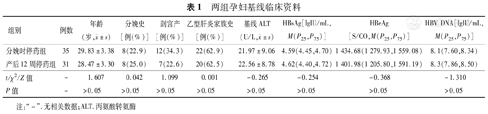
两组孕妇基线临床资料
两组孕妇基线临床资料
| 组别 | 例数 | 年龄(岁, ±s) ±s) | 分娩史[例(%)] | 剖宫产[例(%)] | 乙型肝炎家族史[例(%)] | 基线ALT(U/L, ±s) ±s) | HBsAg[lgIU/mL,M(P25,P75)] | HBeAg[S/CO,M(P25,P75)] | HBV DNA[lgIU/mL,M(P25,P75)] |
|---|---|---|---|---|---|---|---|---|---|
| 分娩时停药组 | 35 | 29.83±3.38 | 8(22.9) | 12(34.3) | 22(62.9) | 21.97±9.06 | 4.59(4.45,4.70) | 1 434.68(1 279.93,1 559.08) | 8.1(7.60,8.34) |
| 产后12周停药组 | 31 | 28.47±3.30 | 8(25.0) | 7(22.6) | 20(62.5) | 22.56±8.78 | 4.62(4.40,4.72) | 1 401.98(1 205.80,1 591.19) | 8.3(7.86,8.50) |
| t/χ2/Z值 | - | 1.607 | 0.042 | 1.099 | 0.001 | -0.265 | -0.254 | -0.368 | -1.310 |
| P值 | - | >0.05 | >0.05 | >0.05 | >0.05 | >0.05 | >0.05 | >0.05 | >0.05 |
注:"-".无相关数据;ALT.丙氨酸转氨酶
两组孕妇分娩时HBV DNA载量均较基线水平下降,差异具有统计学意义(Z=-4.937和-4.860,P值均<0.01);产后12周停药组在产后4周及产后12周HBV DNA均明显低于分娩时停药组,差异具有统计学意义(P值均<0.01),分娩时停药组在产后4周HBV DNA载量基本恢复至基线水平,产后12周停药组在产后16周HBV DNA载量基本恢复至基线水平,差异均无统计学意义(Z=-0.742和-1.891,P值均>0.05),见表2。
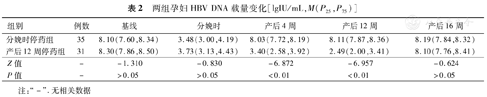
两组孕妇HBV DNA载量变化[lgIU/mL,M(P25,P75)]
两组孕妇HBV DNA载量变化[lgIU/mL,M(P25,P75)]
| 组别 | 例数 | 基线 | 分娩时 | 产后4周 | 产后12周 | 产后16周 |
|---|---|---|---|---|---|---|
| 分娩时停药组 | 35 | 8.10(7.60,8.34) | 3.48(3.00,4.19) | 8.03(7.72,8.19) | 8.11(7.87,8.36) | 8.19(7.84,8.32) |
| 产后12周停药组 | 31 | 8.30(7.86,8.50) | 3.73(3.13,4.43) | 3.40(2.58,3.92) | 2.49(2.00,3.41) | 8.10(7.76,8.41) |
| Z值 | - | -1.310 | -0.830 | -6.872 | -6.957 | -0.624 |
| P值 | - | >0.05 | >0.05 | <0.01 | <0.01 | >0.05 |
注:"-".无相关数据
随访期间,入组的66例患者共有21例出现产后ALT异常,分娩时停药组9例(25.71%,9/35),产后12周停药组12例(38.71%,12/31),两组差异无统计学意义(χ2=1.280,P>0.05)。分娩时停药组9例患者均出现在产后12周内,其中产后4周1例,产后8周6例,产后12周2例;产后12周停药组中,产后4周出现ALT异常3例,产后8周2例,产后12周3例,产后24周4例。两组孕妇产后12周内ALT异常发生率分别为25.71%(9/35)和25.81%(8/31),差异无统计学意义(χ2=0.0001,P>0.05)。进一步分析显示,两组患者产后肝功能异常多以轻度异常为主,且肝功能异常程度分布情况差异无统计学意义(χ2=0.527,P>0.05)(表3)。同时,在整个随访过程中,所有ALT异常患者均未发现TBil明显升高(均<2×ULN)以及凝血功能异常。
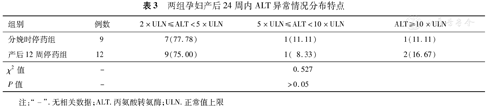
两组孕妇产后24周内ALT异常情况分布特点
两组孕妇产后24周内ALT异常情况分布特点
| 组别 | 例数 | 2×ULN≤ALT<5×ULN | 5×ULN≤ALT<10×ULN | ALT≥10×ULN |
|---|---|---|---|---|
| 分娩时停药组 | 9 | 7(77.78) | 1(11.11) | 1(11.11) |
| 产后12周停药组 | 12 | 9(75.00) | 1( 8.33) | 2(16.67) |
| χ2值 | - | 0.527 | ||
| P值 | - | >0.05 |
注:"-".无相关数据;ALT.丙氨酸转氨酶;ULN.正常值上限
发生轻度ALT异常的患者中两组各有1例患者(ALT峰值分别为197 U/L和162 U/L,HBV DNA载量分别为3.82×108 IU/mL和8.43×107 IU/mL)因反复肝功能异常分别于产后半年和产后1年加用TDF抗病毒治疗,其余患者在指导休息后未予特殊药物处理肝功能均恢复正常。
2例中度ALT异常孕妇中,分娩时停药组患者产后半个月乳腺炎发作,产后4周发现ALT明显升高(ALT为352 U/L,HBV DNA载量为6.85×107 IU/mL),在休息及护肝治疗后仍有肝功能反复异常,最终考虑肝炎活动予以TDF抗病毒治疗;产后12周停药组患者在产后24周出现肝功能异常(ALT为233 U/L,HBV DNA载量为5.90×107 IU/mL),检查前1周休息欠佳,在指导休息后ALT很快恢复正常,且未再出现肝功能反复。
3例重度肝功能异常患者均住院治疗,分娩时停药组患者于产后8周出现ALT异常(ALT为748 U/L,HBV DNA载量为2.14×107 IU/mL),住院护肝治疗后好转,但随访中出现肝功能再次反复,于产后24周予以长期TDF抗病毒治疗;产后12周停药组患者,1例发生在产后8周(ALT峰值为402 U/L,HBV DNA载量<100 IU/mL),抗病毒治疗期间加用护肝药物后肝功能恢复正常直到其产后3个月后继续抗病毒治疗;另1例发生在产后24周的孕妇(ALT峰值为1 028 U/L,HBV DNA载量为1.38×107 IU/mL)在产前服用TDF后4周及产后8周均曾出现短期ALT轻度升高(ALT分别为105 U/L和65 U/L,HBV DNA载量分别为2.28×105 IU/mL和1.71×102 IU/mL),考虑为肝炎活动,予以长期TDF抗病毒治疗联合短期护肝治疗后肝功能恢复正常。
两组在年龄、分娩次数、乙型肝炎家族史、基线HBsAg、HBeAg、HBV DNA水平、分娩方式、产后是否哺乳以及分娩时停药患者比率等方面差异均无明显统计学意义(P值均>0.05),ALT异常组孕期ALT异常率明显高于ALT正常组,分别为23.81%和2.22%,差异具有统计学意义(χ2=8.070,P<0.05),见表4。将孕期ALT异常这项指标进行二分类Logistic回归分析,发现孕期ALT异常与产后出现ALT异常独立相关(OR=13.75,95%CI 1.49~126.85,P<0.05)。
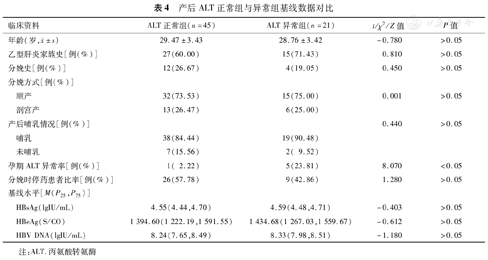
产后ALT正常组与异常组基线数据对比
产后ALT正常组与异常组基线数据对比
| 临床资料 | ALT正常组(n=45) | ALT异常组(n=21) | t/χ2/Z值 | P值 | |
|---|---|---|---|---|---|
年龄(岁, ±s) ±s) | 29.47±3.43 | 28.76±3.42 | -0.780 | >0.05 | |
| 乙型肝炎家族史[例(%)] | 27(60.00) | 15(71.43) | 0.810 | >0.05 | |
| 分娩史[例(%)] | 12(26.67) | 4(19.05) | 0.450 | >0.05 | |
| 分娩方式[例(%)] | |||||
| 顺产 | 32(73.53) | 15(75.00) | 0.001 | >0.05 | |
| 剖宫产 | 13(26.47) | 6(25.00) | |||
| 产后哺乳情况[例(%)] | 0.440 | >0.05 | |||
| 哺乳 | 38(84.44) | 19(90.48) | |||
| 未哺乳 | 7(15.56) | 2( 9.52) | |||
| 孕期ALT异常率[例(%)] | 1( 2.22) | 5(23.81) | 8.070 | <0.05 | |
| 分娩时停药患者比率[例(%)] | 26(57.78) | 9(42.86) | 1.280 | >0.05 | |
| 基线水平[M(P25,P75)] | |||||
| HBsAg(lgIU/mL) | 4.55(4.44,4.70) | 4.59(4.48,4.71) | -0.403 | >0.05 | |
| HBeAg(S/CO) | 1 394.60(1 222.19,1 591.55) | 1 434.68(1 267.03,1 559.67) | -0.612 | >0.05 | |
| HBV DNA(lgIU/mL) | 8.24(7.65,8.49) | 8.33(7.98,8.51) | -1.180 | >0.05 | |
注:ALT.丙氨酸转氨酶
高载量HBV DNA是导致乙型肝炎母婴传播的主要原因[3,12]。TDF是多个指南推荐的阻断HBV母婴传播的一线用药,其安全性及有效性已得到证实[4,5,7,13]。目前HBV母婴阻断停药后的肝炎活动是临床关注的一个主要问题,有研究显示,停药后17.2%~62%的患者可能发生肝炎活动,且多发生在产后24周内[7,14,15],这也是临床上对于产后立即停药的主要顾虑。因此,HBV母婴阻断产后何时停药仍具有争议,目前多个指南推荐HBV母婴阻断于产后1~3个月停药[4,5,6,7],临床工作中也多遵循这一停药原则,但不管是产后1个月还是3个月停药,HBsAg阳性的产妇都可能会失去母乳喂养的机会。在中国,多数母亲有着强烈的母乳喂养愿望,且指南也推荐母乳喂养。在本研究中,产后12周停药的母亲中仍有74.19%(23/31)产后选择母乳喂养。虽然目前指南提出应用TDF时,母乳喂养不是禁忌证[7],但部分产妇仍较介意母乳期间服药。因此在保证母亲停药安全的情况下若能产后立即停药对于母乳喂养有着重要意义。
本研究对比了使用TDF进行HBV母婴阻断分娩时及产后12周停药对产后ALT异常的影响,结果显示,两组孕妇产后肝功能异常发生率及严重程度差异均无统计学意义,提示分娩时停药与产后12周停药对产后肝功能无明显影响。本研究中所有孕妇产后均未出现TBil的明显升高、凝血功能异常等重症肝炎表现,产后ALT最高的1例出现在产后12周停药组,发生于产后24周,此例孕妇在产前及产后服用TDF期间曾反复出现ALT轻度升高,针对这一类孕妇,应酌情考虑是否予以产后长期抗病毒治疗。
进一步分析发现,两组孕妇产后ALT异常均主要出现于产后12周内,尽管在产后12周内产后12周停药组患者仍在继续服用抗病毒药物,HBV DNA载量均维持在低水平,但仍有25.81%(8/31)出现肝功能异常,其中有1例出现重度肝功能异常(ALT 402 U/L,HBV DNA<100 IU/mL),与分娩时停药组相比差异无统计学意义,因此产后12周内不管是否继续服用抗病毒药物,均可能出现肝功能异常,且服用抗病毒药物并未减少肝功能异常发生的概率,这提示产后肝功能异常与是否停用抗病毒药物并无明显关系[15]。对于HBsAg阳性的孕妇,即使产后HBV DNA水平很低甚至检测不到,产后12周服用抗病毒药物期间仍可能出现肝功能明显异常,也就是出现"高酶低病毒"状态,在Lu等[16]以及王晓晓等[17]既往研究中也发现了这种现象,并指出这种现象可能提示患者进入免疫清除期,针对这部分患者予以合适的抗病毒治疗可以取得较好的治疗效果。但目前还缺乏大样本的相关研究,需要进一步验证。此外,目前产后肝功能异常的另一个公认的原因是产后体内激素水平以及免疫情况改变[18,19],因此比起延长产后抗病毒治疗时间,孕期及产后的密切随访对于免疫耐受期的妇女而言更为重要。
孕期ALT异常波动与产后是否出现ALT异常有一定关系,且可能是产后出现ALT异常的独立影响因素,而年龄、病毒因素(基HBsAg/HBeAg水平、HBV DNA水平)、孕产因素(分娩史和分娩方式)等与产后肝功能异常无关,本研究结果与既往相关研究结果一致[11,20,21,22]。因此产前进行密切的肝功能监测对产后肝功能变化情况预测有着重要意义,对于产前出现ALT明显升高的患者产后应慎重停药,并有针对性的进行更加密切的肝功能监测。此外,在临床工作中发现产妇在出现产后肝功能异常时常常存在夜间睡眠欠佳的情况,而其中因哺乳需要频繁起夜是其中一个常见原因,产后ALT正常组与ALT异常组的产后哺乳情况进行比较,结果并无统计学差异,因此产后哺乳并不会增加孕妇产后ALT异常的概率。但由于本研究样本量较小,还需大样本量研究进一步分析证实影响产后ALT异常的相关独立危险因素。
尽管在分娩时立即停药,产后4~8周病毒载量基本会恢复到产前水平,但多个研究证实对进行了预防接种的婴儿进行母乳喂养是安全的[23,24]。本研究中分娩时停药组所分娩的35名新生儿在完成全程疫苗接种后检测HBsAg、HBV DNA均为阴性,也证实分娩时停药进行母乳喂养是安全的。
综上所述,本研究证实对于HBsAg、HBeAg阳性且HBV DNA≥2×106 IU/mL的免疫耐受期孕妇,在妊娠24~28周开始应用TDF进行HBV母婴阻断,产后不同时间停药对产后肝功能无明显影响,分娩时停药不会增加患者产后出现肝酶异常的风险。孕期ALT异常波动是产后肝功能异常的一项独立危险因素,针对孕期出现ALT异常的患者,产后应谨慎停药,且产后需密切监测肝功能,建议产后3个月内每月监测一次,随后每3个月监测一次。因本文样本量有限,仍需进一步大样本多中心的临床研究进一步验证。
所有作者均声明不存在利益冲突



























