
探讨核苷(酸)类似物治疗乙型肝炎肝硬化代偿期患者HBsAg消失后停药的安全性。
收集2008年1月至2020年12月于台州医院、台州市立医院、台州恩泽医院使用核苷(酸)类药物治疗的3 783例乙型肝炎肝硬化代偿期患者中85例HBsAg消失后停药或继续用药患者在HBsAg消失时及随访48个月的丙氨酸转氨酶(ALT)、HBV血清学标志物、HBV DNA载量及影像学资料,并进行回顾性研究。采用χ2检验和秩和检验对数据进行统计学分析。
85例患者中停药36例,继续用药49例。两组患者HBsAg消失时,随访24和48个月时,ALT水平均在正常范围内;停药组抗-HBs阳性率与继续用药组相比差异均无统计学意义(χ2=0.75、0.39和0.90,P=0.78、0.84和0.34)。HBeAg阳性率与继续用药组相比差异亦无统计学意义(χ2=0.40、0.00和0.00,P=0.84、1.00和1.00)。随访48个月时,停药组原发性肝癌发生2例,继续用药组无原发性肝癌发生,两组比较差异无统计学意义(χ2=0.89,P=0.34)。整个随访中,HBsAg均为阴性,HBV DNA载量均低于检测下限。
乙型肝炎肝硬化代偿期患者HBsAg消失后可考虑停用核苷(酸)类似物。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
乙型肝炎病毒(Hepatitis B virus,HBV)感染相关疾病是一个全球性的公共卫生问题,严重威胁了人类健康[1]。核苷(酸)类似物是治疗HBV感染相关疾病的最主要药物,中国《慢性乙型肝炎防治指南》(2019版)和美国肝病研究学会(AASLD)、欧洲肝病研究学会(EASL)和亚太肝病研究学会(APASL)等国际指南,推荐慢性乙型肝炎患者使用核苷(酸)类似物治疗HBsAg消失且HBV DNA检测不到后停药随访[2,3,4,5]。对乙型肝炎肝硬化代偿期使用核苷(酸)类似物治疗后HBsAg消失且HBV DNA检测不到是否停药目前国内外指南意见不一,AASLD及APASL指南认为HBsAg消失且HBV DNA检测不到可考虑停药[3,5],中国指南认为肝硬化代偿期患者需要长期用药[2],对于HBsAg消失且HBV DNA检测不到的此类患者是否停药未有明确建议。本研究收集核苷(酸)类似物治疗乙型肝炎肝硬化代偿期患者HBsAg消失后停药或继续用药患者的临床资料进行回顾性研究,现报道如下。
收集2008年1月至2020年12月在台州医院、台州市立医院、台州恩泽医院诊治的3 783例乙型肝炎肝硬化代偿期患者接受核苷(酸)类似物治疗HBsAg消失后停药或继续用药患者的临床资料。初始分别应用拉米夫定、阿德福韦酯、恩替卡韦、替诺福韦口服药物治疗,以后根据病毒学是否完全应答以及不良反应的情况,改用恩替卡韦、替诺福韦、丙酚替诺福韦治疗。肝硬化代偿期诊断标准按照《慢性乙型肝炎防治指南(2019版)》[2],即所有患者腹部CT或MRI征象符合肝硬化且不伴有腹水、食管胃底静脉出血、肝性脑病等严重并发症。肝功能分级为Child-Push A级(白蛋白≥35 g/L,总胆红素<35 μmol/L,凝血酶原活动度>60%)[6],其中5例患者行肝脏穿刺活检,组织病理学分期为G2~G4S4。共有85例患者符合入选标准:(1)年龄30~80岁;(2)HBsAg消失;(3)HBV DNA低于检测值下限。
(1)肝硬化失代偿患者;(2)原发性肝癌患者;(3)合并其他肝炎病毒者。
HBV DNA >20 IU/mL,伴(或)不伴HBsAg阳性,ALT>1×正常值上限(ULN)值。
观察患者HBsAg消失时、随访24、48个月时丙氨酸转氨酶(ALT)、甲胎蛋白(AFP)、HBV血清学标志物、HBV DNA、肝脏影像学表现。肝功能采用日立7600全自动生化分析仪(日本株式会社日立高新技术公司)及配套试剂检测。HBsAg、抗-HBs、HBeAg定量检测采用化学发光微粒子免疫分析法,ARCHITECT12000型全自动免疫分析仪及配套试剂购自美国雅培公司,阳性结果判定标准:HBsAg≥0.05 IU/mL、抗-HBs ≥10.00 mIU/mL、HBeAg≥1.00 S/CO者判为阳性。HBV DNA采用罗氏lightcycle基因荧光定量分析仪,试剂盒购自苏州新波生物技术有限公司。肝弹性超声值采集于海斯凯尔Fibrotouch 100(无锡海斯凯尔医学技术有限公司)。
使用SPSS 25.0软件进行分析,正态分布的计量资料以 ±s表示,采用t检验;非正态分布的计量资料用中位数(M)和上下四分位数(Q1,Q3)表示,采用秩和检验;计数资料比较采用χ2检验,P<0.05具有统计学意义。
±s表示,采用t检验;非正态分布的计量资料用中位数(M)和上下四分位数(Q1,Q3)表示,采用秩和检验;计数资料比较采用χ2检验,P<0.05具有统计学意义。
85例乙型肝炎肝硬化代偿期HBsAg消失患者,停药组36例,女性5例,男性31例,年龄(56.7±10.4)岁;继续用药组49例,女性9例,男性40例,年龄(58.0±10.7)岁;两组患者年龄和性别差异无统计学意义(t=-0.56,χ2=0.30,P值均为0.58)。停药组HBsAg消失时中位用药时间为51.0(33.8~69.8)个月,继续用药组中位用药时间为55.0(36.0~80.5)个月,两组用药时间差异无统计学意义(Z=-0.59,P>0.05)。
停药组和继续用药组ALT水平均在正常值范围内,两组抗-HBs阳性率差异无统计学意义(χ2=0.75,P=0.78);停药组HBeAg阳性例数3例(检测值1.01~1.05 S/CO),继续用药组2例(检测值1.03~1.10 S/CO),两组HBeAg阳性率差异无统计学意义(χ2=0.40,P=0.84)(表1)。
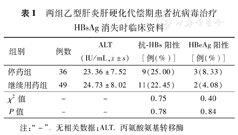
两组乙型肝炎肝硬化代偿期患者抗病毒治疗HBsAg消失时临床资料
两组乙型肝炎肝硬化代偿期患者抗病毒治疗HBsAg消失时临床资料
| 组别 | 例数 | ALT(IU/mL, ±s) ±s) | 抗-HBs阳性[例(%)] | HBeAg阳性[例(%)] |
|---|---|---|---|---|
| 停药组 | 36 | 23.36±7.52 | 9(25.00) | 3(8.33) |
| 继续用药组 | 49 | 24.73±8.02 | 11(22.45) | 2(4.08) |
| χ2值 | - | - | 0.75 | 0.40 |
| P值 | - | - | 0.78 | 0.84 |
注:"-".无相关数据;ALT.丙氨酸氨基转移酶
停药组和继续用药组患者ALT水平均在正常值范围内;两组HBsAg均阴性,HBV DNA载量均<20 IU/mL。两组抗-HBs阳性率、HBeAg阳性率差异均无统计学意义(χ2=0.39和0.00,P=0.84和1.00)(表2)。
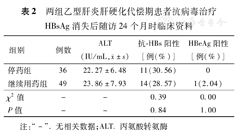
两组乙型肝炎肝硬化代偿期患者抗病毒治疗HBsAg消失后随访24个月时临床资料
两组乙型肝炎肝硬化代偿期患者抗病毒治疗HBsAg消失后随访24个月时临床资料
| 组别 | 例数 | ALT(IU/mL, ±s) ±s) | 抗-HBs阳性[例(%)] | HBeAg阳性[例(%)] |
|---|---|---|---|---|
| 停药组 | 36 | 22.27±6.48 | 11(30.56) | 0 |
| 继续用药组 | 49 | 23.86±7.93 | 14(28.57) | 1(2.04) |
| χ2值 | - | - | 0.39 | 0.00 |
| P值 | - | - | 0.84 | 1.00 |
注:"-".无相关数据;ALT.丙氨酸转氨酶
停药组和继续用药组患者ALT水平均在正常值范围内;两组HBsAg均阴性,HBV DNA载量均<20 IU/mL。两组抗-HBs阳性率和HBeAg阳性率差异无统计学意义(χ2=0.90和0.00,P=0.34和1.00)(表3)。
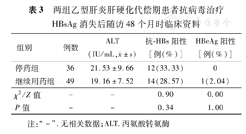
两组乙型肝炎肝硬化代偿期患者抗病毒治疗HBsAg消失后随访48个月时临床资料
两组乙型肝炎肝硬化代偿期患者抗病毒治疗HBsAg消失后随访48个月时临床资料
| 组别 | 例数 | ALT(IU/mL, ±s) ±s) | 抗-HBs阳性[例(%)] | HBeAg阳性[例(%)] |
|---|---|---|---|---|
| 停药组 | 36 | 21.53±9.66 | 12(33.33) | 0 |
| 继续用药组 | 49 | 19.16±7.52 | 14(28.57) | 1(2.04) |
| χ2/Z值 | - | - | 0.90 | 0.00 |
| P值 | - | - | 0.34 | 1.00 |
注:"-".无相关数据;ALT.丙氨酸转氨酶
停药组发生原发性肝癌2例,继续用药组未发生原发性肝癌,两组差异无统计学意义(χ2=0.89,P=0.34)。停药组和继续用药组肝弹性超声值分别为7.60(4.93,17.03)和7.90(4.77,23.60)kPa,差异亦无统计学意义(Z=4.49,P=0.65)。
肝硬化代偿期是指肝硬化早期,不伴有严重并发症,肝功能为Child-Pugh A级[6]。肝炎是引起肝硬化最常见病因之一[7]。既往认为乙型肝炎肝硬化是自然进展、不可逆的过程[8],近来越来越多的证据表明长期抗病毒治疗可能逆转肝硬化,改善肝纤维化程度[9,10,11,12],我们前期研究证明代偿期乙型肝炎肝硬化患者经过长期抗病毒治疗后临床指标和肝脏组织学均能得到改善[13],Grossi等[14,15,16]的研究结果也提示口服核苷(酸)类似物治疗乙型肝炎肝硬化可改善肝纤维化程度。乙型肝炎肝硬化代偿期患者目前使用的口服抗病毒药物主要是核苷(酸)类似物,包括拉米夫定、阿德福韦、恩替卡韦、替诺福韦、丙酚替诺福韦等[17],但由于药物不良反应、耐药、经济因素及用药依从性等原因,停药问题日渐突出,需要进一步研究。
HBsAg消失是慢性乙型肝炎停药指标[2,18,19],但是对于乙型肝炎肝硬化代偿期患者HBsAg消失是否可以停药尚无定论。本研究选择核苷(酸)类似物治疗乙型肝炎肝硬化代偿期HBsAg消失停药患者,随访24、48个月时无一例患者ALT水平发生异常、HBV DNA载量亦检测不到,可能与HBsAg消失后达到临床治愈后,HBV DNA停止复制,ALT正常,达到了免疫控制[20]。本研究停药组、继续用药组HBsAg消失时仍有5例患者HBeAg阳性,但检测值仅比检测下限略高,推测可能与检测方法比较敏感有关。
由于肝穿刺活检为有创检查,以及方法的局限性,近年来无创性肝纤维化评估被指定并纳入肝病管理指南,瞬时弹性成像进行肝硬度测量是目前临床上应用最广泛的用于评估肝纤维化的非侵入性方法之一,已被认为是预测晚期肝纤维化或肝硬化的准确且可重复的方法[21,22],根据我国《慢性乙型肝炎防治指南》(2019版)中对于肝弹性超声数值的相关界定,即>21.3 kPa为乙肝肝硬化、<8.2 kPa排除肝硬化、<5.8 kPa排除进展期肝纤维化[2]。国内大样本研究结果显示,瞬时肝弹性成像能够确定和评估乙型肝炎肝硬化及观察肝纤维化进展情况[23,24]。本研究中停药组患者肝弹性超声数值中位数为7.60 kPa,提示乙型肝炎肝硬化代偿期患者通过口服核苷(酸)类似物抗病毒治疗,患者肝脏纤维化程度明显减轻甚至发生肝硬化逆转,所以乙型肝炎肝硬化患者使用核苷(酸)类似物治疗HBsAg消失后,可参考慢性乙型肝炎患者停药标准,即HBsAg消失且HBV DNA检测不到后,予停止抗病毒治疗。
中国原发性肝癌大多与乙型肝炎肝硬化相关,乙型肝炎肝硬化患者使用核苷(酸)类似物治疗后可降低原发性肝癌的发生率[14,25]。但Chu等[26]研究指出乙型肝炎肝硬化患者,即使HBsAg消失,仍有可能发生肝癌,但发生率较低。本研究停药组在随访48个月期间有2例发生了原发性肝癌,继续用药组在随访48个月期间无原发性肝癌发生,两组肝癌发生率差异无统计学意义。因此,对于使用核苷(酸)类似物治疗乙型肝炎肝硬化代偿期患者HBsAg消失,无论是否停药均需要定期随访,以便于早期发现原发性肝癌。
乙型肝炎肝硬化代偿期患者抗病毒治疗的目的是防止肝硬化失代偿以及原发性肝癌的发生,本研究中HBsAg消失后停用核苷(酸)类似物患者随访期间无一例出现肝功能的恶化和HBV DNA突破,部分患者还出现了HBsAg的血清学转换。由于本研究为回顾性研究,停止抗病毒治疗的患者数据有限,无肝脏穿刺肝硬化病理证明肝硬化代偿期均发生逆转,未统计归纳使用某一药物治疗的具体患者数目等,使本研究可能存在一定的局限性。
总之,乙型肝炎肝硬化代偿期患者口服核苷(酸)类似物HBsAg消失后,停药组与继续用药组患者在48个月随访期间HBsAg持续阴性,部分患者还出现了HBsAg的血清学转换,ALT、HBV DNA、原发性肝癌发生等方面在统计学上无明显差异,因此认为乙型肝炎肝硬化代偿期患者HBsAg消失后可考虑停用核苷(酸)类似物。
所有作者均声明不存在利益冲突



























