
对比来迪派韦/索磷布韦(Ledipasvir/sofosbuvir,LDV/SOF)与艾尔巴韦/格拉瑞韦(Elbasvir/grazoprevir,EBR/GZR)治疗初治慢性丙型肝炎(Chronic hepatitis C,CHC)患者的临床疗效及安全性。
回顾性分析2020年1月至2021年12月在湖州市中心医院诊治的143例基因1b型CHC初治患者临床资料,根据治疗方案的不同分为LDV/SOF组(n=74)和EBR/GZR组(n=69),比较两组患者治疗4、12周及停药后12周的病毒学应答情况,以及治疗前后的血清学和肝脏炎症指标等。采用SPSS 25.0软件对数据进行统计学分析。
治疗4、12周及治疗结束后12周时,LDV/SOF组和EBR/GZR组的病毒学应答率分别为97.30%和98.55%,98.65%和100.00%,97.30%和98.55%,两组差异均无统计学意义(P>0.05)。治疗终点时,两组患者肝脏炎症指标丙氨酸转氨酶、天冬氨酸转氨酶、γ-谷氨酰转肽酶均明显低于治疗基线水平(Z=-7.470和-6.974,-9.757和-6.832,-3.578和-4.054,P<0.01);两组各项指标对比差异均无统计学意义(P>0.05)。两组患者的不良反应均轻微,无严重不良事件发生。
LDV/SOF和EBR/GZR治疗基因1b型初治CHC患者均具有较好的临床疗效,耐受性良好。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
丙型肝炎病毒(Hepatitis C virus,HCV)感染是引起全球慢性肝病的主要原因之一,仅有约15%~25%的急性感染者可发生病毒的自发清除,其余感染者则逐步进展为肝纤维化、肝硬化,甚至肝细胞癌(Hepatocellular carcinoma,HCC)[1]。强有效的抗病毒治疗是延缓慢性丙型肝炎(Chronic hepatitis C,CHC)病情进展,降低HCV相关肝硬化及肝癌发生率的关键[2]。直接抗病毒药物(Direct-acting antiviral agents,DAAs)的上市和广泛应用对CHC抗病毒治疗而言是重大发展,我国2019年《丙型肝炎防治指南》[3]推荐来迪派韦/索磷布韦(Ledipasvir/sofosbuvir,LDV/SOF)与艾尔巴韦/格拉瑞韦(Elbasvir/grazoprevir,EBR/GZR)作为基因1b型CHC抗病毒的首选治疗方案,且这两种方案均进入了我国国家医保目录。DAAs不仅表现出较佳的疗效,还具有全口服给药、疗程短及不良反应少等优点,也为有干扰素治疗禁忌的失代偿期肝硬化患者带来了更多治疗选择。但是在实际临床应用中,我国临床应用DAAs抗HCV治疗时间尚短,DAAs治疗慢性HCV感染者持续病毒学应答情况以及合并不同基础疾病对治疗安全性的影响仍是值得探讨的问题,目前对DAAs远期疗效和安全性的研究尚较少。且有研究发现尽管患者的HCV RNA被清除,但CHC相关肝硬化患者仍有发生HCC及终末期肝病的风险[4,5]。目前鲜见关于LDV/SOF对比EBR/GZR治疗中国人群CHC的研究。故本研究通过分析这两种治疗方案治疗基因1b型CHC初治患者的疗效,旨在为临床治疗CHC提供一定的参考依据。
收集2020年1月至2021年12月在湖州市中心医院感染科诊治的143例基因1b型CHC患者,所有患者均符合《丙型肝炎防治指南(2019年版)》中CHC的诊断标准[3]。纳入标准:(1)年龄≥18岁;(2)HCV感染时间>6个月,抗HCV阳性,血清HCV RNA≥15 IU/mL,经血清学检测确诊为基因1b型;(3)既往未使用任何抗HCV药物治疗;(4)无LDV/SOF或EBR/GZR禁忌证。肝硬化诊断需综合考虑病因、病史、临床表现、并发症、治疗过程、检验、影像学及组织学等检查[6]。代偿期肝硬化的诊断标准(下列四条之一)[6]:(1)组织学符合肝硬化诊断;(2)内镜显示食管胃静脉曲张或消化道异位静脉曲张,除外非肝硬化性门脉高压;(3)B超、肝硬度值(LSM)或CT等影像学检查提示肝硬化或门脉高压特征:如脾大、门静脉≥1.3 cm,LSM测定符合不同病因的肝硬化诊断界值;(4)无组织学、内镜或影像学检查者,以下检查指标异常提示存在肝硬化(需符合4条中2条):①血小板(PLT)<100×109/L,且无其他原因可以解释;②血清白蛋白(Alb)<35 g/L,排除营养不良或肾脏疾病等其他原因;③国际标准化比值(INR)>1.3或凝血酶原时间(PT)延长(停用溶栓或抗凝药7 d以上);④天冬氨酸转氨酶(AST)/PLT比率指数(APRI):成人APRI评分>2[6]。失代偿期肝硬化的诊断依据:在肝硬化基础上,出现门脉高压并发症和(或)肝功能减退。①具备肝硬化的诊断依据;②出现门脉高压相关并发症:如腹水、食管胃静脉曲张破裂出血、脓毒症、肝性脑病、肝肾综合征等[6]。排除标准:(1)合并HIV或HBV等感染,原发性肝癌、肝移植、严重心律失常、停药治疗者;(2)合并酒精性肝病、药物性肝损伤、自身免疫性肝病患者;(3)妊娠、哺乳期、治疗期间有生育要求者;(4)正在服用与DAAs存在潜在药物间相互作用的其他药物者,如苯妥英钠、卡马西平等;(5)不能严格依从治疗方案进行随访者。根据患者不同治疗方案分为LDV/SOF(商品名:夏帆宁,吉利德制药有限责任公司)组(74例)和EBR/GZR(商品名:择必达,默沙东制药有限责任公司)组(69例)。LDV/SOF治疗方案:LDV/SOF 90 mg/400 mg,1片/次,1次/d,疗程为12周,肝硬化患者疗程延长为24周。EBR/GZR治疗方案:EBR/GZR 50 mg/100 mg,1片/次,1次/d,疗程为12周,代偿期肝硬化患者疗程延长为24周。该研究符合《赫尔辛基宣言》研究要求。
(1)抗病毒治疗前和治疗结束后患者的血红蛋白、PLT计数、丙氨酸转氨酶(ALT)、AST、碱性磷酸酶(AKP)、γ-谷氨酰转肽酶(GGT)、总胆红素(TBil)、直接胆红素(DBil)、Alb、血肌酐、INR和甲胎蛋白(AFP)、LSM。(2)抗病毒治疗前、治疗4、12周、(肝硬化患者为治疗24周)、停药后12周的HCV RNA载量。随访时间截止2022年3月31日。
使用Cobras TaqMan HCV试剂盒(Roche Diagnostics,Indianapolis,IN,USA)检测血清或血浆中的HCV RNA,定量下限为15 IU/mL。通过影像学方法或肝脏弹性测定肝纤维化程度。肝纤维化无创检测所用仪器为法国Echosens公司的FibroScan 502,由专职人员操作,检测患者肝脂肪含量和LSM。
病毒学应答:采用敏感检测方法(检测下限≤15 IU/mL)检测血清或血浆HCV RNA检测不到。12周持续病毒学应答(SVR12):抗病毒治疗结束后12周,采用敏感检测方法(检测下限≤15 IU/mL)检测血清或血浆HCV RNA检测不到[3]。
记录患者的合并疾病及用药情况,在治疗和随访期间监测所有不良事件,并及时记录发生和处理情况。
采用SPSS 25.0软件进行统计学分析。呈正态分布的计量资料用 ±s表示,两组间比较采用t检验;呈偏态分布的计量资料以中位数(M)和上下四分位数(Q1,Q3)表示,采用非参数检验配对样本比较的Wilcoxon符号秩和检验或独立样本比较Mann Whitney U检验分析两组间的差异。计数资料以例(百分数)表示,采用χ2检验或Fisher精确检验。以P<0.05为差异有统计学意义。
±s表示,两组间比较采用t检验;呈偏态分布的计量资料以中位数(M)和上下四分位数(Q1,Q3)表示,采用非参数检验配对样本比较的Wilcoxon符号秩和检验或独立样本比较Mann Whitney U检验分析两组间的差异。计数资料以例(百分数)表示,采用χ2检验或Fisher精确检验。以P<0.05为差异有统计学意义。
两组患者在年龄、性别、基础疾病、HCV RNA、ALT、AST、TBil及DBil等基线水平方面比较,差异均无统计学意义(P值>0.05),见表1。LDV/SOF组肝硬化患者26例(35.14%),其中代偿期14例,失代偿期12例;EBR/GZR组肝硬化患者20例,均为代偿期。
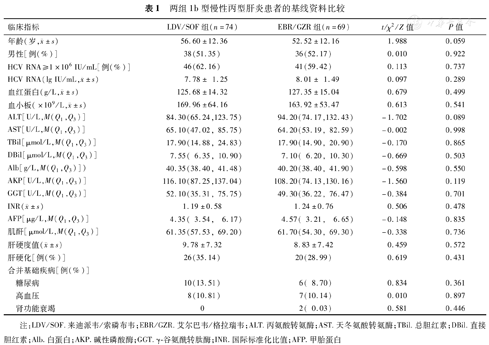
两组1b型慢性丙型肝炎患者的基线资料比较
两组1b型慢性丙型肝炎患者的基线资料比较
| 临床指标 | LDV/SOF组(n=74) | EBR/GZR组(n=69) | t/χ2/Z值 | P值 | |
|---|---|---|---|---|---|
年龄(岁, ±s) ±s) | 56.60±12.36 | 52.52±12.16 | 1.988 | 0.059 | |
| 男性[例(%)] | 38(51.35) | 36(52.17) | 0.010 | 0.922 | |
| HCV RNA≥1×106 IU/mL[例(%)] | 46(62.16) | 41(59.42) | 0.113 | 0.737 | |
HCV RNA(lg IU/mL, ±s) ±s) | 7.78± 1.25 | 8.01± 1.49 | 0.097 | 0.289 | |
血红蛋白(g/L, ±s) ±s) | 125.68±14.32 | 127.35±15.04 | 0.679 | 0.499 | |
血小板(×109/L, ±s) ±s) | 169.96±64.16 | 163.92±53.47 | 0.613 | 0.541 | |
| ALT[U/L,M(Q1,Q3)] | 84.30(65.24,123.75) | 94.20(74.17,132.43) | -1.702 | 0.089 | |
| AST[U/L,M(Q1,Q3)] | 65.10(47.02, 85.75) | 64.20(53.19, 82.59) | -0.002 | 0.998 | |
| TBil[μmol/L,M(Q1,Q3)] | 17.90(14.88, 24.83) | 17.90(14.90, 20.90) | -0.170 | 0.865 | |
| DBil[μmol/L,M(Q1,Q3)] | 7.55( 6.35, 10.90) | 7.10( 6.20, 10.30) | -0.669 | 0.503 | |
| Alb[g/L,M(Q1,Q3)]) | 40.35(38.40, 41.48) | 40.20(38.40, 41.90) | -0.598 | 0.550 | |
| AKP[U/L,M(Q1,Q3)] | 116.10(87.25,137.04) | 108.20(74.13,130.16) | -1.560 | 0.119 | |
| GGT[U/L,M(Q1,Q3)] | 52.10(35.31, 75.75) | 49.30(36.22, 76.47) | -0.384 | 0.701 | |
INR( ±s) ±s) | 1.19±0.58 | 1.24±0.76 | 0.506 | 0.478 | |
| AFP[μg/L,M(Q1,Q3)] | 4.35( 3.54, 6.17) | 4.57( 3.21, 6.65) | -0.148 | 0.835 | |
| 肌酐[μmol/L,M(Q1,Q3)] | 61.35(57.53, 69.20) | 61.70(54.30, 69.30) | -0.338 | 0.736 | |
肝硬度值( ±s) ±s) | 9.78±7.32 | 8.83±7.42 | 0.459 | 0.572 | |
| 肝硬化[例(%)] | 26(35.14) | 20(28.99) | 0.619 | 0.431 | |
| 合并基础疾病[例(%)] | |||||
| 糖尿病 | 10(13.51) | 6( 8.70) | 0.834 | 0.361 | |
| 高血压 | 8(10.81) | 7(10.14) | 0.010 | 0.897 | |
| 肾功能衰竭 | 0 | 2( 0.03) | 0.581 | 0.446 | |
注:LDV/SOF.来迪派韦/索磷布韦;EBR/GZR.艾尔巴韦/格拉瑞韦;ALT.丙氨酸转氨酶;AST.天冬氨酸转氨酶;TBil.总胆红素;DBil.直接胆红素;Alb.白蛋白;AKP.碱性磷酸酶;GGT.γ-谷氨酰转肽酶;INR.国际标准化比值;AFP.甲胎蛋白
治疗4、12周及治疗结束后12周时,LDV/SOF组和EBR/GZR组的病毒学应答率分别为97.30%和98.55%,98.65%和100.00%,97.30%和98.55%,两组差异均无统计学意义(P值>0.05),见表2。
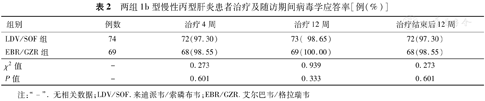
两组1b型慢性丙型肝炎患者治疗及随访期间病毒学应答率[例(%)]
两组1b型慢性丙型肝炎患者治疗及随访期间病毒学应答率[例(%)]
| 组别 | 例数 | 治疗4周 | 治疗12周 | 治疗结束后12周 |
|---|---|---|---|---|
| LDV/SOF组 | 74 | 72(97.30) | 73( 98.65) | 72(97.30) |
| EBR/GZR组 | 69 | 68(98.55) | 69(100.00) | 68(98.55) |
| χ2值 | - | 0.273 | 0.939 | 0.273 |
| P值 | - | 0.601 | 0.333 | 0.601 |
注:"-".无相关数据;LDV/SOF.来迪派韦/索磷布韦;EBR/GZR.艾尔巴韦/格拉瑞韦
治疗终点时(非肝硬化患者为12周,肝硬化患者为24周),两组患者肝脏炎症指标ALT、AST、GGT均明显低于治疗基线水平,差异有统计学意义(Z=-7.470和-6.974,-9.757和-6.832,-3.578和-4.054,P<0.01);两组血清ALT、AST、GGT、AKP、TBil、Alb、肌酐、血红蛋白、血小板计数、LSM对比,差异均无统计学意义(P>0.05),见表3。
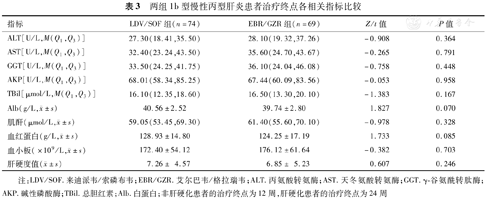
两组1b型慢性丙型肝炎患者治疗终点各相关指标比较
两组1b型慢性丙型肝炎患者治疗终点各相关指标比较
| 指标 | LDV/SOF组(n=74) | EBR/GZR组(n=69) | Z/t值 | P值 |
|---|---|---|---|---|
| ALT[U/L,M(Q1,Q3)] | 27.30(18.41,35.50) | 28.10(19.32,37.26) | -0.908 | 0.364 |
| AST[U/L,M(Q1,Q3)] | 32.40(23.24,43.50) | 35.60(24.70,43.67) | -0.265 | 0.791 |
| GGT[U/L,M(Q1,Q3)] | 33.50(24.25,41.75) | 36.10(24.04,46.08) | -0.758 | 0.448 |
| AKP[U/L,M(Q1,Q3)] | 68.01(58.34,85.25) | 67.44(60.09,83.56) | -0.053 | 0.958 |
| TBil[μmol/L,M(Q1,Q3)] | 16.10(12.35,18.60) | 16.50(13.30,20.10) | -1.383 | 0.167 |
Alb(g/L, ±s) ±s) | 40.56±2.52 | 39.74±2.80 | 1.827 | 0.070 |
肌酐(μmol/L, ±s) ±s) | 59.05(53.45,69.30) | 61.40(55.60,70.10) | -0.978 | 0.328 |
血红蛋白(g/L, ±s) ±s) | 128.93±14.80 | 124.25±17.19 | 1.733 | 0.085 |
血小板(×109/L, ±s) ±s) | 172.40±54.12 | 176.12±61.64 | -0.382 | 0.703 |
肝硬度值( ±s) ±s) | 7.26± 4.57 | 6.85± 5.23 | 0.607 | 0.246 |
注:LDV/SOF.来迪派韦/索磷布韦;EBR/GZR.艾尔巴韦/格拉瑞韦;ALT.丙氨酸转氨酶;AST.天冬氨酸转氨酶;GGT.γ-谷氨酰转肽酶;AKP.碱性磷酸酶;TBil.总胆红素;Alb.白蛋白;非肝硬化患者的治疗终点为12周,肝硬化患者的治疗终点为24周
治疗期间,LDV/SOF组17例(22.97%)发生不良事件,EBR/GZR组13例(18.84%)发生不良事件,均无严重不良事件发生,两组不良事件发生率比较差异无统计学意义(χ2=0.368,P=0.544)。LDV/SOF组主要不良事件为疲乏(6.76%)、食欲下降或恶心(4.05%)、轻微头痛或头晕(4.05%)及血压升高(4.05%)等;EBR/GZR组主要不良事件为疲乏(5.80%)和食欲下降或恶心(4.35%)等,见表4。
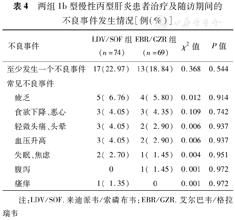
两组1b型慢性丙型肝炎患者治疗及随访期间的不良事件发生情况[例(%)]
两组1b型慢性丙型肝炎患者治疗及随访期间的不良事件发生情况[例(%)]
| 不良事件 | LDV/SOF组(n=74) | EBR/GZR组(n=69) | χ2值 | P值 | |
|---|---|---|---|---|---|
| 至少发生一个不良事件 | 17(22.97) | 13(18.84) | 0.368 | 0.544 | |
| 常见不良事件 | |||||
| 疲乏 | 5( 6.76) | 4( 5.80) | 0.012 | 0.914 | |
| 食欲下降、恶心 | 3( 4.05) | 3( 4.35) | 0.109 | 0.742 | |
| 轻微头痛、头晕 | 3( 4.05) | 2( 2.90) | 0.006 | 0.937 | |
| 血压升高 | 3( 4.05) | 2( 2.90) | 0.006 | 0.937 | |
| 失眠、焦虑 | 2( 2.70) | 1( 1.45) | 0.004 | 0.951 | |
| 腹泻 | 0 | 1( 1.45) | 0.001 | 0.972 | |
| 瘙痒 | 1( 1.35) | 0 | 0.001 | 0.972 | |
注:LDV/SOF.来迪派韦/索磷布韦;EBR/GZR.艾尔巴韦/格拉瑞韦
治疗终点时,两组肝硬化患者的临床症状均较前明显减轻,其中12例肝硬化失代偿期患者腹水较前明显减退,Alb升高,肝功能好转,患者腹胀、纳差等症状明显减轻,有6例Child-Puch评分由C级变为B级。肝硬化患者SVR12率为95.65%,其中有1例肝硬化失代偿期患者实现了SVR12,继续随访第9个月时发现弥漫性大B细胞淋巴瘤,因患者一般情况极差未给予化疗。另1例肝硬化失代偿期患者实现了SVR12,但继续随访第10个月时发现胰腺恶性肿瘤,于外院行胰腺手术切除术,术后行多次化疗及靶向治疗,目前随访患者一般情况良好。
2例合并肾功能衰竭的CHC患者在行血液透析的同时使用EBR/GZR抗病毒治疗,2例患者均获得SVR12。
自2017年以来,多种DAAs相继在我国上市,对我国HCV感染治疗具有重大进展。与利巴韦林联合聚乙二醇干扰素治疗方案相比,DAAs口服给药更加方便,疗程短,耐受性更好,且抗HCV治疗的SVR率超过95%[3],有利于推进我国"消除丙型肝炎"行动计划的早日实现。研究发现,SVR与改善肝脏功能和总体生存率相关,同时还与减少肝硬化并发症和肝外HCV相关表现有关[5]。LDV/SOF和EBR/GZR作为新一代的DAAs,均可用于治疗基因1型的CHC患者[7]。本研究中,采用LDV/SOF和EBR/GZR治疗基因1b型CHC患者的SVR12率分别为97.30%和98.55%,同Afdhal等[8]和Wei等[9]结果一致,两组比较差异无统计学意义,两种治疗方案临床疗效相当。一项纳入224例应用EBR/GZR治疗HCV合并慢性肾脏病4期(CKD4期)(其中76%是血液透析患者)的随机试验研究发现,94%的患者实现了SVR12,其中6例患者因病毒学失败以外的原因停止治疗[10],本研究中的2例合并肾衰竭患者研究结果与之一致,体现了EBR/GZR在治疗HCV合并终末期肾病患者中的有效性和良好耐受性。
本研究发现,治疗4、12周时,LDV/SOF组和EBR/GZR组均表现出较高的病毒学应答率(>95.00%)。治疗终点时,两组患者的血清生化学指标和LSM均较治疗前明显好转,两组肝硬化患者的临床症状亦明显减轻,表明抗病毒治疗对血清生化学、肝纤维化和临床症状有较明显的改善作用。
CHC患者往往合并其他疾病,常见疾病为糖尿病、高血压等,合并用药主要为降糖、降压等药物,DAAs与其他不同合并症用药存在潜在的相互作用,直接影响治疗效果并增加不良事件的频率和严重程度,甚至可能导致CHC的治疗失败,因此在选择用药时需引起关注[11,12,13]。German等[14]对LDV/SOF的临床药代动力学和药效学研究发现,LDV/SOF表现出良好的临床药理学特征,对于有不同程度的肝功能损害或轻度至中度肾功能损害的HCV感染患者,每天服用一次不需要调整剂量。与其他合并用药方案相比,EBR/GZR在合并应用2类需监测药物和3类禁忌药物中的药物相互作用风险最小[15]。本研究中,两组合并使用治疗糖尿病、高血压等药物均未发现明显的药物间相互作用。
本研究中LDV/SOF和EBR/GZR组各有17例和13例发生药物不良反应,表现轻微,主要不良反应为疲乏、食欲下降、恶心等,两组患者均无严重的不良事件,也没有因不良事件而中断或终止治疗。目前,LDV/SOF和EBR/GZR均已进入国家医疗保险目录,在药品价格进一步下降后,与其他DAAs相比,两者经济学优势也较为明显[16]。然而,也有研究发现尽管通过直接抗病毒治疗可能根除HCV感染,但HCC的风险仍然存在,其机制可能与DAAs迅速清除HCV,导致体内因HCV刺激而上调的自然杀伤细胞迅速减低,继而导致免疫监控丢失,从而导致肿瘤的发生有关[17];此外,HCV可能通过其蛋白质或转录物直接驱动HCC发生,和/或通过诱导慢性肝脏炎症间接驱动HCC发生[18]。本研究中有2例肝硬化患者在获得SVR后并发肝外恶性肿瘤。因此实现SVR后,特别是处于肝硬化阶段的患者,即使HCV RNA被清除,仍需要监测HCC及其他肿瘤的发生。
本研究为回顾性单中心临床研究,存在一定的局限性,如EBR/GZR组因治疗禁忌未纳入失代偿期肝硬化患者,LDV/SOF组因治疗安全性未纳入肾衰竭患者。未来需进一步开展基于临床数据登记的前瞻性真实世界研究,并通过增加样本量和随访时间以更准确地反映CHC的治疗现状及经DAAs治疗的远期结局,为探索适合我国的CHC诊治方案提供数据支持。
综上所述,基因1b型不伴或伴有肝硬化的CHC患者使用LDV/SOF或EBR/GZR抗病毒治疗的疗效及安全性均较好,且经济负担小,性价比高,但仍需继续随访患者并监测有无并发症的发生。
所有作者均声明不存在利益冲突



























