
探讨妊娠期李斯特菌病的临床及实验室特征,为临床早期治疗妊娠期李斯特菌病提供参考。
回顾性分析浙江大学医学院附属杭州市第一人民医院2015年10月至2021年3月收治的14例妊娠期李斯特菌病孕妇的临床特征及实验室结果。采用Excel对数据进行处理。
妊娠期李斯特菌病的发生率为0.03%(14/42 816)。14例孕妇发病时间显示,孕中期9例,孕晚期5例。14例患者就诊时均发热(14/14),同时伴腹痛(4/14)、头痛(3/14)和阴道流血(3/14)等。实验室检查结果显示,外周血白细胞计数升高11例,中性粒细胞百分比、超敏C-反应蛋白水平及外周血降钙素原均升高。李斯特菌检出标本为孕妇全血(10/14)、羊水(5/14)、阴道分泌物(2/14)、骨髓(1/14)、新生儿脐血(1/15)和新生儿全血(1/15),实验室检出李斯特菌的时长为(2.78±0.77) d,药敏试验结果显示对氨苄西林、青霉素及美罗培南均敏感。12例胎盘经病理检查发现绒毛膜羊膜炎者7例。所有孕妇均康复出院。10名孕中期胎儿存活2名,5名孕晚期胎儿全部存活。
妊娠期李斯特菌病临床特征不特异,实验室病原学诊断应首选血培养。妊娠晚期患者的胎儿存活机会较高。早期经验用药应覆盖李斯特菌。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
产单核细胞李斯特菌是兼性厌氧的革兰阳性无芽孢杆菌,是一种食源性污染菌,容易污染熟食肉、软乳酪、熏鱼、芽菜等即食食品,引发李斯特菌病,全球每年的发病率为0.001‰~0.01‰[1]。李斯特菌病的易感人群包括老年人、孕妇、新生儿、免疫力低下的人群。孕妇因怀孕期间生理性的细胞免疫抑制现象,其易感性为正常人的16~18倍,李斯特菌经血流感染侵袭胎盘组织,可引起流产、死产和早产,而新生儿通过吞咽污染羊水或经过李斯特菌定植的产道后可能引起新生儿产单核细胞李斯特菌感染[2]。本研究总结了14例妊娠期李斯特病的临床特征、诊疗方案、病原学培养,供临床参考。
收集2015年10月1日至2021年3月31日浙江大学医学院附属杭州市第一人民医院收治孕妇共42 816例,其中产单核细胞李斯特菌阳性的孕妇14例。本研究经浙江大学医学院附属杭州市第一人民医院伦理委员会批准(批准文号ZN-20220318-0048-01)。
妊娠期女性临床出现发热、腹泻、腹痛等符合李斯特菌病的临床表现,并且至少满足下述情况之一:(1)从无菌部位采集的临床标本中培养分离出李斯特菌;(2)从非无菌部位(如宫腔拭子)采集标本中培养出李斯特菌,同时胎盘病理改变符合急性胎膜绒毛膜炎;(3)新生儿出生后即出现急性李斯特菌败血症。
血液标本接种于BD血培养瓶并置于BACTEC FX全自动血培养仪(美国BD公司产品)中培养。哥伦比亚血平板(贝瑞特)用于接种其他标本,并置于5%CO2孵育箱,37℃培养18~24 h。细菌鉴定采用MALDI-TOF MS(德国Bruker),药敏方法及结果判读参考EUCAST v11.0[4]。
送检胎盘置10%中性甲醛液中1~3 d,从母体面至胎儿面每隔1 cm纵形切开,再次采用10%中性甲醛液固定1周。取胎盘母体面、子面组织各1块,采用80%、90%、95%、100%浓度乙醇依次脱水2 h,以石蜡包埋标本并切片,厚度为4~6 μm。铺片,烤片后采用HE染色,显微镜下观察。根据《妇产科诊断病理学》[5]对胎盘急性绒毛膜羊膜炎进行分期:Ⅰ期,急性绒毛膜下炎(绒毛膜板下的纤维蛋白内可见中性粒细胞);Ⅱ期,急性绒毛膜炎(胎盘表面或胎膜的绒毛膜间质内可见中性粒细胞);Ⅲ期,急性绒毛膜羊膜炎(绒毛膜板或胎膜的绒毛膜和羊膜内可见中性粒细胞)。病理报告经两位病理科医师复查后出具。
采用大肠埃希菌(ATCC25922)、流感嗜血杆菌(ATCC49247)、白念珠菌(ATCC14053)和肺炎链球菌(ATCC49619)作为实验质量控制的菌株,均由广州迪景微生物科技有限公司提供。
使用Excel对数据进行处理。正态分布的计量资料以 ±s表示,非正态分布的计量资料以中位数(M)和上下四分位数(Q1,Q3)表示。计数资料以例(百分数)或例/例表示。
±s表示,非正态分布的计量资料以中位数(M)和上下四分位数(Q1,Q3)表示。计数资料以例(百分数)或例/例表示。
妊娠期李斯特菌病的发生率为0.03%(14/42 816)。14例孕妇的年龄为27.00(23.25,29.00)岁。既往孕产史:7例为初次妊娠;5例为第2次妊娠,其中2例有1次流产史;1例为第3次妊娠,有1次流产史;1例为第4次妊娠,有2次流产史。既往病史:1例患系统性红斑狼疮10年,规范服药治疗,入院时为狼疮肾炎;1例为慢性乙型肝炎,1例合并妊娠期肝内胆汁淤积症,1例有甲状腺功能亢进,1例为孕妇预激综合征和妊娠合并甲状腺功能减退。发病孕龄:14例孕妇发病时孕龄为24+1(20+4,28+5)周。9例于孕中期发病,5例于孕晚期发病,无孕早期发病者,见表1。
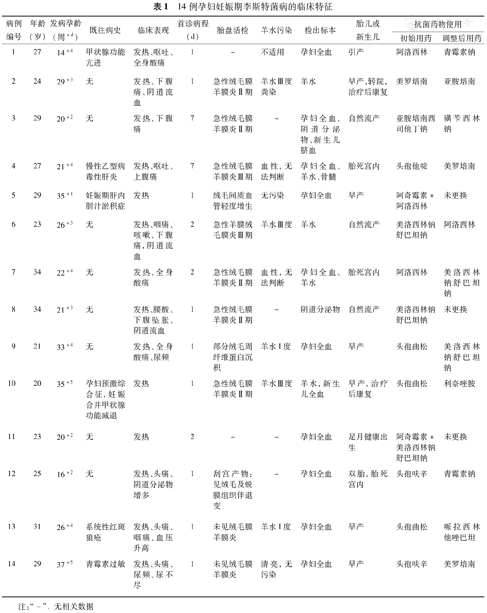
14例孕妇妊娠期李斯特菌病的临床特征
14例孕妇妊娠期李斯特菌病的临床特征
| 病例编号 | 年龄(岁) | 发病孕龄(周+d) | 既往病史 | 临床表现 | 首诊病程(d) | 胎盘活检 | 羊水污染 | 检出标本 | 胎儿或新生儿 | 抗菌药物使用 | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 初始用药 | 调整后用药 | ||||||||||
| 1 | 27 | 14+4 | 甲状腺功能亢进 | 发热、呕吐、全身酸痛 | 1 | - | 不适用 | 孕妇全血 | 引产 | 阿洛西林 | 青霉素钠 |
| 2 | 24 | 29+3 | 无 | 发热、下腹痛、阴道流血 | 1 | 急性绒毛膜羊膜炎Ⅱ期 | 羊水Ⅲ度粪染 | 羊水 | 早产,转院,治疗后康复 | 美罗培南 | 亚胺培南 |
| 3 | 29 | 20+2 | 无 | 发热、下腹痛 | 7 | 急性绒毛膜羊膜炎Ⅱ期 | - | 孕妇全血、阴道分泌物、新生儿脐血 | 自然流产 | 亚胺培南西司他丁钠 | 磺苄西林钠 |
| 4 | 27 | 21+4 | 慢性乙型病毒性肝炎 | 发热、呕吐、上腹痛 | 7 | 急性绒毛膜羊膜炎Ⅲ期 | 血性,无法判断 | 孕妇全血、羊水、骨髓 | 胎死宫内 | 头孢他啶 | 美罗培南 |
| 5 | 29 | 35+1 | 妊娠期肝内胆汁淤积症 | 发热 | 1 | 绒毛间质血管轻度增生 | 无污染 | 孕妇全血 | 早产 | 阿奇霉素+阿洛西林 | 未更换 |
| 6 | 23 | 26+3 | 无 | 发热、咽痛、咳嗽、下腹痛,阴道流血 | 2 | 急性羊膜绒毛膜炎Ⅲ期 | 羊水Ⅲ度 | 羊水 | 自然流产 | 美洛西林钠舒巴坦钠 | 阿洛西林 |
| 7 | 34 | 22+4 | 无 | 发热、全身酸痛 | 2 | 急性绒毛膜羊膜炎Ⅱ期 | 血性,无法判断 | 孕妇全血、羊水 | 胎死宫内 | 阿洛西林 | 美洛西林钠舒巴坦钠 |
| 8 | 34 | 21+3 | 无 | 发热、腰酸、下腹坠胀、阴道流血 | 1 | 急性绒毛膜羊膜炎Ⅱ期 | - | 阴道分泌物 | 自然流产 | 美洛西林钠舒巴坦钠 | 未更换 |
| 9 | 21 | 33+4 | 无 | 发热、全身酸痛、尿频 | 1 | 部分绒毛周纤维蛋白沉积 | 羊水I度 | 孕妇全血 | 早产 | 头孢曲松 | 美洛西林钠舒巴坦钠 |
| 10 | 20 | 35+5 | 孕妇预激综合征,妊娠合并甲状腺功能减退 | 发热 | 1 | 急性绒毛膜羊膜炎Ⅱ期 | 羊水Ⅲ度 | 羊水,新生儿全血 | 早产,治疗后康复 | 头孢曲松 | 利奈唑胺 |
| 11 | 23 | 20+2 | 无 | 发热 | 2 | - | - | 孕妇全血 | 足月健康出生 | 阿奇霉素+美洛西林钠舒巴坦钠 | 未更换 |
| 12 | 25 | 16+2 | 无 | 发热、头痛、阴道分泌物增多 | 1 | 刮宫产物:见绒毛及蜕膜组织伴退变 | - | 孕妇全血 | 双胎,胎死宫内 | 头孢呋辛 | 青霉素钠 |
| 13 | 31 | 26+4 | 系统性红斑狼疮 | 发热、头痛、咽痛、血压升高 | 1 | 未见绒毛膜羊膜炎 | 羊水I度 | 孕妇全血 | 早产 | 头孢曲松 | 哌拉西林他唑巴坦 |
| 14 | 29 | 37+5 | 青霉素过敏 | 发热、头痛、尿频、尿不尽 | 1 | 未见绒毛膜羊膜炎 | 清亮,无污染 | 孕妇全血 | 早产 | 头孢呋辛 | 美罗培南 |
注:"-".无相关数据
14例孕妇的首诊病程为1.00(1.00,2.00) d,确诊前病程为6.52(4.77,9.02) d。14例孕妇就诊时均有发热,其中高热(>39.0 ℃)8例,中度发热(38.0~39.0 ℃)6例;其他伴随症状包括腹痛(4/14)、头痛(3/14)、阴道流血(3/14)、咽痛(2/14)、呕吐(2/14)、尿频(2/14)和阴道流液(1/14)。
血常规检查中,外周血白细胞计数升高11例;中性粒细胞百分比>70%者14例。所有孕妇超敏C-反应蛋白(CRP)水平及外周血降钙素原(PCT)水平均升高。5例孕妇羊水污染,其中2例为I度污染,3例为Ⅲ度污染。检出李斯特菌的标本来源为孕妇全血10份,羊水标本5份,阴道分泌物标本2份,骨髓标本1份;新生儿脐血标本1份,全血标本1份。尿液、痰液、脑脊液标本均未检出。实验室对14例孕妇从接收标本到报告病原菌的时长为(2.78±0.77) d。其中9株李斯特菌进行了药敏试验,结果显示:除对红霉素和复方磺胺甲噁唑耐药各1株外,对氨苄西林、青霉素及美罗培南均敏感。
14例孕妇的结局:宫内感染7例,败血症5例,脓毒血症5例,肺部感染4例,感染性休克2例,急性腮腺炎、急性胆囊炎和急性胰腺炎各1例,未出现中枢神经系统感染,无孕妇死亡,经治疗均康复出院。14例孕妇住院时长为9.29(5.88,12.25) d,最长1例为并发感染性休克者,其住院时间为78 d。14例孕妇共妊娠15名胎儿(其中1例为双胎),胎儿或新生儿结局:7名存活,其中6名早产(均经剖腹产获得),1名足月健康出生,其中2例早产儿并发早发型李斯特菌病,均经治疗后康复;4名胎死宫内,3名流产,1名被引产。10名孕中期胎儿存活2名,5名孕晚期胎儿全部存活。
12例孕妇进行胎盘病理检查。结果显示Ⅱ期绒毛膜羊膜炎5例,Ⅲ期绒毛膜羊膜炎2例,且上述7例孕妇的羊水或阴道分泌物或胎儿脐血均培养得到李斯特菌。
初始经验性抗菌治疗:14例孕妇中,初始经验性抗菌药物治疗启动时的病程为2.50(1.00,4.50) d,6例采用头孢菌素治疗,8例采用青霉素类或碳青霉烯类药物。调整后用药:在病原学结果明确为李斯特菌后,依据药敏试验结果,6例初始头孢菌素方案均调整为青霉素类或碳青霉烯类或利奈唑胺,见表1。
李斯特菌病是一种食源性传播疾病,妊娠期李斯特菌病对胎儿是一个严重的威胁。国内妊娠期李斯特菌病病例占李斯特菌病总病例数的50.4%[6]。感染李斯特菌的孕妇大多既往健康,极少数有免疫相关的基础疾病[7]。因此,孕妇人群是李斯特菌病的重点监测对象。但孕妇感染李斯特菌时,约有1/3患者无症状[8],其余表现为非特异性,如发热、头痛、肌肉酸痛、咽喉痛等流感样症状[7,9],实验室的炎症指标也可见CRP、PCT升高[8],容易误诊误治。本研究中14例病例临床症状以发热为主,伴腹痛、头痛、阴道流血、咽痛、呕吐、尿频和阴道流液等,CRP和PCT均升高,虽然首诊病程为1.00(1.00,2.00) d,但上述非特异性症状和实验室检查结果无法为临床及时诊疗提供明确依据。根据妊娠期李斯特菌病诊断标准[3],除临床症状外,临床标本检出李斯特菌是诊断的必备依据。因此,采集合适的临床标本送检培养是诊断妊娠期李斯特菌病的重要环节。本研究提示,血液是检出李斯特菌的主要标本来源(10/14),其次为羊水和阴道分泌物(7/14),与国内报道不同标本类型的检出情况较接近[10]。因李斯特菌能突破绒毛外滋养细胞垂直传播至胎儿[11],本研究中流产、死胎或早发型新生儿李斯特菌病早产儿的胎盘组织呈急性羊膜绒毛膜炎病理改变,且通过其羊水或阴道分泌物或新生儿脐带血培养获得李斯特菌,建议除血液外,羊水、阴道分泌物、胎盘组织、脐带血均应送检培养[12]。通常急诊科或感染科是妊娠期李斯特菌病病例的门诊首诊科室,因此首诊医师若遇到妊娠患者出现发热及非特异性症状,应考虑李斯特菌感染的可能,应及时采集多种类型样本,尽早明确感染病原体,结合羊水污染程度、胎盘组织病理改变,有助于对胎儿/新生儿李斯特菌感染的评估。妊娠期李斯特菌病患者预后良好,一般在结束妊娠后恢复正常,罕见并发脑膜脑炎和死亡[7,13,14]。但临床应关注妊娠患者可能并发其他并发症,如败血症、脓毒血症、宫内感染、肺部感染及感染性休克等,可能增加住院时长[15]。而胎儿的预后,研究显示与孕龄相关,一项对166例妊娠期李斯特菌病的回顾性分析发现,孕早、中和晚期胎儿的存活率分别为:0、29.2%和95.3%[13],且每增加一周孕龄,胎儿存活率增加34.3%[13]。本研究尚无孕早期病例,可能因早期流产通常由染色体异常引起,流产组织不作常规培养[12],无法获得确切的流产原因。但本研究10名孕中期胎儿存活2名,5名孕晚期胎儿全部存活,与上述研究结果较一致。国外回顾性分析结果显示,妊娠期李斯特菌病胎儿的总体存活率为76.5%~80%[9,16],国内2011至2017年总体存活率为66.0%(138/209)[6],中国内某单中心总体存活率为19.0%(4/21)[10],差异主要可能与孕中期病例的比例及妊娠晚期病例的处置方式有关。本研究中15名胎儿共存活7名。基于妊娠期李斯特菌病对胎儿产生的严重后果,专家建议对可疑妊娠期李斯特菌病应早期足量抗菌药物治疗,并尽早终止妊娠[14,17]。抗李斯特菌的一线药物包括氨苄西林、阿莫西林和青霉素等,且强调足量使用,过敏者可以使用复方磺胺甲噁唑[13,16]。但作为临床常用的经验性治疗药物的广谱抗生素-头孢菌素,由于无法紧密结合李斯特菌细胞膜上的青霉素结合蛋白3,使得李斯特菌对头孢菌素天然耐药,因此应避免使用。本研究药敏试验结果显示,李斯特菌对氨苄西林、青霉素均敏感,但对复方磺胺甲噁唑存在耐药株。本研究为单中心研究,病例数有限,无法开展对妊娠期李斯特菌病的发病与预后等相关因素的统计学研究,尚需进一步大样本研究。
综上所述,李斯特菌感染途径常为食源性,在预防方面应强调对孕妇饮食卫生的科普宣传。门诊首诊医师对于有发热、腹泻、流感、腹痛甚至尿频等症状的孕妇,应尽早使用有效足量的抗菌药物覆盖李斯特菌,并及早采集多种标本,尤其是血培养,尽早确定病原菌,进行针对治疗。晚期妊娠患者需及时终止妊娠有利于胎儿结局。
所有作者均声明不存在利益冲突



























