
探讨γ-干扰素释放试验QFT-GIT与病原学结果不一致的影响因素。
回顾性分析2017年9月至2021年8月在浙江大学医学院附属杭州市胸科医院收治的进行QFT-GIT试验后经培养确诊结核分枝杆菌阳性的1 398例患者临床资料。以病原学培养结果为标准,QFT-GIT结果阳性为结果一致组(n=1 242),阴性及不确定为结果不一致组(n=156)。采用Logistic回归分析QFT-GIT与结核病原学结果不一致的影响因素。采用SPSS 25.0软件对数据进行分析。
QFT-GIT与结核病原学结果不一致发生率为11.16%(156/1 398)。<18岁、18~<65岁和≥65岁人群QFT-GIT与结核病原学结果不一致发生率分别为0、7.09%(63/889)和19.58%(93/475)。≥65岁人群不一致的发生率高于<18岁和18~<65岁人群(χ2=6.584和36.762,P<0.01)。多因素Logistic回归分析显示,年龄(OR=1.026,95%CI 1.016~1.037)、吸烟(OR=1.649,95%CI 1.159~2.347)、慢性肝病(OR=1.868,95%CI 1.213~2.876)、心血管疾病(OR=2.353,95%CI 1.361~4.069)及白蛋白(OR=0.956,95%CI 0.928~0.985)是QFT-GIT与结核病原学结果不一致发生的独立影响因素。
高龄、吸烟、慢性肝病、心血管疾病和低白蛋白水平患者更易发生QFT-GIT与结核病原学结果不一致。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
结核病是由结核分枝杆菌(Mycobacterium tuberculosis,MTB)感染引起的传染病,严重危害着人类的生命健康。根据世界卫生组织(WHO)2021年全球结核病报告显示,2020年全球结核病发病的人数为987万,我国新发患者数为84.2万,中国是全球30个结核病高负担国家之一[1]。QuantiFERON-TB Gold In-tube(QFT-GIT)是一种检测MTB感染的γ-干扰素(IFNγ)释放试验,通过酶联免疫吸附测定(ELISA)方法对多肽抗原体外反应所产生的IFNγ进行定量检测,从而判断机体是否感染MTB[2,3]。在诊断结核病的传统技术中,涂片法阳性率低,MTB培养实验周期长(1~2个月),虽然近年来分子诊断取得了快速发展,但这些检测手段依然依赖患者痰液等样本质量,对于无痰、少痰患者诊断效能较差。相比以上检测技术,QFT-GIT检测患者血液样本,具有检测稳定、灵敏度高及报告快速(1~2个工作日)等优势。另外QFT-GIT不仅可以检测活动性结核,也可以检测潜伏性结核感染,并且不受卡介苗及非结核分枝杆菌的影响。以上这些特点使得QFT-GIT在结核病早期快速筛查方面发挥了重大作用,并且成为了结核诊疗指南推荐的重要实验室检测方法[4]。然而在临床实践中,有研究显示QFT-GIT仍存在一定比例的假阴性及不确定结果(Indeterminatetest results,ITRs)[5,6],这些检测结果与病原学诊断不一致。由于QFT-GIT主要用于早期结核病快速筛查,与病原学不一致的结果可能会造成一定程度的漏诊或诊断延误,从而导致治疗不及时,加重疾病的严重程度,延长患者的痛苦,增加患者死亡的风险,并促进疾病(涂阳肺结核病)向密切接触者传播[7,8]。因此,探究QFT-GIT与结核病原学结果不一致的影响因素尤为重要。本文通过回顾性分析浙江大学医学院附属杭州市胸科医院收治结核患者的QFT-GIT结果,分析QFT-GIT与结核病原学结果不一致发生的影响因素,为临床提供参考。
收集2017年9月至2021年8月在浙江大学医学院附属杭州市胸科医院收治的进行QFT-GIT试验后经Bactec MGIT960液体培养确诊MTB阳性的1 398例患者临床资料。其中男性924例,女性474例,年龄54.00(30.00,69.00)岁。纳入标准:(1)住院患者,且有详细住院资料及各种检验检测指标;(2)均行QFT-GIT;(3)MTB确诊阳性。排除标准:(1)分枝杆菌培养阳性,经药敏试验或博奥芯片试验菌种鉴定为非结核分枝杆菌者;(2)结核与非结核分枝杆菌混合感染者。其中QFT-GIT结果阳性1 242例,假阴性110例,ITRs 46例。以病原学培养结果为标准,QFT-GIT结果阳性为结果一致组(n=1 242),阴性及不确定为结果不一致组(n=156)。该研究经浙江大学医学院附属杭州市胸科医院伦理委员会批准(伦理批号:201709号)。
Bactec MGIT960液体培养系统及试剂(美国BD公司,批号:7167829和7244979等)。QFT-GIT试剂盒(德国QIAGEN凯杰公司,批号:170506、180307等),全自动酶标免疫分析仪DS2,恒温培养箱,血常规检测仪(美国贝克曼库尔特有限公司DxH 800);全自动生化分析仪(美国贝克曼库尔特有限公司AU5821)。
(1)标本采集与处理:采集患者外周静脉全血4~6 mL置肝素锂抗凝管,4 h内送至实验室进行检测。颠倒混匀10次后取标本分别置于丝裂原阳性对照(Mitogen)管、结核抗原(TBAg)管和空白对照(Nil)管,每管1 mL,立即上下颠倒振荡10次,确保整个试管内层都被血液覆盖,以溶解管壁上的抗原,直立置于37 ℃培养箱孵育16~24 h,2 000 × g/min离心15 min。(2)QFT-GIT结果计算与判定:采用QFT-GIT试剂盒,实验过程严格按照说明书操作,酶标仪检出数值采用德国QIAGEN公司提供的QFT分析软件(DS2QFT 4pt v6.25版本)进行计算,结果判读标准见表1。(3)记录所有患者入院时的临床资料。一般特征:年龄、性别;临床表现:发热、咯血、咳嗽、胸闷气促、结核既往史及吸烟情况;基础疾病:低蛋白血症、慢性肝病、慢性肾病、免疫疾病、肿瘤、糖尿病、慢性肺病、高血压及心血管疾病等;实验室检查:葡萄糖、尿素氮、肌酐、尿酸、血清总蛋白、血清白蛋白、血清球蛋白、C-反应蛋白(CRP)、白细胞、淋巴细胞数、淋巴细胞百分比及血红蛋白等指标。
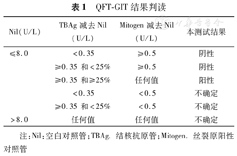
QFT-GIT结果判读
QFT-GIT结果判读
| Nil(U/L) | TBAg减去Nil(U/L) | Mitogen减去Nil(U/L) | 本测试结果 |
|---|---|---|---|
| ≤8.0 | <0.35 | ≥0.5 | 阴性 |
| ≥0.35和<25% | ≥0.5 | 阴性 | |
| ≥0.35和≥25% | 任何值 | 阳性 | |
| <0.35 | <0.5 | 不确定 | |
| ≥0.35和<25% | <0.5 | 不确定 | |
| >8.0 | 任何值 | 任何值 | 不确定 |
注:Nil:空白对照管;TBAg.结核抗原管;Mitogen.丝裂原阳性对照管
采用SPSS 25.0软件进行统计分析,非正态分布的计量资料以中位数(M)和上下四分位数(Q1,Q3)表示,组间比较采用Mann-Whitney U检验或Kruskal Wallis检验。计数资料用例(百分数)表示,采用χ2检验或Fisher确切概率法。结果不一致影响因素分析采用多因素Logistic逐步回归分析。以P<0.05为差异有统计学意义。
1 398例患者中,与病原学结果不一致共156例,比例为11.16%。<18岁、18~<65岁、≥65岁人群QFT-GIT与病原学结果不一致的发生率分别为0、7.09%(63/889)、19.58%(93/475),各年龄人群比较,差异有统计学意义(χ2=53.111,P<0.001);≥65岁人群不一致的发生率高于<18岁人群、18~<65岁人群,差异均有统计学意义(χ2=6.584和36.762,P<0.01)。单因素分析显示,两组患者在年龄、性别、胸闷气促、吸烟、低蛋白血症、慢性肝病、肿瘤、慢性肺病、高血压、心血管疾病、贫血、葡萄糖、尿素氮、尿酸、血清总蛋白、血清白蛋白、CRP、淋巴细胞数、淋巴细胞百分比及血红蛋白方面比较,差异均具有统计学意义(P<0.05或<0.01)(表2)。
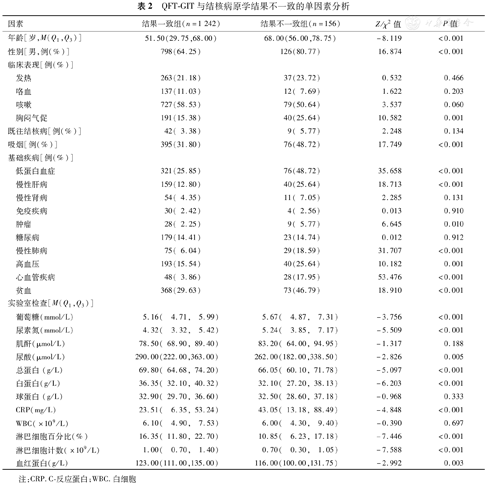
QFT-GIT与结核病原学结果不一致的单因素分析
QFT-GIT与结核病原学结果不一致的单因素分析
| 因素 | 结果一致组(n=1 242) | 结果不一致组(n=156) | Z/χ2值 | P值 | |
|---|---|---|---|---|---|
| 年龄[岁,M(Q1,Q3)] | 51.50(29.75,68.00) | 68.00(56.00,78.75) | -8.119 | <0.001 | |
| 性别[男,例(%)] | 798(64.25) | 126(80.77) | 16.874 | <0.001 | |
| 临床表现[例(%)] | |||||
| 发热 | 263(21.18) | 37(23.72) | 0.532 | 0.466 | |
| 咯血 | 137(11.03) | 12( 7.69) | 1.622 | 0.203 | |
| 咳嗽 | 727(58.53) | 79(50.64) | 3.537 | 0.060 | |
| 胸闷气促 | 191(15.38) | 40(25.64) | 10.582 | 0.001 | |
| 既往结核病[例(%)] | 42( 3.38) | 9( 5.77) | 2.248 | 0.134 | |
| 吸烟[例(%)] | 395(31.80) | 76(48.72) | 17.749 | <0.001 | |
| 基础疾病[例(%)] | |||||
| 低蛋白血症 | 321(25.85) | 76(48.72) | 35.658 | <0.001 | |
| 慢性肝病 | 159(12.80) | 40(25.64) | 18.713 | <0.001 | |
| 慢性肾病 | 54( 4.35) | 11( 7.05) | 2.285 | 0.131 | |
| 免疫疾病 | 30( 2.42) | 4( 2.56) | 0.013 | 0.910 | |
| 肿瘤 | 28( 2.25) | 9( 5.77) | 6.645 | 0.010 | |
| 糖尿病 | 179(14.41) | 23(14.74) | 0.012 | 0.912 | |
| 慢性肺病 | 75( 6.04) | 29(18.59) | 31.707 | <0.001 | |
| 高血压 | 193(15.54) | 40(25.64) | 10.182 | 0.001 | |
| 心血管疾病 | 48( 3.86) | 28(17.95) | 53.476 | <0.001 | |
| 贫血 | 368(29.63) | 73(46.79) | 18.910 | <0.001 | |
| 实验室检查[M(Q1,Q3)] | |||||
| 葡萄糖(mmol/L) | 5.16( 4.71, 5.99) | 5.67( 4.87, 7.31) | -3.756 | <0.001 | |
| 尿素氮(mmol/L) | 4.32( 3.32, 5.42) | 5.24( 3.85, 7.17) | -5.509 | <0.001 | |
| 肌酐(μmol/L) | 78.50( 68.90, 89.40) | 83.20( 64.00, 94.95) | -1.317 | 0.188 | |
| 尿酸(μmol/L) | 290.00(222.00,363.00) | 262.00(182.00,338.50) | -2.826 | 0.005 | |
| 总蛋白(g/L) | 69.80( 64.68, 74.20) | 66.05( 60.10, 71.78) | -5.097 | <0.001 | |
| 白蛋白(g/L) | 36.35( 32.10, 40.32) | 32.10( 27.20, 38.13) | -6.203 | <0.001 | |
| 球蛋白(g/L) | 32.90( 29.70, 36.60) | 32.50( 28.60, 37.18) | -0.968 | 0.333 | |
| CRP(mg/L) | 23.51( 6.35, 53.24) | 43.05( 13.18, 88.49) | -4.848 | <0.001 | |
| WBC(×109/L) | 6.10( 4.90, 7.53) | 6.00( 4.30, 9.40) | -0.390 | 0.697 | |
| 淋巴细胞百分比(%) | 16.35( 11.80, 22.70) | 10.85( 6.23, 17.18) | -7.446 | <0.001 | |
| 淋巴细胞计数(×109/L) | 1.00( 0.70, 1.40) | 0.70( 0.30, 1.05) | -7.588 | <0.001 | |
| 血红蛋白(g/L) | 123.00(111.00,135.00) | 116.00(100.00,131.75) | -2.992 | 0.003 | |
注:CRP.C-反应蛋白;WBC.白细胞
将单因素分析具有统计学意义的指标纳入多因素Logistis回归分析,结果显示:年龄(OR=1.026,95%CI 1.016~1.037)、吸烟(OR=1.649,95%CI 1.159~2.347)、慢性肝病(OR=1.868,95%CI 1.213~2.876)、心血管疾病(OR=2.353,95%CI 1.361~4.069)是QFT-GIT与结核病原学不一致结果发生的独立危险因素,白蛋白(OR=0.956,95%CI 0.928~0.985)是QFT-GIT与结核病原学不一致结果发生的独立保护因素(图1)。
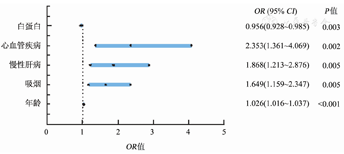

结核病是全球高发传染病,严重威胁人类的健康。QFT-GIT在结核病的早期诊断中起着重要的作用,与结核菌素皮肤试验方法相比,该方法更容易对结核病做出早期诊断[9]。然而在结核病的诊断过程中,QFT-GIT结果与结核病原学结果存在不一致现象,这严重干扰了临床医师对结核病的诊断。因此,探究QFT-GIT与结核病原学结果不一致的影响因素具有重要意义。QFT-GIT结果除了阳性,还会出现假阴性和不确定结果。本研究显示,以结核病原学阳性结果为标准,QFT-GIT与结核病原学不一致结果发生率为11.16%(156/1 398),低于龚道方等[10]报道的QFT-GIT假阴性率(17.5%),分析原因可能与入组标准不同有关。龚道方等[10]研究纳入标准参照中华医学会结核病学分会编著的《临床诊疗指南:结核病分册》[11],与病原学确诊阳性病例相比,这种标准有可能将非结核患者纳入,从而提高患者的假阴性率。本研究采用多因素Logistic回归分析发现,年龄、慢性肝病、吸烟、心血管疾病及白蛋白为QFT-GIT与结核病原学结果不一致的独立影响因素。随着年龄增长,QFT-GIT与结核病原学结果不一致发生的风险增加,原因可能是随着年龄增长,机体对MTB特异性抗原引起的细胞免疫反应减弱,产生的IFNγ浓度降低[12]。与不吸烟人群相比,吸烟人群QFT-GIT与结核病原学结果不一致发生的风险明显增高。有研究[13,14]发现,经常接触烟草烟雾会降低细胞中IFNγ的产生并损害IFNγ介导的信号传导和疫苗效力,吸烟对免疫防御有负面影响,这可能会影响免疫诊断测试的性能,从而增加QFT-GIT与结核病原学结果不一致发生的风险。谭守勇等[15]研究表明,白蛋白水平下降引起的营养不良是继发免疫功能低下的主要因素,进而降低细胞中IFNγ免疫活性,导致QFT-GIT与结核病原学结果不一致产生。这与其他研究[10,16,17]结果是一致的,在这几项研究中,白蛋白水平的下降分别引起了QFT-GIT假阴性或ITRs的发生,从而导致了QFT-GIT与结核病原学结果不一致。慢性肝病是QFT-GIT与结核病原学结果不一致的独立影响因素,可能是因为白蛋白主要由肝脏合成,慢性肝病会导致合成白蛋白能力下降,继而引起免疫功能低下[18]。本研究还显示,心血管疾病是QFT-GIT与结核病原学结果不一致的独立影响因素。这在以往的研究很少提到,具体机制不清楚,可能的原因:一方面是心血管疾病好发老年患者,另一方面心血管疾病患者伴随体质较弱,容易伴发免疫功能低下。
不同的研究因纳入因素、人群特征不同,结论会有所不同。但在这几项研究[10,16,17]中,年龄均是独立风险因素。本研究结果显示:年龄越大,QFT-GIT与结核病原学结果不一致风险越高。Kwon等[17]研究显示,与<65岁组相比,≥65岁组是QFT-GIT假阴性的独立影响因素(OR=1.60,P=0.029)。Tebruegge等[19]研究将年龄分为<18岁组、18~<65岁组和≥65岁组,不确定结果在<18岁组与≥65岁组发生率较高,而在18~<65岁组较低。原因可能为儿童青少年免疫功能尚处在发育阶段,老年人免疫功能逐渐衰老所致,免疫功能不完善或减弱会降低淋巴细胞对结核抗原的免疫应答,产生低水平的IFNγ,导致不一致结果发生。老年患者由于基础疾病复杂,营养状况较差,有很多潜在的疾病,机体免疫力下降,需要引起高度重视。本研究还存在一些不足之处,研究纳入的疾病类型没有精准细化,这对影响因素的精准分析造成了困难。如果可以获得更多病例及更详实的资料,就能更好地了解患者生理病理因素在QFT-GIT与结核病原学不一致发生中的作用。
综上所述,判读QFT-GIT结果时,需要重视QFT-GIT与结核病原学不一致情况。对于那些具有独立风险因素的患者,建议临床尽量完善影像、涂片、分枝杆菌培养及各项结核分子检测等检查,对于少痰、无痰患者可行支气管肺泡灌洗液检查,从而提高结核病的诊断。
所有作者均声明不存在利益冲突



























