
探究艾滋病相关淋巴瘤(Acquired immunodeficiency syndrome-related lymphpma,ARL)患者临床特征及预后的影响因素。
回顾性分析2013年3月至2021年10月浙江大学医学院附属第一医院84例ARL患者的临床资料,采用多因素Cox回归模型评估ARL患者预后的影响因素。
84例ARL患者中,非霍奇金淋巴瘤占95.2%(80/84)。52.3%(44/84)患者伴随发热、盗汗及体质量减轻等淋巴瘤B症状。根据Ann Arbor分期,Ⅲ~Ⅳ期占84.5%(71/84)。58.0%(47/81)患者基线CD4+T淋巴细胞计数≤200个/μL。接受放化疗期间,发生肺部感染30例(35.7%),消化道感染11例(13.1%),21.4%(18/84)患者发生败血症。84例患者1年生存率是70.2%(59/84)。通过多因素Cox分析显示,国际预后指数(International prognostic index,IPI)评分>3分(HR=5.094,95%CI 1.877~13.824,P=0.001)是ARL患者预后的独立危险因素,接受利妥昔单抗治疗(HR=0.354,95%CI 0.152~0.823,P=0.016)是ARL患者预后的独立保护因素。
ARL临床表现多样化,确诊时常处于疾病晚期,并发症多,预后不佳。IPI评分和是否接受利妥昔单抗治疗是影响ARL患者预后的关键因素。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
艾滋病相关淋巴瘤(Acquired immunodeficiency syndrome-related lymphoma, ARL)是一组与HIV感染相关的淋巴组织异质性肿瘤,85%为B细胞来源,最常见的是弥漫性大B细胞淋巴瘤(Diffuse large B-cell lymphoma, DLBCL)[1]。超过28%的艾滋病患者死于恶性肿瘤,其中40%的死因是ARL[2,3,4]。ARL患者因感染HIV病毒,免疫功能减弱,抗感染和预防疾病侵袭人体的能力下降,易发生多种病原体感染。早期研究发现,约20%接受化疗的ARL患者发生艾滋病相关机会性感染[5],且化疗患者因CD4+T淋巴细胞水平下降导致感染的病原体更复杂,对于抗菌药物的使用需要更加谨慎。研究证实,利妥昔单抗可显著改善CD4+T淋巴细胞计数≥50个/μL ARL患者的预后[6],但对CD4+T淋巴细胞计数<50个/μL患者,可能会增加感染并发症的风险,不推荐使用[7]。这进一步增加了ARL患者的治疗难度。
ARL由于发病隐匿、临床表现缺乏特异性,造成早期诊断困难;患者免疫功能破坏严重,对放化疗耐受性较差,易发生感染、严重骨髓抑制等多种并发症,预后较差。目前,国际预后指数(International prognostic index,IPI)评分是最常用的淋巴瘤患者预后评估体系[8],但随着抗反转录病毒治疗(Active antiretroviral therapy,ART)的应用,ARL患者生存期明显延长,在临床实践中,IPI评分还需结合患者基础情况、病理类型、病毒载量及合并症等因素,综合评估患者病情及预后。此外,随着ARL发病率的升高,一些免疫标记物和预后分子被认为是评估患者预后的生物标记物,如胞苷脱氨酶、BCL-2、MYC、人类相关转录因子3(RUNX3)、RPS6KB1和CDC2扩增基因等,与ARL患者的预后密切相关[9,10,11,12]。但这些标记物检测费用昂贵,操作精密且时间周期长。因此,临床上迫切需要寻找更多实用经济的预后因素,建立全面的预后评估系统[13],以期尽早筛选出高风险患者,制订个体化治疗方案,提高患者生存质量和预后。本研究回顾性总结84例ARL患者的临床特征,并分析影响ARL患者预后的相关因素,以期尽早识别高风险患者,改善患者预后,为临床提供参考。
回顾性收集2013年3月至2021年10月浙江大学医学院附属第一医院住院的84例ARL患者临床资料。纳入标准:(1)年龄≥18岁;(2)经HIV抗体初筛和中国疾病预防控制中心确诊为艾滋病者,艾滋病诊断标准参照《中国艾滋病诊疗指南(2018版)》[14];(3)患者的肿瘤病灶经组织病理学检测和免疫组织化学法明确诊断为ARL,诊断标准采用世界卫生组织(WHO)制定的淋巴组织肿瘤分类标准[15]。排除妊娠期或哺乳期妇女、无明确病理报告的患者。本研究获得了浙江大学医学院附属第一医院医学伦理委员会的审核批准(编号:IIT20220194B-RI)。
收集所有患者的一般资料(包括年龄、性别及流行病学等)、临床表现、辅助检查、治疗及临床转归等资料。患者接受为期1年随访,方式为电话随访、复查或者上门随访,随访截止日期为2022年10月1日。患者生存时间以淋巴结穿刺或手术样本病理确诊ARL当日到最后一次随访结束时间或者患者死亡时间为准。按照患者1年生存情况分为存活组(n=59)和死亡组(n=25),对影响患者预后因素进行分析。
应用SPSS 26.0软件进行数据分析。呈正态分布的计量资料用 ±s表示,采用t检验或者方差分析;呈偏态分布的计量资料用中位数(M)和上下四分位数(Q1,Q3)表示。计数资料以例(百分数)表示,采用χ2检验或Fisher精确检验。采用多因素Cox回归模型评估ARL患者预后的独立影响因素。以P<0.05为差异具有统计学意义。
±s表示,采用t检验或者方差分析;呈偏态分布的计量资料用中位数(M)和上下四分位数(Q1,Q3)表示。计数资料以例(百分数)表示,采用χ2检验或Fisher精确检验。采用多因素Cox回归模型评估ARL患者预后的独立影响因素。以P<0.05为差异具有统计学意义。
84例ARL患者中,男性76例,女性8例,中位年龄47.0(35.0,57.8)岁。86.9%(73/84)患者诊断淋巴瘤前发现艾滋病,13.1%(11/84)患者艾滋病和淋巴瘤同时发现。69.1%(58/84)患者淋巴瘤原发于淋巴结内,27.4%(23/84)患者淋巴瘤原发在淋巴结外,包括胃肠道7例,肺部5例,鼻咽部3例,脑3例,肝脏2例,脊髓腔内、眼部、扁桃体各1例,3.6%(3/84)患者淋巴瘤原发淋巴结内和结外病灶。所有ARL患者,霍奇金淋巴瘤(Hodgkin’s lymphoma,HL)占4.8%(4/84),非霍奇金淋巴瘤(Non-Hodgkin’s lymphoma,NHL)占95.2%(80/84),其中弥漫大B细胞淋巴瘤占53.6%(45/84),伯基特淋巴瘤占20.2%(17/84),浆母细胞淋巴瘤占3.6%(3/84),血管免疫母细胞性T细胞淋巴瘤占2.3%(2/84),滤泡淋巴瘤占1.2%(1/84),14.3%(12/84)是B细胞来源NHL,未进一步病理分型。所有患者中,合并乙型肝炎12例(14.3%),梅毒26例(31.0%),结核11例(13.1%),EB病毒55例(65.5%),巨细胞病毒12例(14.3%)。
69.1%(58/84)患者乳酸脱氢酶(Lactic dehydrogenase, LDH)升高(>250 U/L)。Ann Arbor分期中,Ⅲ~Ⅳ期占84.5%(71/84)。国际预后评分IPI:低危组8例(9.5%),低中危组10例(11.9%),中高危组29例(34.5%),高危组37例(44.0%)。52.3%(44/84)患者伴随发热、盗汗及体质量减轻等淋巴瘤B症状,主要临床表现为浅表淋巴结肿大40例(47.6%)、发热盗汗16例(19.1%)、乏力纳差6例(7.1%)等。3例患者缺失CD4+T淋巴细胞计数资料,其他患者的CD4+T淋巴细胞计数为151.3(73.2, 279.3)个/μL。35.8%(29/81)患者CD4+T淋巴细胞计数<100个/μL,22.2%(18/81)患者CD4+T淋巴细胞计数为100~200个/μL,42.0%(34/81)患者CD4+T淋巴细胞计数>200个/μL。
84例患者接受随访时间为0.2~12个月,中位随访时间是11个月,1年生存率是70.2%(59/84)。在84例ARL患者中,79例接受高效抗反转录病毒治疗(HAART)或放化疗。其中HAART联合化疗的72例患者,死亡患者18例(25.0%);NHL患者68例(94.4%),35例患者治疗达到完全缓解或部分缓解;HL患者4例(5.5%),3例达到完全缓解或部分缓解,1例疾病进展。5例未接受HAART或化疗,其中4例因疾病进展死亡,1例存活。
在放化疗期间,21.4%(18/84)患者发生败血症,35.7%(30/84)患者发生肺部感染,13.1%(11/84)患者发生消化道感染,4.8%(4/84)患者发生泌尿系统感染。机会性感染包括:念珠菌感染患者占17.9%(15/84),肺孢子菌肺炎患者占6.0%(5/84),疱疹病毒、新生隐球菌、非结核分枝杆菌感染患者各占4.8%(4/84),马尔尼菲篮状菌、巨细胞视网膜炎患者各占2.4%(2/84),弓形虫脑病患者占1.2%(1/84)。
单因素分析显示,LDH、IPI评分、是否接受利妥昔单抗治疗和中枢转移可能影响ARL患者预后,见表1。将单因素分析中P<0.05的变量纳入多因素分析,通过多因素Cox分析显示,IPI评分>3分(HR=5.094,95%CI 1.877~13.824,P<0.001)是ARL患者预后的独立危险因素,接受利妥昔单抗治疗(HR=0.354,95%CI 0.152~0.823,P=0.016)是ARL患者预后的独立保护因素,见表2。
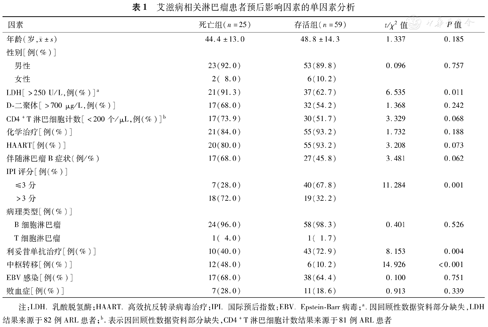
艾滋病相关淋巴瘤患者预后影响因素的单因素分析
艾滋病相关淋巴瘤患者预后影响因素的单因素分析
| 因素 | 死亡组(n=25) | 存活组(n=59) | t/χ2值 | P值 |
|---|---|---|---|---|
年龄(岁, ±s) ±s) | 44.4±13.0 | 48.8±14.3 | 1.337 | 0.185 |
| 性别[例(%)] | ||||
| 男性 | 23(92.0) | 53(89.8) | 0.096 | 0.757 |
| 女性 | 2( 8.0) | 6(10.2) | ||
| LDH[>250 U/L,例(%)]a | 21(91.3) | 37(62.7) | 6.535 | 0.011 |
| D-二聚体[>700 μg/L,例(%)] | 17(68.0) | 32(54.2) | 1.368 | 0.242 |
| CD4+T淋巴细胞计数[<200个/μL,例(%)]b | 17(73.9) | 30(51.7) | 3.329 | 0.068 |
| 化学治疗[例(%)] | 21(84.0) | 55(93.2) | 1.732 | 0.188 |
| HAART[例(%)] | 20(80.0) | 55(93.2) | 3.208 | 0.073 |
| 伴随淋巴瘤B症状(例/%) | 17(68.0) | 27(45.8) | 3.481 | 0.062 |
| IPI评分[例(%)] | ||||
| ≤3分 | 7(28.0) | 40(67.8) | 11.284 | 0.001 |
| >3分 | 18(72.0) | 19(32.2) | ||
| 病理类型[例(%)] | ||||
| B细胞淋巴瘤 | 24(96.0) | 58(98.3) | 0.401 | 0.526 |
| T细胞淋巴瘤 | 1( 4.0) | 1( 1.7) | ||
| 利妥昔单抗治疗[例(%)] | 10(40.0) | 43(72.9) | 8.153 | 0.004 |
| 中枢转移[例(%)] | 12(48.0) | 6(10.2) | 14.926 | <0.001 |
| EBV感染[例(%)] | 17(68.0) | 38(64.4) | 0.100 | 0.751 |
| 败血症[例(%)] | 7(28.0) | 11(18.6) | 0.913 | 0.339 |
注:LDH.乳酸脱氢酶;HAART.高效抗反转录病毒治疗;IPI.国际预后指数;EBV. Epstein-Barr病毒;a.因回顾性数据资料部分缺失,LDH结果来源于82例ARL患者;b.表示因回顾性数据资料部分缺失,CD4+T淋巴细胞计数结果来源于81例ARL患者

艾滋病相关淋巴瘤患者预后影响因素的多因素Cox回归分析
艾滋病相关淋巴瘤患者预后影响因素的多因素Cox回归分析
| 因素 | β | SE | Wald(χ2)值 | HR值 | 95%可信区间(CI) | P值 |
|---|---|---|---|---|---|---|
| IPI评分>3分 | 1.628 | 0.509 | 10.214 | 5.094 | 1.877~13.824 | 0.001 |
| 利妥昔单抗治疗 | -1.039 | 0.431 | 5.813 | 0.354 | 0.152~ 0.823 | 0.016 |
注:IPI.国际预后指数
ARL患者早期发病隐匿,临床症状表现多样化,大多以无痛性肿物为首发症状,位置多以颈部、腋窝及腹股沟区淋巴结多见,缺乏临床特异性,常导致就诊时疾病进展至晚期[16,17,18]。本研究52.3%的患者伴随淋巴瘤B症状,84.5%患者就诊时处于Ⅲ~Ⅳ期,伴淋巴结节外受侵,IPI评分以中高、高危为主,与我国公开报道ARL的研究结果[16,17,18]一致。因此,在艾滋病的诊治过程中,对于临床上淋巴结肿大、不明原因发热等患者,需要积极筛查淋巴瘤,做到早发现、早诊断、早治疗,以提高治疗效果。
淋巴瘤通常发生于艾滋病期,随着CD4+T淋巴细胞计数减少,患者免疫功能严重缺陷,易发生多重感染,增加死亡的风险[19];同时低CD4+T淋巴细胞计数的患者对化疗的耐受性降低,易发生骨髓抑制而中断抗肿瘤治疗,导致疾病进展,预后不佳。本研究58.0%的患者基线CD4+T淋巴细胞计数≤200个/μL,化疗期间多合并感染,以呼吸、消化系统感染最多见,21.4%的患者发生败血症,7例因感染加重而死亡,严重影响患者生存质量。因此,当ARL患者接受化疗时,建议给予复方磺胺甲噁唑预防肺孢子菌肺炎和弓形虫病[20],密切随访并给予肠道抗菌药物预防感染;对于长期CD4+T淋巴细胞计数<50个/μL、粒细胞缺乏的化疗患者,给予抗菌药物预防感染或积极筛查感染的病原体,避免发生难以控制的重症感染。
本研究通过多因素分析显示,IPI评分>3分是ARL患者预后的独立危险因素,接受利妥昔单抗是患者预后的独立保护因素。IPI评分包括年龄、美国东部肿瘤协作组体能状态评分、结外病灶、Ann Arbor分期及血清LDH等指标。在HIV阴性淋巴瘤患者中,IPI评分是常用的预后评估体系,为诊断侵袭性NHL患者提供预后信息,可有效地指导临床治疗[8]。多项研究发现,IPI评分>3分是ARL患者的预后影响因素[21,22],提示IPI评分有助于评估ARL患者的预后,指导治疗。但也有研究发现,IPI评分不是ARL患者的预后危险因素[16],其包含的年龄、LDH、结外病灶等指标有助于评估患者预后[13]。其中血清LDH被认为是最重要的预后因素之一,并认为LDH值在预计长期生存时比淋巴瘤Ann Arbor分期更精确[21]。此外,有研究表明,高水平LDH与ARL患者高肿瘤负荷和侵袭性密切相关,可导致预后不佳[13,16,17,23]。LDH是一种由坏死细胞释放的糖酵解酶,高水平LDH是氧化应激和炎症的标志物。由于肿瘤组织长期处于缺氧状态,抑制缺氧诱导因子-1(Hypoxia inducible factor-1,HIF-1α)的降解[24],累积的高水平HIF-1再次激发无氧酵解和堆积LDH。LDH将丙酮酸催化成乳酸,产生的大量乳酸会导致肿瘤周边正常细胞的死亡、促进癌细胞的转移、对化疗产生抵抗性等,为肿瘤的生长、侵袭和转移提供了条件[25,26]。本研究单因素分析发现LDH和患者预后相关,但多因素分析中无统计学意义,可能和纳入研究的患者样本量较少有关。研究发现,接受利妥昔单抗治疗,明显提高了ARL患者的无进展生存期和总生存期,显著改善CD4+T淋巴细胞计数≥50个/μL ARL患者的预后[6]。本研究结果也发现接受利妥昔单抗治疗是ARL患者预后的保护因素。一项Ⅱ期研究AMC034发现,在ARL患者中,早期进行利妥昔单抗治疗可提高完全反应率,但生存率未明显改善[27]。一项意大利队列研究发现,在HIV阳性的弥漫性大B细胞淋巴瘤患者中,利妥昔单抗治疗没有生存益处[28]。各项研究在利妥昔单抗治疗的疗效方面出现相互矛盾的结果,未来还需在大样本、多中心、前瞻性队列研究中进一步验证利妥昔单抗治疗和ARL患者预后的关系。
在ART时代之前,ARL患者化疗后不良反应大,缓解期短,低剂量方案是标准治疗。进入ART时代后,艾滋病相关NHL患者2年总生存期提高到67%[29],本研究84例ARL患者的1年生存率是70.2%,与前结果相近。化疗联合HAART治疗可以提高ARL患者的生存率[16,17,18]。因此,化疗和HAART治疗是ARL患者存活的重要措施。可能是因为HAART治疗后病毒载量降低,免疫功能改善,预期患者可以更好地耐受化疗,机会性感染减少,整体结局预期也会改善。经荟萃分析和研究证实,HAART联合规范化化疗可以提高患者生存率,改善患者预后[6,17,30]。然而,在本研究中,未发现HAART或化疗和患者预后相关,可能和患者样本量较少相关,回顾性研究产生的选择偏倚也可能是原因之一。根据临床实践,建议ARL患者尽早启动HAART,但需要注意抗病毒药物和化疗药物重叠的不良反应及潜在的药物相互作用[2]。研究表明,基于蛋白酶抑制剂的ART与ARL患者较差生存率相关[31],建议以整合酶抑制剂为基础的方案,有效控制HIV病毒的复制,同时尽可能减少药物相互作用和骨髓抑制作用[7]。
本研究局限性:(1)随访时间有限,通过存活/死亡评估预后,并未对无进展生存期做进一步分析;(2)本研究为单中心的回顾性研究,样本量有限,ARL患者病情复杂,结论仍需要进行多中心、大样本、前瞻性的研究队列进一步验证。
综上所述,ARL患者临床表现多样,就诊时多是晚期,易合并感染,IPI评分>3分和患者预后不佳相关,积极的利妥昔单抗治疗可能改善ARL患者的预后。
惠疆锦,万智凯,郎观晶,等.艾滋病相关淋巴瘤84例临床特征和预后分析[J].中华临床感染病杂志,2022,15(6):448-453.DOI:10.3760/cma.j.issn.1674-2397.2022.06.003.
所有作者均声明不存在利益冲突



























