
通过血流感染病原菌谱及其耐药性的监测,为临床血流感染治疗和合理用药提供参考。
收集全国血流感染细菌耐药监测联盟(BRICS)成员单位2021年1至12月所有分离自血培养的病原菌,按美国临床和实验室标准化研究所(CLSI)推荐的稀释法进行抗菌药物敏感性测定。采用WHONET 5.6进行分析统计。
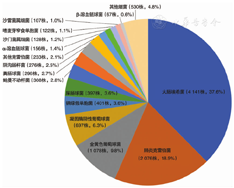
共收集51家成员单位11 013株病原菌,其中革兰阳性菌为2 782株(25.3%),革兰阴性菌8 231株(74.7%)。前10位病原菌为大肠埃希菌4 141株(37.6%)、肺炎克雷伯菌2 076株(18.9%)、金黄色葡萄球菌1 078株(9.8%)、凝固酶阴性葡萄球菌697株(6.3%)、铜绿假单胞菌401株(3.6%)、屎肠球菌397株(3.6%)、鲍曼不动杆菌308株(2.8%)、粪肠球菌296株(2.7%)、阴沟肠杆菌276株(2.5%)和其他克雷伯菌属233株(2.1%)。耐甲氧西林金黄色葡萄球菌(MRSA)和耐甲氧西林凝固酶阴性葡萄球菌流行率分别为25.3%和76.8%,未检测到对糖肽类和达托霉素耐药葡萄球菌属;金黄色葡萄球菌对头孢比罗的敏感率>95.0%。未检测到耐万古霉素肠球菌。产超广谱β-内酰胺酶大肠埃希菌、肺炎克雷伯菌、奇异变形杆菌分别为49.6%、25.5%和39.0%;耐碳青霉烯类大肠埃希菌、肺炎克雷伯菌分别为2.2%和15.8%;7.9%耐碳青霉烯类肺炎克雷伯菌对头孢他啶/阿维巴坦耐药。头孢比罗对超广谱β-内酰胺酶阴性大肠埃希菌和肺炎克雷伯菌具有较强的抗菌活性。耐碳青霉烯类大肠埃希菌、肺炎克雷伯菌对氨曲南/阿维巴坦敏感性较高。鲍曼不动杆菌对碳青霉烯类的耐药率为60.0%,对多黏菌素B和替加环素耐药率低,分别为5.5%和4.5%;铜绿假单胞菌对碳青霉烯类的耐药率为18.9%。
我国血流感染病原体以革兰阴性菌为主,且大肠埃希菌占1/3;MRSA的流行率呈进一步下降趋势,耐万古霉素肠球菌仍然处于较低水平;耐碳青霉烯肺炎克雷伯菌仍呈较高水平流行,但已有下降趋势,耐碳青霉烯类大肠埃希菌处于较低水平流行。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
血流感染(Bloodstream infection,BSI)是临床严重感染,正确选择抗菌药物可以提高对血流感染的治疗有效率[1,2]。临床医师对抗菌药物的选择主要依据临床感染状况以及感染病原体流行状况,细菌耐药监测结果对指导正确的抗感染治疗具有十分重要的价值。病原体分布、抗菌药物使用、人口构成和医疗服务等都可能影响血流感染的病原体流行病学。因此,需要持续更新血流感染病原体谱和抗菌药物敏感性的趋势,以支持恰当的感染治疗,并为临床抗感染治疗指南的编写提供依据。
全国血流感染细菌耐药监测联盟(Bacterial resistant investigation collaborative system,BRICS)涵盖全国16个省市51家医院,这一监测系统的优点包括地理覆盖范围广,收集的数据量大,而且数据可随时作为实验室的常规输出持续提供。本研究通过对2021年我国血流感染病原谱和耐药谱的全面分析,并对照BRICS连续监测结果,掌握细菌耐药变化趋势,为临床血流感染治疗和耐药控制提供参考。
2021年成员单位包括20家省级医院和31家地市级医院,参加单位均有独立的微生物实验室和固定微生物检验人员,拥有血培养仪、微生物鉴定和药敏仪器,采用规范化微生物检验流程,室间和室内质控合格。
收集2021年1月1日至12月31日成员单位分离自血流感染的细菌,具体按照《全国临床检验操作规程》(第四版)[3]及BRICS监测方案进行标本采集、培养及菌株鉴定,包括常规生化鉴定和自动化仪器鉴定;单瓶培养阳性的凝固酶阴性葡萄球菌、芽孢杆菌属、草绿色链球菌、棒状杆菌属、丙酸杆菌属、气球菌属、微球菌属等,排除污染菌;剔除所有布鲁菌,并剔除同一患者重复菌株;菌株统一保存于Microbank冻存管并置-80 ℃贮存。成员单位将临床分离的菌株按季度统一转送至传染病诊治国家重点实验室,实验室收到菌种后进行菌株的复核鉴定,并入库保存。
青霉素G(批号:130437-201707,效价:94.1%)、苯唑西林(批号:130482-201402,效价:90%)、他唑巴坦(批号:130511-201904,效价:99.5%)、舒巴坦(批号:130430-201408,效价:99%)、头孢唑啉(批号:130421-201204,效价:99%)、头孢曲松(批号:130480-201504,效价:98%)、头孢吡肟(批号:130524-201404,效价:84.4%)、头孢西丁(批号:130572-201603,效价:95.1%)、美罗培南(批号:130506-201403,效价:87%)、阿米卡星(批号:130335-200204,效价:65.5 %)、左氧氟沙星(批号:130455-201607,效价:97%)、克林霉素(批号:130422-201306,效价:84.9%)、红霉素(批号:130307-201417,效价:93.3%)、四环素(批号:130306-201419,效价:96.9%)、甲氧苄啶(批号:100031-201606,效价:99%)、利福平(批号:130496-201403,效价:98.8%)购自中国食品药品生物制品检定院;阿莫西林(批号:F0130A,效价:90%)、氨苄西林(批号:M0621AS,效价:98%)、克拉维酸(批号:01018BS,效价:95%)、哌拉西林(批号:J0601A,效价:95%)、头孢呋辛(批号:M0214A,浓度:855 μg/mg)、头孢哌酮(批号:J0602A,效价:98%)、头孢他啶(批号:J1230A,效价:94%)、阿维巴坦(批号:N0323A,效价:99%)、拉氧头孢(批号:00701A,效价:99%)、环丙沙星(批号:D1201A,效价:99%)、莫西沙星(批号:A1201A,效价:99%)、亚胺培南(批号:A0401A,效价:95%)、厄他培南(批号:S0802A,效价:90%)、磺胺甲噁唑(批号:321A026,效价:99.5%)、庆大霉素(批号:A0320AS,浓度:590 IU/mg)、磷霉素(批号:M0101A,效价:96%)、氨曲南(批号:00705A,效价:95%)、米诺环素(批号:D1231A,效价:98%)为大连美仑生物技术有限公司商品;头孢比罗(批号:YF-BAL9141-000-211209-01,效价:91.3%)为华润九新药业有限公司产品;替加环素、利奈唑胺、万古霉素、达托霉素肉汤稀释法药敏测定板为温州康泰生物科技有限公司定制产品,抗菌药物纸片(头孢他啶、头孢他啶/克拉维酸、头孢噻肟、头孢噻肟/克拉维酸和头孢西丁纸片)为英国Oxoid公司商品。
参考美国临床和实验室标准化研究所(CLSI)[4]推荐,药物敏感性测定中采用大肠埃希菌ATCC25922、铜绿假单胞菌ATCC27853、肺炎克雷伯菌ATCC700603、金黄色葡萄球菌ATCC29213、粪肠球菌ATCC29212、肺炎链球菌ATCC49619为质控菌株。上述菌株均为本实验室常备菌株。
Mueller-Hinton(MH)琼脂为英国Oxoid公司产品,液体培养基经钙离子调节的Mueller-Hinton肉汤(CAMHB)和6-磷酸-葡萄糖为Sigma公司产品,CaCl2、NaOH、NaCl均为生工生物工程(上海)股份有限公司产品,磷酸盐缓冲液(PBS)为吉诺生物医药技术有限公司产品。
按CLSI推荐的双纸片扩散法进行[4],包括检测大肠埃希菌、肺炎克雷伯菌和奇异变形杆菌菌株。
按CLSI推荐的头孢西丁(30 μg)纸片法进行,培养温度33~35 ℃。判断标准:对于金黄色葡萄球菌培养16~18 h判读结果,头孢西丁纸片扩散法的抑菌圈直径≥22 mm,判读为甲氧西林敏感金黄色葡萄球菌(Methicillin-susceptible Staphylococcus aureus,MSSA);直径≤21 mm,判读为甲氧西林耐药金黄色葡萄球菌(Methicillin-resistant Staphylococcus aureus,MRSA)。对于凝固酶阴性葡萄球菌(Coagulase-negative Staphylococcus,CNS),除外伪中间葡萄球菌、施氏葡萄球菌和路邓葡萄球菌)培养24 h判读结果,头孢西丁纸片扩散法的抑菌圈直径≥25 mm,判读为甲氧西林敏感凝固酶阴性葡萄球菌(Methicillin-susceptible coagulase-negative Staphylococcus,MSCNS);直径≤24 mm,判读为耐甲氧西林凝固酶阴性葡萄球菌(Methicillin-resistant coagulase-negative Staphylococcus,MRCNS)。伪中间葡萄球菌和施氏葡萄球菌采用苯唑西林(1 μg)纸片法,培养16~18 h判读结果,纸片扩散法的抑菌圈直径≥18 mm,判读为甲氧西林敏感葡萄球菌。路邓葡萄球菌的检测和判读方法同金黄色葡萄球菌。
按CLSI推荐的红霉素(15 μg)和克林霉素(2 μg)纸片法对红霉素耐药且克林霉素非耐药的葡萄球菌属、肺炎链球菌和β-溶血链球菌进行克林霉素诱导试验,细菌对克林霉素耐药率按照诱导试验结果计算,最小抑菌浓度(MIC)按实际检测结果。
根据不同的抗菌药物和细菌,采用琼脂稀释法或肉汤稀释法,按照CLSI推荐的操作进行,结果判读抗菌药物折点参照CLSI[4]为主;若在CLSI尚无折点,判读结果参照欧洲抗菌药物敏感性试验委员会(EUCAST)标准[5];替加环素的折点参照美国食品和药品监督管理局(FDA)的标准。参照CLSI推荐,阿莫西林/克拉维酸按照2∶1的比例;哌拉西林/他唑巴坦中他唑巴坦固定浓度4 mg/L;头孢他啶/阿维巴坦和氨曲南/阿维巴坦中固定阿维巴坦浓度为4 mg/L;头孢哌酮/舒巴坦按照2∶1的比例进行测定[4]。
采用微量肉汤稀释法进行药敏测定的抗菌药物:多黏菌素B、替加环素、利奈唑胺、达托霉素、青霉素G(肠球菌、链球菌)、克林霉素(肠球菌、链球菌),以及测定链球菌对红霉素、复方磺胺甲噁唑、头孢呋辛、头孢曲松、头孢吡肟、美罗培南、万古霉素、四环素、左氧氟沙星和莫西沙星。其他药物采用琼脂稀释法进行药敏测定。
磷霉素的药敏测定为琼脂稀释法,在琼脂培养基中将6-磷酸-葡萄糖浓度补充至25 mg/L。肺炎链球菌、α-溶血链球菌和β-溶血链球菌的肉汤稀释法使用CAMHB,含有细胞溶解马血(LHB)(2.5~5%,v/v);在检测达托霉素时添加钙离子浓度至50 mg/L;进行葡萄球菌苯唑西林药敏时,需在MH琼脂中加入终浓度为4%的NaCl。
采用WHONET 5.6进行药敏统计分析。
2021年1月1日至12月31日,16个省市区的51家成员单位,共收集到11 856株细菌,经复核,删除843株不符合要求的菌株,包括304株重复菌株,323株经复核后菌名有误,121株为污染菌株,65株单瓶阳性的凝固酶阴性葡萄球菌,30株其他微生物(包括真菌、厌氧菌和少见病原菌等);11 013株细菌进行药物敏感性测定。
11 013株细菌中,革兰阳性菌为2 782株(25.3%),革兰阴性菌8 231株(74.7%),其中大肠埃希菌、肺炎克雷伯菌、金黄色葡萄球菌、凝固酶阴性葡萄球菌和铜绿假单胞菌为前5位的主要分离病原菌,占总病原菌分离株数的76.2%(8 393/11 013)(图1)。

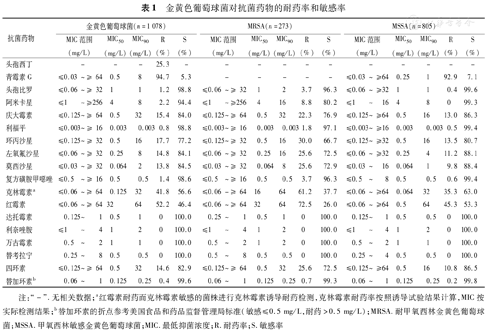
共分离到1 078株金黄色葡萄球菌,MRSA占25.3%(273/1 078);697株凝固酶阴性葡萄球菌中,MRCNS占76.8%(535/697)。金黄色葡萄球菌对万古霉素、达托霉素、替考拉宁和利奈唑胺均敏感;同时,无论是MRSA和MSSA,对阿米卡星、利福平和替加环素保持较高的敏感性。头孢比罗对MRSA和MSSA均有较好的抗菌活性,MIC50/90分别为1/2 mg/L和1/1 mg/L。CNS对达托霉素、万古霉素、替考拉宁和替加环素均敏感,有1.6%的CNS对利奈唑胺耐药。头孢比罗对MRSA和MRCNS的MIC50/90均为1/2 mg/L(表1和表2)。
金黄色葡萄球菌对抗菌药物的耐药率和敏感率
金黄色葡萄球菌对抗菌药物的耐药率和敏感率
| 抗菌药物 | 金黄色葡萄球菌(n=1 078) | MRSA(n=273) | MSSA(n=805) | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| MIC范围(mg/L) | MIC50(mg/L) | MIC90(mg/L) | R(%) | S(%) | MIC范围(mg/L) | MIC50(mg/L) | MIC90(mg/L) | R(%) | S(%) | MIC范围(mg/L) | MIC50(mg/L) | MIC90(mg/L) | R(%) | S(%) | |
| 头孢西丁 | - | - | - | 25.3 | - | - | - | - | - | - | - | - | - | - | - |
| 青霉素G | ≤0.03~≥ 64 | 0.5 | 8 | 94.7 | 5.3 | - | - | - | - | - | ≤0.03~≥64 | 0.25 | 1 | 92.9 | 7.1 |
| 头孢比罗 | ≤0.06~≥ 32 | 1 | 1 | 1.2 | 98.8 | ≤0.06~≥ 32 | 1 | 2 | 3.7 | 96.3 | ≤0.06~≥32 | 1 | 1 | 0.4 | 99.6 |
| 阿米卡星 | ≤1~≥256 | 4 | 8 | 2.2 | 94.4 | ≤1~≥256 | 4 | 16 | 8.8 | 80.2 | ≤1~16 | 4 | 8 | 0 | 99.3 |
| 庆大霉素 | ≤0.125~≥ 64 | 0.5 | 32 | 15.4 | 84.0 | ≤0.125~≥ 64 | 0.5 | 32 | 22.3 | 76.9 | ≤0.125~≥64 | 0.5 | 16 | 13.0 | 86.3 |
| 利福平 | ≤0.003~≥ 16 | 0.003 | 0.003 | 0.8 | 98.8 | ≤0.003~≥ 16 | 0.003 | 0.003 | 1.8 | 97.1 | ≤0.003~≥16 | 0.003 | 0.003 | 0.5 | 99.4 |
| 环丙沙星 | ≤0.125~≥ 32 | 0.5 | 16 | 17.7 | 77.2 | ≤0.125~≥ 32 | 0.5 | 16 | 30.0 | 66.7 | ≤0.125~≥32 | 0.5 | 16 | 13.5 | 80.7 |
| 左氧氟沙星 | ≤0.06~≥ 32 | 0.25 | 8 | 14.8 | 84.1 | ≤0.06~≥ 32 | 0.25 | 16 | 25.6 | 72.5 | ≤0.06~≥32 | 0.25 | 4 | 11.2 | 88.1 |
| 莫西沙星 | ≤0.03~≥ 32 | 0.064 | 2 | 13.8 | 84.5 | ≤0.03~≥ 32 | 0.064 | 8 | 25.6 | 72.9 | ≤0.03~16 | 0.064 | 1 | 9.8 | 88.4 |
| 复方磺胺甲噁唑 | ≤0.5~≥ 16 | 0.5 | 0.5 | 1.4 | 98.6 | ≤0.5~≥ 16 | 0.5 | 0.5 | 3.7 | 96.3 | ≤0.5~8 | 0.5 | 0.5 | 0.6 | 99.4 |
| 克林霉素a | ≤0.06~≥ 64 | 0.125 | 32 | 41.8 | 56.6 | ≤0.06-≥ 64 | 16 | 64 | 61.2 | 37.7 | ≤0.06~≥64 | 0.064 | 32 | 35.3 | 63.0 |
| 红霉素 | ≤0.06~≥ 64 | 32 | 64 | 52.2 | 46.4 | ≤0.06~≥ 64 | 32 | 64 | 72.5 | 26.0 | ≤0.06~≥64 | 0.5 | 64 | 45.3 | 53.3 |
| 达托霉素 | 0.125~1 | 0.5 | 1 | 0 | 100.0 | 0.25~1 | 0.5 | 1 | 0 | 100.0 | 0.125~1 | 0.5 | 0.5 | 0 | 100.0 |
| 利奈唑胺 | ≤1~4 | 1 | 2 | 0 | 100.0 | ≤1~4 | 1 | 2 | 0 | 100.0 | ≤1~4 | 1 | 2 | 0 | 100.0 |
| 万古霉素 | 0.5~2 | 1 | 1 | 0 | 100.0 | 0.5~2 | 1 | 2 | 0 | 100.0 | 0.5~2 | 1 | 1 | 0 | 100.0 |
| 替考拉宁 | 0.25~8 | 0.5 | 0.5 | 0 | 100.0 | 0.5~8 | 0.5 | 0.5 | 0 | 100.0 | 0.25~4 | 0.5 | 0.5 | 0 | 100.0 |
| 四环素 | ≤0.125~≥ 64 | 0.5 | 32 | 14.6 | 82.9 | ≤0.125~≥ 64 | 0.5 | 32 | 25.6 | 72.5 | ≤0.125~≥64 | 0.5 | 16 | 10.8 | 86.5 |
| 替加环素b | 0.06~1 | 0.125 | 0.25 | 0.4 | 99.6 | 0.06~1 | 0.125 | 0.25 | 0.7 | 99.3 | 0.06~1 | 0.125 | 0.25 | 0.2 | 99.8 |
注:"-".无相关数据;a红霉素耐药而克林霉素敏感的菌株进行克林霉素诱导耐药检测,克林霉素耐药率按照诱导试验结果计算,MIC按实际检测结果;b替加环素的折点参考美国食品和药品监督管理局标准(敏感≤0.5 mg/L,耐药>0.5 mg/L);MRSA.耐甲氧西林金黄色葡萄球菌;MSSA.甲氧西林敏感金黄色葡萄球菌;MIC.最低抑菌浓度;R.耐药率;S.敏感率
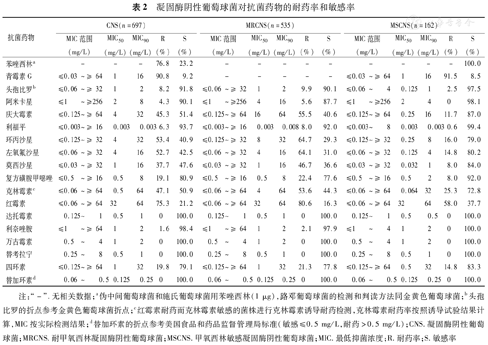
凝固酶阴性葡萄球菌对抗菌药物的耐药率和敏感率
凝固酶阴性葡萄球菌对抗菌药物的耐药率和敏感率
| 抗菌药物 | CNS(n=697) | MRCNS(n=535) | MSCNS(n=162) | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| MIC范围(mg/L) | MIC50(mg/L) | MIC90(mg/L) | R(%) | S(%) | MIC范围(mg/L) | MIC50(mg/L) | MIC90(mg/L) | R(%) | S(%) | MIC范围(mg/L) | MIC50(mg/L) | MIC90(mg/L) | R(%) | S(%) | |
| 苯唑西林a | - | - | - | 76.8 | 23.2 | - | - | - | - | - | - | - | - | - | 100.0 |
| 青霉素G | ≤0.03~≥ 64 | 1 | 16 | 90.8 | 9.2 | - | - | - | - | - | ≤0.03~≥ 64 | 1 | 16 | 91.5 | 8.5 |
| 头孢比罗b | ≤0.06~≥ 32 | 1 | 2 | 8.2 | 91.8 | ≤0.06~≥ 32 | 1 | 2 | 9.9 | 90.1 | ≤0.06~4 | 0.125 | 1 | 2.5 | 97.5 |
| 阿米卡星 | ≤1~≥256 | 2 | 8 | 4.3 | 90.1 | ≤1~≥256 | 4 | 16 | 5.6 | 87.7 | ≤1~≥256 | 2 | 4 | 0 | 98.1 |
| 庆大霉素 | ≤0.125~≥ 64 | 4 | 32 | 45.3 | 51.4 | ≤0.125~≥ 64 | 16 | 64 | 55.5 | 40.6 | ≤0.125~≥ 64 | 0.25 | 16 | 11.7 | 87.0 |
| 利福平 | ≤0.003~≥ 16 | 0.003 | 0.003 | 6.3 | 93.7 | ≤0.003~≥ 16 | 0.003 | 0.008 | 8.0 | 92.0 | ≤0.003~8 | 0.003 | 0.003 | 0.6 | 99.4 |
| 环丙沙星 | ≤0.125~≥ 32 | 4 | 32 | 53.4 | 40.9 | ≤0.125~≥ 32 | 8 | 32 | 64.7 | 29.3 | ≤0.125~≥ 32 | 0.25 | 8 | 16.0 | 79.0 |
| 左氧氟沙星 | ≤0.06~≥ 32 | 4 | 16 | 52.7 | 42.5 | ≤0.06~≥ 32 | 4 | 16 | 64.1 | 31.0 | ≤0.06~≥ 32 | 0.125 | 4 | 14.8 | 80.2 |
| 莫西沙星 | ≤0.03~≥ 32 | 1 | 16 | 37.7 | 47.6 | ≤0.03~≥ 32 | 1 | 16 | 46.7 | 36.6 | ≤0.03~≥ 32 | 0.032 | 1 | 8.0 | 84.0 |
| 复方磺胺甲噁唑 | ≤0.5~≥ 16 | 0.5 | 8 | 19.1 | 80.9 | ≤0.5~≥ 16 | 0.5 | 8 | 22.4 | 77.6 | ≤0.5~≥ 16 | 0.5 | 2 | 8.0 | 92.0 |
| 克林霉素c | ≤0.06~≥ 64 | 0.5 | 64 | 47.1 | 50.9 | ≤0.06~≥ 64 | 4 | 64 | 53.6 | 44.3 | ≤0.06~≥ 64 | 0.064 | 32 | 25.3 | 72.8 |
| 红霉素 | ≤0.06~≥ 64 | 32 | 64 | 75.3 | 21.2 | ≤0.06~≥ 64 | 32 | 64 | 80.6 | 16.3 | ≤0.06~≥ 64 | 32 | 64 | 58.0 | 37.7 |
| 达托霉素 | 0.125~1 | 0.5 | 1 | 0 | 100.0 | 0.125~1 | 0.5 | 1 | 0 | 100.0 | 0.125~1 | 0.5 | 0.5 | 0 | 100.0 |
| 利奈唑胺 | ≤1~≥ 64 | 1 | 2 | 1.6 | 98.4 | ≤1~≥ 64 | 1 | 2 | 2.1 | 97.9 | ≤1~4 | 1 | 2 | 0 | 100.0 |
| 万古霉素 | 0.5~4 | 1 | 2 | 0 | 100.0 | 0.5~4 | 1 | 2 | 0 | 100.0 | 0.5~4 | 1 | 2 | 0 | 100.0 |
| 替考拉宁 | 0.25~8 | 0.5 | 1 | 0 | 100.0 | 0.25~8 | 0.5 | 1 | 0 | 100.0 | 0.25~8 | 0.5 | 1 | 0 | 100.0 |
| 四环素 | ≤0.125~≥ 64 | 1 | 32 | 19.8 | 79.1 | ≤0.125~≥ 64 | 1 | 32 | 21.3 | 77.8 | ≤0.125~≥ 64 | 0.5 | 32 | 14.8 | 83.3 |
| 替加环素d | 0.06~0.5 | 0.125 | 0.25 | 0 | 100.0 | 0.06~0.5 | 0.125 | 0.25 | 0 | 100.0 | 0.06~0.5 | 0.125 | 0.25 | 0 | 100.0 |
注:"-".无相关数据;a伪中间葡萄球菌和施氏葡萄球菌用苯唑西林(1 μg),路邓葡萄球菌的检测和判读方法同金黄色葡萄球菌;b头孢比罗的折点参考金黄色葡萄球菌折点;c红霉素耐药而克林霉素敏感的菌株进行克林霉素诱导耐药检测,克林霉素耐药率按照诱导试验结果计算,MIC按实际检测结果;d替加环素的折点参考美国食品和药品监督管理局标准(敏感≤0.5 mg/L,耐药>0.5 mg/L);CNS.凝固酶阴性葡萄球菌;MRCNS.耐甲氧西林凝固酶阴性葡萄球菌;MSCNS.甲氧西林敏感凝固酶阴性葡萄球菌;MIC.最低抑菌浓度;R.耐药率;S.敏感率
屎肠球菌的检出率高于粪肠球菌,均未检出对万古霉素和替考拉宁耐药的肠球菌。屎肠球菌和粪肠球菌中,对达托霉素耐药的菌株分别占0.5%(2/397)和0.7%(2/296)。肠球菌属对利奈唑胺和替加环素显示较高的敏感性(均>95.0%)。与屎肠球菌相比,粪肠球菌及其他肠球菌属细菌对青霉素G、利福平、氟喹诺酮类和红霉素的敏感率高于屎肠球菌。头孢比罗对屎肠球菌和粪肠球菌的MIC50/90分别为64/64 mg/L和0.25/2 mg/L(表3)。
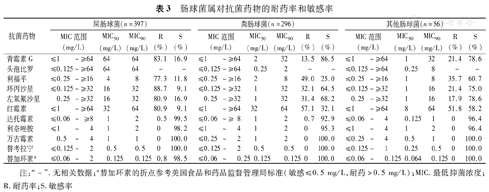
肠球菌属对抗菌药物的耐药率和敏感率
肠球菌属对抗菌药物的耐药率和敏感率
| 抗菌药物 | 屎肠球菌(n=397) | 粪肠球菌(n=296) | 其他肠球菌(n=56) | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| MIC范围(mg/L) | MIC50(mg/L) | MIC90(mg/L) | R(%) | S(%) | MIC范围(mg/L) | MIC50(mg/L) | MIC90(mg/L) | R(%) | S(%) | MIC范围(mg/L) | MIC50(mg/L) | MIC90(mg/L) | R(%) | S(%) | |
| 青霉素G | ≤1 ~≥64 | 64 | 64 | 83.1 | 16.9 | ≤1 ~≥64 | 2 | 32 | 13.5 | 86.5 | ≤1 ~≥64 | 1 | 32 | 21.4 | 78.6 |
| 头孢比罗 | ≤0.125~≥64 | 64 | 64 | - | - | ≤0.125~≥64 | 0.25 | 2 | - | - | ≤0.125~≥64 | 0.25 | 8 | - | - |
| 利福平 | ≤0.25~≥16 | 4 | 8 | 77.3 | 11.8 | ≤0.25~≥16 | 2 | 8 | 49.0 | 25.0 | ≤0.25~≥16 | 1 | 8 | 35.7 | 60.7 |
| 环丙沙星 | ≤0.125~≥32 | 16 | 32 | 88.7 | 9.1 | ≤0.125~≥32 | 1 | 32 | 32.1 | 64.5 | ≤0.125~≥32 | 1 | 16 | 21.4 | 75.0 |
| 左氧氟沙星 | 0.25~≥32 | 16 | 32 | 80.9 | 16.9 | 0.25~≥32 | 1 | 32 | 31.4 | 68.2 | 0.25~≥32 | 1 | 16 | 17.9 | 78.6 |
| 红霉素 | ≤1~≥64 | 32 | 64 | 80.9 | 9.1 | ≤1~≥64 | 32 | 64 | 57.1 | 32.1 | ≤1~≥64 | 8 | 64 | 51.8 | 58.2 |
| 达托霉素 | ≤0.06~≥8 | 1 | 2 | 0.5 | 99.5 | ≤0.06~≥ 8 | 1 | 2 | 0.7 | 92.9 | ≤0.06~4 | 0.125 | 1 | 0 | 96.4 |
| 利奈唑胺 | ≤1~4 | 1 | 2 | 0 | 98.2 | ≤1~4 | 1 | 2 | 0 | 95.3 | ≤1~4 | 1 | 2 | 0 | 96.4 |
| 万古霉素 | 0.5~4 | 1 | 1 | 0 | 100.0 | ≤0.25~2 | 1 | 2 | 0 | 100.0 | ≤0.25~4 | 0.5 | 1 | 0 | 100.0 |
| 替考拉宁 | ≤0.125~2 | 0.5 | 0.5 | 0 | 100.0 | ≤0.125~2 | 0.5 | 0.5 | 0 | 100.0 | ≤0.125~1 | 0.25 | 0.5 | 0 | 100.0 |
| 替加环素a | ≤0.06~2 | 0.125 | 0.125 | 0.8 | 98.5 | ≤0.06~0.25 | 0.125 | 0.125 | 0 | 100.0 | ≤0.06~0.125 | 0.064 | 0.125 | 0 | 100.0 |
注:"-".无相关数据;a替加环素的折点参考美国食品和药品监督管理局标准(敏感≤0.5 mg/L,耐药>0.5 mg/L);MIC.最低抑菌浓度;R.耐药率;S.敏感率
按注射青霉素G非脑膜炎折点,未发现耐青霉素肺炎链球菌。肺炎链球菌、β-溶血链球菌和α-溶血链球菌对利奈唑胺和万古霉素均敏感,对头孢曲松、头孢吡肟、美罗培南和达托霉素均有较高的敏感性。与肺炎链球菌相比,β-溶血链球菌和α-溶血链球菌对复方磺胺甲噁唑敏感性较高(表4)。
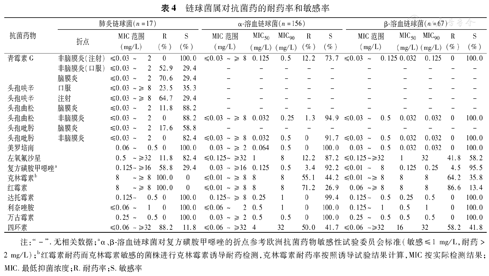
链球菌属对抗菌药的耐药率和敏感率
链球菌属对抗菌药的耐药率和敏感率
| 抗菌药物 | 肺炎链球菌(n=17) | α-溶血链球菌(n=156) | β-溶血链球菌(n=67) | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 折点 | MIC范围(mg/L) | R(%) | S(%) | MIC范围(mg/L) | MIC50(mg/L) | MIC90(mg/L) | R(%) | S(%) | MIC范围(mg/L) | MIC50(mg/L) | MIC90(mg/L) | R(%) | S(%) | |
| 青霉素G | 非脑膜炎(注射) | ≤0.03~ 2 | 0 | 100.0 | ≤0.03~≥ 8 | 0.125 | 0.5 | 12.2 | 73.7 | ≤0.03 ~ 0.125 | 0.032 | 0.125 | 0 | 100.0 |
| 非脑膜炎(口服) | ≤0.03~2 | 52.9 | 29.4 | - | - | - | - | - | - | - | - | - | - | |
| 脑膜炎 | ≤0.03~2 | 70.6 | 29.4 | - | - | - | - | - | - | - | - | - | - | |
| 头孢呋辛 | 口服 | ≤0.03~≥ 8 | 23.5 | 35.3 | - | - | - | - | - | - | - | - | - | - |
| 头孢呋辛 | 注射 | ≤0.03~≥ 8 | 64.7 | 29.4 | - | - | - | - | - | - | - | - | - | - |
| 头孢曲松 | 脑膜炎 | ≤0.03~2 | 11.8 | 88.2 | - | - | - | - | - | - | - | - | - | - |
| 头孢曲松 | 非脑膜炎 | ≤0.03~2 | 0 | 88.2 | ≤0.03~≥ 8 | 0.032 | 0.25 | 1.3 | 94.9 | ≤0.03~0.5 | 0.032 | 0.032 | 0 | 100.0 |
| 头孢吡肟 | 脑膜炎 | ≤0.03~2 | 17.6 | 58.8 | - | - | - | - | - | - | - | - | - | - |
| 头孢吡肟 | 非脑膜炎 | ≤0.03~2 | 0 | 82.4 | ≤0.03~≥ 8 | 0.032 | 0.5 | 0 | 91.7 | ≤0.03~0.5 | 0.032 | 0.032 | 0 | 100.0 |
| 美罗培南 | 0.06~0.5 | 0 | 100.0 | 0.03~≥ 2 | 0.064 | 0.5 | 0 | 100.0 | 0.03~0.5 | 0.032 | 0.032 | 0 | 100.0 | |
| 左氧氟沙星 | 0.5~≥32 | 11.8 | 82.4 | ≤0.125~≥32 | 1 | 8 | 12.2 | 87.2 | ≤0.125~≥32 | 1 | 32 | 41.8 | 58.2 | |
| 复方磺胺甲噁唑a | 0.125~≥16 | 58.8 | 29.4 | 0.03~≥16 | 0.125 | 0.5 | 3.4 | 92.2 | ≤0.01~8 | 0.125 | 0.25 | 4.5 | 95.5 | |
| 克林霉素b | 8~≥ 8 | 100.0 | 0 | ≤0.01~≥ 8 | 8 | 8 | 55.1 | 44.2 | ≤0.01~≥ 8 | 8 | 8 | 64.2 | 35.8 | |
| 红霉素 | 8~≥ 8 | 100.0 | 0 | ≤0.01~≥ 8 | 8 | 8 | 71.2 | 26.9 | 0.06~≥ 8 | 8 | 8 | 86.6 | 13.4 | |
| 达托霉素 | 0.125~0.5 | 0 | 100.0 | 0.125~≥ 8 | 0.25 | 1 | 0 | 99.4 | 0.125~0.5 | 0.25 | 0.5 | 0 | 100.0 | |
| 利奈唑胺 | ≤0.06~1 | 0 | 100.0 | ≤0.06~2 | 0.5 | 1 | 0 | 100.0 | 0.125~1 | 0.5 | 1 | 0 | 100.0 | |
| 万古霉素 | 0.25~0.5 | 0 | 100.0 | 0.03~≥ 2 | 0.5 | 0.5 | 0 | 100.0 | 0.25~0.5 | 0.5 | 0.5 | 0 | 100.0 | |
| 四环素 | ≤0.06~≥32 | 88.2 | 11.8 | ≤0.06~≥32 | 4 | 32 | 50.0 | 41.7 | ≤0.06~≥32 | 16 | 32 | 58.2 | 41.8 | |
注:"-".无相关数据;aα、β-溶血链球菌对复方磺胺甲噁唑的折点参考欧洲抗菌药物敏感性试验委员会标准(敏感≤1 mg/L,耐药>2 mg/L);b红霉素耐药而克林霉素敏感的菌株进行克林霉素诱导耐药检测,克林霉素耐药率按照诱导试验结果计算,MIC按实际检测结果;MIC.最低抑菌浓度;R.耐药率;S.敏感率
2.2%(92/4 141)为耐碳青霉烯类大肠埃希菌(Carbapenem-resistant Escherichia coli,CREC);在其他的4 049株大肠埃希菌中,有49.6%(2 007/4 049)为ESBLs(+)大肠埃希菌;与ESBLs(+)大肠埃希菌相比,ESBLs(-)大肠埃希菌对氨基糖苷类和氟喹诺酮类具有较高的敏感性;CREC对头孢他啶/阿维巴坦的敏感率为77.2%(MIC50/90为0.25/32 mg/L),对氨曲南/阿维巴坦的MIC50/90为0.064/4 mg/L,同时对多黏菌素B和替加环素仍有较高的敏感性,对阿米卡星和磷霉素的敏感率均>50.0%(表5)。
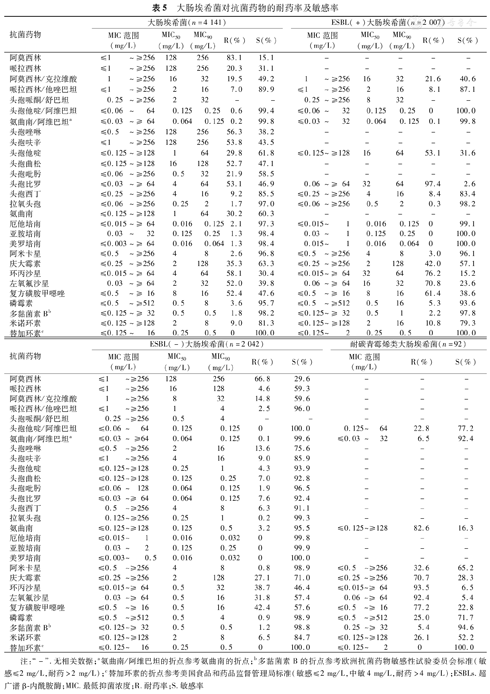
大肠埃希菌对抗菌药物的耐药率及敏感率
大肠埃希菌对抗菌药物的耐药率及敏感率
| 抗菌药物 | 大肠埃希菌(n=4 141) | ESBL(+)大肠埃希菌(n=2 007) | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| MIC范围(mg/L) | MIC50(mg/L) | MIC90(mg/L) | R(%) | S(%) | MIC范围(mg/L) | MIC50(mg/L) | MIC90(mg/L) | R(%) | S(%) | |
| 阿莫西林 | ≤1 ~≥256 | 128 | 256 | 83.1 | 15.1 | - | - | - | - | - |
| 哌拉西林 | ≤1 ~≥256 | 128 | 256 | 20.3 | 31.1 | - | - | - | - | - |
| 阿莫西林/克拉维酸 | 1~≥256 | 16 | 32 | 19.5 | 49.2 | 1~≥256 | 16 | 32 | 21.6 | 40.6 |
| 哌拉西林/他唑巴坦 | ≤1~≥256 | 2 | 16 | 7.0 | 89.9 | ≤1~≥256 | 2 | 16 | 8.1 | 87.1 |
| 头孢哌酮/舒巴坦 | 0.25~≥256 | 2 | 32 | - | - | 0.25~≥256 | 8 | 32 | - | - |
| 头孢他啶/阿维巴坦 | ≤0.06~64 | 0.125 | 0.25 | 0.6 | 99.4 | ≤0.06~32 | 0.125 | 0.25 | 0 | 100.0 |
| 氨曲南/阿维巴坦a | ≤0.03~≥ 64 | 0.064 | 0.125 | 0.2 | 99.8 | ≤0.03~32 | 0.064 | 0.125 | 0.1 | 99.8 |
| 头孢唑啉 | ≤0.5~≥256 | 128 | 256 | 56.3 | 38.2 | - | - | - | - | - |
| 头孢呋辛 | ≤1~≥256 | 128 | 256 | 53.8 | 43.5 | - | - | - | - | - |
| 头孢他啶 | ≤0.125~≥128 | 1 | 64 | 29.8 | 61.8 | ≤0.125~≥128 | 16 | 64 | 53.1 | 31.6 |
| 头孢曲松 | ≤0.125~≥128 | 16 | 128 | 52.7 | 47.1 | - | - | - | - | - |
| 头孢吡肟 | ≤0.06~≥256 | 0.5 | 32 | 21.9 | 58.5 | - | - | - | - | - |
| 头孢比罗 | ≤0.03~≥ 64 | 4 | 64 | 53.1 | 46.9 | 0.06~≥ 64 | 32 | 64 | 97.4 | 2.6 |
| 头孢西丁 | ≤0.25~≥256 | 4 | 16 | 9.2 | 85.5 | ≤0.25~≥256 | 4 | 16 | 8.4 | 83.4 |
| 拉氧头孢 | ≤0.06~≥256 | 0.25 | 2 | 1.7 | 97.0 | ≤0.06~≥256 | 0.5 | 2 | 0.3 | 98.2 |
| 氨曲南 | ≤0.125~≥128 | 1 | 64 | 30.2 | 60.3 | - | - | - | - | - |
| 厄他培南 | ≤0.015~≥ 64 | 0.016 | 0.125 | 2.1 | 97.3 | ≤0.015~1 | 0.016 | 0.125 | 0 | 99.1 |
| 亚胺培南 | 0.03~32 | 0.125 | 0.25 | 1.3 | 98.4 | 0.03~1 | 0.125 | 0.25 | 0 | 100.0 |
| 美罗培南 | ≤0.003~≥ 64 | 0.016 | 0.064 | 1.3 | 98.4 | 0.015~1 | 0.016 | 0.064 | 0 | 100.0 |
| 阿米卡星 | ≤0.5~≥256 | 4 | 8 | 2.6 | 96.8 | ≤0.5~≥256 | 4 | 8 | 3.0 | 96.1 |
| 庆大霉素 | ≤0.25~≥256 | 2 | 128 | 35.3 | 63.3 | ≤0.25~≥256 | 2 | 128 | 42.0 | 57.1 |
| 环丙沙星 | ≤0.015~≥ 64 | 4 | 64 | 58.1 | 30.4 | ≤0.015~≥ 64 | 32 | 64 | 76.2 | 15.2 |
| 左氧氟沙星 | 0.03~≥ 64 | 2 | 32 | 52.0 | 39.8 | 0.06~≥ 64 | 16 | 32 | 70.8 | 23.6 |
| 复方磺胺甲噁唑 | ≤0.5~≥ 16 | 8 | 16 | 52.4 | 47.6 | ≤0.5~≥ 16 | 8 | 16 | 61.4 | 38.6 |
| 磷霉素 | ≤0.5~≥512 | 0.5 | 8 | 3.6 | 95.7 | ≤0.5~≥512 | 0.5 | 16 | 5.3 | 93.6 |
| 多黏菌素Bb | ≤0.125~≥ 32 | 0.5 | 0.5 | 1.8 | 98.2 | ≤0.125~≥ 32 | 0.5 | 1 | 2.2 | 97.8 |
| 米诺环素 | ≤0.125~≥128 | 2 | 8 | 9.0 | 81.3 | ≤0.125~≥128 | 2 | 16 | 10.8 | 79.3 |
| 替加环素c | ≤0.125~16 | 0.25 | 0.5 | 0 | 100.0 | ≤0.125~2 | 0.25 | 0.5 | 0 | 100.0 |
| 抗菌药物 | ESBL(-)大肠埃希菌(n=2 042) | 耐碳青霉烯类大肠埃希菌(n=92) | ||||||
|---|---|---|---|---|---|---|---|---|
| MIC范围(mg/L) | MIC50(mg/L) | MIC90(mg/L) | R(%) | S(%) | MIC范围(mg/L) | R(%) | S(%) | |
| 阿莫西林 | ≤1~≥256 | 128 | 256 | 66.8 | 29.6 | - | - | - |
| 哌拉西林 | ≤1~≥256 | 16 | 128 | 4.6 | 59.3 | - | - | - |
| 阿莫西林/克拉维酸 | 1~≥256 | 8 | 32 | 14.8 | 59.6 | - | - | - |
| 哌拉西林/他唑巴坦 | ≤1~≥256 | 1 | 4 | 2.5 | 96.0 | - | - | - |
| 头孢哌酮/舒巴坦 | 0.25~≥256 | 0.5 | 4 | - | - | - | - | - |
| 头孢他啶/阿维巴坦 | ≤0.06~64 | 0.125 | 0.125 | 0 | 100.0 | 0.125~64 | 22.8 | 77.2 |
| 氨曲南/阿维巴坦a | ≤0.03~≥64 | 0.064 | 0.125 | 0.1 | 99.6 | ≤0.03~32 | 6.5 | 92.4 |
| 头孢唑啉 | ≤0.5~≥256 | 2 | 16 | 13.6 | 75.6 | - | - | - |
| 头孢呋辛 | ≤1~≥256 | 4 | 16 | 9.0 | 85.9 | - | - | - |
| 头孢他啶 | ≤0.125~≥128 | 0.25 | 1 | 4.3 | 93.9 | - | - | - |
| 头孢曲松 | ≤0.125~≥128 | 0.125 | 0.25 | 7.0 | 92.8 | - | - | - |
| 头孢吡肟 | ≤0.06~128 | 0.064 | 0.125 | 1.9 | 96.5 | - | - | - |
| 头孢比罗 | ≤0.03~≥ 64 | 0.064 | 0.125 | 7.6 | 92.4 | - | - | - |
| 头孢西丁 | 0.5~≥256 | 4 | 8 | 6.3 | 91.1 | - | - | - |
| 拉氧头孢 | 0.125~≥256 | 0.25 | 1 | 0.2 | 99.3 | - | - | - |
| 氨曲南 | ≤0.125~≥128 | 0.125 | 0.5 | 3.2 | 95.5 | ≤0.125~≥128 | 82.6 | 16.3 |
| 厄他培南 | ≤0.015~1 | 0.016 | 0.032 | 0 | 99.8 | - | - | - |
| 亚胺培南 | 0.03~2 | 0.125 | 0.25 | 0 | 99.9 | - | - | - |
| 美罗培南 | ≤0.003~0.5 | 0.016 | 0.032 | 0 | 100.0 | - | - | - |
| 阿米卡星 | ≤0.5~≥256 | 4 | 8 | 0.8 | 98.9 | ≤0.5~≥256 | 32.6 | 65.2 |
| 庆大霉素 | ≤0.25~≥256 | 2 | 128 | 27.1 | 71.0 | ≤0.25~≥256 | 70.7 | 28.3 |
| 环丙沙星 | ≤0.015~≥ 64 | 0.5 | 32 | 38.7 | 46.4 | ≤0.015~≥ 64 | 93.5 | 6.5 |
| 左氧氟沙星 | 0.03~≥ 64 | 0.5 | 16 | 31.8 | 57.4 | 0.06~≥ 64 | 92.4 | 5.4 |
| 复方磺胺甲噁唑 | ≤0.5~≥ 16 | 0.5 | 16 | 42.4 | 57.6 | ≤0.5~≥ 16 | 77.2 | 22.8 |
| 磷霉素 | ≤0.5~≥512 | 0.5 | 4 | 0.9 | 98.9 | ≤0.5~≥512 | 25.0 | 71.7 |
| 多黏菌素Bb | ≤0.125~≥ 32 | 0.5 | 0.5 | 1.2 | 98.8 | 0.25~≥ 32 | 5.4 | 94.6 |
| 米诺环素 | ≤0.125~≥128 | 2 | 8 | 6.5 | 84.7 | ≤0.125~≥128 | 26.1 | 52.2 |
| 替加环素c | ≤0.125~16 | 0.25 | 0.5 | 0 | 100.0 | ≤0.125~2 | 0 | 100.0 |
注:"-".无相关数据;a氨曲南/阿维巴坦的折点参考氨曲南的折点;b多黏菌素B的折点参考欧洲抗菌药物敏感性试验委员会标准(敏感≤2 mg/L,耐药>2 mg/L);c替加环素的折点参考美国食品和药品监督管理局标准(敏感≤2 mg/L,中敏4 mg/L,耐药>4 mg/L);ESBLs.超广谱β-内酰胺酶;MIC.最低抑菌浓度;R.耐药率;S.敏感率
2 076株肺炎克雷伯菌中,有1 748株为非碳青霉烯耐药株,其中ESBLs(+)肺炎克雷伯菌占25.5%(446/1 748);与ESBLs(+)肺炎克雷伯菌相比,ESBLs(-)肺炎克雷伯菌对氨基糖苷类、氟喹诺酮类、米诺环素和复方磺胺甲噁唑敏感率较高;耐碳青霉烯类肺炎克雷伯菌(Carbapenem-resistant Klebsiella pneumoniae,CRKP)占15.8%(328/2 076),对头孢他啶/阿维巴坦、多黏菌素B和替加环素的体外敏感率均>90.0%(表6)。
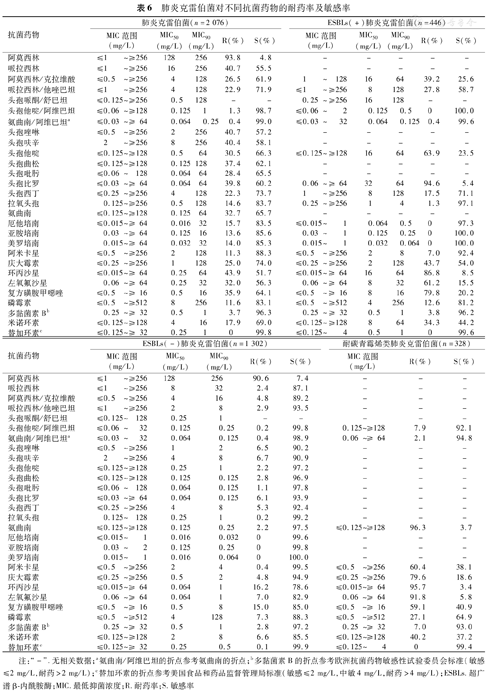
肺炎克雷伯菌对不同抗菌药物的耐药率及敏感率
肺炎克雷伯菌对不同抗菌药物的耐药率及敏感率
| 抗菌药物 | 肺炎克雷伯菌(n=2 076) | ESBLs(+)肺炎克雷伯菌(n=446) | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| MIC范围(mg/L) | MIC50(mg/L) | MIC90(mg/L) | R(%) | S(%) | MIC范围(mg/L) | MIC50(mg/L) | MIC90(mg/L) | R(%) | S(%) | |
| 阿莫西林 | ≤1 ~≥256 | 128 | 256 | 93.8 | 4.8 | - | - | - | - | - |
| 哌拉西林 | ≤1 ~≥256 | 16 | 256 | 40.7 | 55.5 | - | - | - | - | - |
| 阿莫西林/克拉维酸 | ≤0.5~≥256 | 4 | 128 | 26.5 | 61.9 | 1~128 | 16 | 64 | 39.2 | 25.6 |
| 哌拉西林/他唑巴坦 | ≤1~≥256 | 4 | 128 | 22.9 | 71.9 | ≤1~≥256 | 8 | 128 | 27.8 | 58.7 |
| 头孢哌酮/舒巴坦 | ≤0.125~≥256 | 0.5 | 128 | - | - | 0.25~≥256 | 16 | 128 | - | - |
| 头孢他啶/阿维巴坦 | ≤0.06~≥128 | 0.125 | 1 | 1.3 | 98.7 | ≤0.06~2 | 0.125 | 0.5 | 0 | 100.0 |
| 氨曲南/阿维巴坦a | ≤0.03~≥ 64 | 0.064 | 0.25 | 0.4 | 99.0 | ≤0.03~32 | 0.064 | 0.125 | 0.4 | 99.6 |
| 头孢唑啉 | ≤0.5~≥256 | 2 | 256 | 40.7 | 57.2 | - | - | - | - | - |
| 头孢呋辛 | 2~≥256 | 8 | 256 | 40.4 | 58.1 | - | - | - | - | - |
| 头孢他啶 | ≤0.125~≥128 | 0.5 | 64 | 30.5 | 66.3 | ≤0.125~≥128 | 16 | 64 | 63.9 | 23.5 |
| 头孢曲松 | ≤0.125~≥128 | 0.125 | 128 | 37.4 | 62.1 | - | - | - | - | - |
| 头孢吡肟 | ≤0.06~128 | 0.064 | 64 | 28.4 | 65.5 | - | - | - | - | - |
| 头孢比罗 | ≤0.03~≥ 64 | 0.064 | 64 | 39.8 | 60.2 | 0.06~≥ 64 | 32 | 64 | 94.6 | 5.4 |
| 头孢西丁 | ≤0.25~≥256 | 4 | 128 | 22.3 | 73.7 | 1~≥256 | 8 | 128 | 17.5 | 71.1 |
| 拉氧头孢 | 0.125~≥256 | 0.5 | 128 | 14.6 | 83.7 | 0.25~≥256 | 1 | 4 | 1.3 | 97.1 |
| 氨曲南 | ≤0.125~≥128 | 0.125 | 64 | 32.7 | 65.7 | - | - | - | - | - |
| 厄他培南 | ≤0.015~≥ 64 | 0.016 | 32 | 15.7 | 83.5 | ≤0.015~1 | 0.064 | 0.5 | 0 | 97.3 |
| 亚胺培南 | 0.03~≥ 64 | 0.125 | 16 | 13.6 | 85.6 | 0.03~1 | 0.125 | 0.25 | 0 | 100.0 |
| 美罗培南 | 0.015~≥ 64 | 0.032 | 32 | 14.0 | 85.3 | 0.015~1 | 0.032 | 0.064 | 0 | 100.0 |
| 阿米卡星 | ≤0.5~≥256 | 2 | 128 | 11.3 | 88.3 | ≤0.5~≥256 | 2 | 8 | 7.0 | 92.4 |
| 庆大霉素 | ≤0.25~≥256 | 1 | 128 | 25.0 | 74.0 | ≤0.25~≥256 | 2 | 128 | 43.7 | 54.0 |
| 环丙沙星 | ≤0.015~≥ 64 | 0.25 | 64 | 43.9 | 51.7 | ≤0.015~≥ 64 | 16 | 64 | 86.8 | 8.5 |
| 左氧氟沙星 | 0.06~≥ 64 | 0.25 | 32 | 32.0 | 56.3 | 0.06~≥ 64 | 8 | 32 | 61.2 | 15.5 |
| 复方磺胺甲噁唑 | ≤0.5~≥ 16 | 0.5 | 16 | 35.9 | 64.1 | ≤0.5~≥ 16 | 8 | 16 | 79.8 | 20.2 |
| 磷霉素 | ≤0.5~≥512 | 8 | 256 | 11.6 | 83.1 | ≤0.5~≥512 | 4 | 256 | 12.6 | 81.2 |
| 多黏菌素Bb | 0.25~≥ 32 | 0.5 | 1 | 3.7 | 96.3 | 0.25~≥ 32 | 0.5 | 1 | 3.8 | 96.2 |
| 米诺环素 | ≤0.125~≥128 | 4 | 16 | 17.9 | 69.0 | ≤0.125~≥128 | 8 | 64 | 34.3 | 44.2 |
| 替加环素c | ≤0.125~≥ 32 | 0.25 | 1 | 0 | 99.8 | ≤0.125~4 | 0.5 | 1 | 0 | 99.6 |
| 抗菌药物 | ESBLs(-)肺炎克雷伯菌(n=1 302) | 耐碳青霉烯类肺炎克雷伯菌(n=328) | ||||||
|---|---|---|---|---|---|---|---|---|
| MIC范围(mg/L) | MIC50(mg/L) | MIC90(mg/L) | R(%) | S(%) | MIC范围(mg/L) | R(%) | S(%) | |
| 阿莫西林 | ≤1~≥256 | 128 | 256 | 90.6 | 7.4 | - | - | - |
| 哌拉西林 | ≤1~≥256 | 8 | 32 | 2.4 | 87.1 | - | - | - |
| 阿莫西林/克拉维酸 | ≤0.5~≥256 | 4 | 16 | 4.8 | 89.2 | - | - | - |
| 哌拉西林/他唑巴坦 | ≤1~≥256 | 2 | 8 | 2.9 | 93.5 | - | - | - |
| 头孢哌酮/舒巴坦 | ≤0.125~128 | 0.25 | 1 | - | - | - | - | - |
| 头孢他啶/阿维巴坦 | ≤0.06~32 | 0.125 | 0.25 | 0.2 | 99.8 | 0.125~≥128 | 7.9 | 92.1 |
| 氨曲南/阿维巴坦a | ≤0.03~32 | 0.064 | 0.125 | 0.4 | 98.9 | 0.06~≥ 64 | 2.1 | 94.8 |
| 头孢唑啉 | ≤0.5~≥256 | 1 | 2 | 6.5 | 90.2 | - | - | - |
| 头孢呋辛 | 2~≥256 | 4 | 8 | 6.7 | 90.9 | - | - | - |
| 头孢他啶 | ≤0.125~≥128 | 0.25 | 1 | 2.2 | 97.2 | - | - | - |
| 头孢曲松 | ≤0.125~≥128 | 0.125 | 0.125 | 2.8 | 96.9 | - | - | - |
| 头孢吡肟 | ≤0.06~128 | 0.064 | 0.125 | 1.1 | 97.8 | - | - | - |
| 头孢比罗 | ≤0.03~≥ 64 | 0.064 | 0.125 | 6.1 | 93.9 | - | - | - |
| 头孢西丁 | ≤0.25~≥256 | 4 | 8 | 5.3 | 92.4 | - | - | - |
| 拉氧头孢 | 0.125~128 | 0.25 | 1 | 0.2 | 99.2 | - | - | - |
| 氨曲南 | ≤0.125~≥128 | 0.125 | 0.25 | 2.2 | 97.5 | ≤0.125~≥128 | 96.3 | 3.7 |
| 厄他培南 | ≤0.015~1 | 0.016 | 0.032 | 0 | 99.6 | - | - | - |
| 亚胺培南 | 0.03~2 | 0.125 | 0.25 | 0 | 99.8 | - | - | - |
| 美罗培南 | 0.015~1 | 0.016 | 0.064 | 0 | 100.0 | - | - | - |
| 阿米卡星 | ≤0.5~≥256 | 2 | 4 | 0.4 | 99.5 | ≤0.5~≥256 | 60.4 | 38.1 |
| 庆大霉素 | ≤0.25~≥256 | 0.5 | 2 | 4.8 | 94.9 | ≤0.25~≥256 | 79.6 | 18.6 |
| 环丙沙星 | ≤0.015~≥ 64 | 0.064 | 1 | 16.2 | 78.6 | ≤0.015~≥ 64 | 95.7 | 3.4 |
| 左氧氟沙星 | 0.06~≥ 64 | 0.064 | 1 | 7.0 | 82.9 | 0.06~≥ 64 | 91.8 | 5.8 |
| 复方磺胺甲噁唑 | ≤0.5~≥ 16 | 0.5 | 8 | 15.0 | 85.0 | ≤0.5~≥ 16 | 59.1 | 40.9 |
| 磷霉素 | ≤0.5~≥512 | 4 | 128 | 7.3 | 88.3 | ≤0.5~≥512 | 27.1 | 64.9 |
| 多黏菌素Bb | 0.25~≥ 32 | 0.5 | 1 | 2.8 | 97.2 | 0.25~≥ 32 | 7.0 | 93.0 |
| 米诺环素 | ≤0.125~≥128 | 2 | 8 | 6.6 | 85.5 | ≤0.125~≥128 | 40.2 | 37.2 |
| 替加环素c | ≤0.125~≥ 32 | 0.25 | 0.5 | 0.1 | 99.9 | ≤0.125~ 4 | 0 | 99.4 |
注:"-".无相关数据;a氨曲南/阿维巴坦的折点参考氨曲南的折点;b多黏菌素B的折点参考欧洲抗菌药物敏感性试验委员会标准(敏感≤2 mg/L,耐药>2 mg/L);c替加环素的折点参考美国食品和药品监督管理局标准(敏感≤2 mg/L,中敏4 mg/L,耐药>4 mg/L);ESBLs.超广谱β-内酰胺酶;MIC.最低抑菌浓度;R.耐药率;S.敏感率
与其他肠杆菌科细菌相比,变形杆菌属对包括二代头孢菌素在内的头孢菌素具有较好的敏感性,但对氟喹诺酮类的耐药率则高于其他细菌;其他克雷伯菌、阴沟肠杆菌、枸橼酸杆菌属、沙雷菌属和沙门菌属对三、四代头孢菌素以及氟喹诺酮类的耐药率均<30.0%,同时对头孢他啶/阿维巴坦、碳青霉烯类和阿米卡星均有较高的敏感率;其他克雷伯菌、阴沟肠杆菌、沙雷菌属、枸橼酸杆菌属和沙门菌属未发现对替加环素耐药菌株。ESBLs(+)奇异变形杆菌为39.0%(23/59)(表7,表8)。
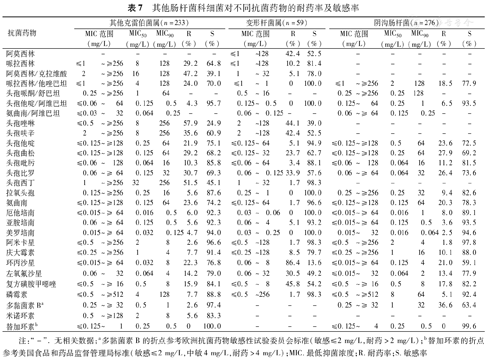
其他肠杆菌科细菌对不同抗菌药物的耐药率及敏感率
其他肠杆菌科细菌对不同抗菌药物的耐药率及敏感率
| 抗菌药物 | 其他克雷伯菌属(n=233) | 变形杆菌属(n=59) | 阴沟肠杆菌(n=276) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| MIC范围(mg/L) | MIC50(mg/L) | MIC90(mg/L) | R(%) | S(%) | MIC范围(mg/L) | R(%) | S(%) | MIC范围(mg/L) | MIC50(mg/L) | MIC90(mg/L) | R(%) | S(%) | |
| 阿莫西林 | - | - | - | - | - | ≤1 ~128 | 42.4 | 52.5 | - | - | - | - | - |
| 哌拉西林 | ≤1 ~≥256 | 8 | 128 | 29.2 | 64.8 | ≤1 ~128 | 10.2 | 81.4 | - | - | - | - | - |
| 阿莫西林/克拉维酸 | 2 ~≥256 | 16 | 128 | 47.2 | 39.1 | 1 ~32 | 5.1 | 78.0 | - | - | - | - | - |
| 哌拉西林/他唑巴坦 | ≤1 ~≥256 | 4 | 128 | 24.0 | 70.0 | ≤1 ~ 1 | 0 | 100.0 | ≤1 ~≥256 | 2 | 128 | 18.5 | 77.9 |
| 头孢哌酮/舒巴坦 | 0.25~≥256 | 1 | 64 | - | - | 0.5~16 | - | - | 0.25~≥256 | 0.25 | 128 | - | - |
| 头孢他啶/阿维巴坦 | ≤0.06~64 | 0.125 | 0.5 | 4.3 | 95.7 | 0.125~ 0.5 | 0 | 100.0 | 0.125~64 | 0.25 | 1 | 6.5 | 93.5 |
| 氨曲南/阿维巴坦 | ≤0.03~32 | 0.064 | 0.25 | - | - | 0.06~0.125 | - | - | 0.06~≥ 64 | 0.125 | 0.25 | - | - |
| 头孢唑啉 | ≤0.5~≥256 | 8 | 256 | 57.9 | 24.9 | 2~ 128 | 44.1 | 39.0 | - | - | - | - | - |
| 头孢呋辛 | 2~≥256 | 8 | 256 | 35.6 | 60.9 | 2~128 | 42.4 | 52.5 | - | - | - | - | - |
| 头孢他啶 | ≤0.125~≥128 | 0.25 | 64 | 21.9 | 75.1 | ≤0.125~64 | 5.1 | 94.9 | ≤0.125~≥128 | 0.5 | 64 | 23.6 | 72.5 |
| 头孢曲松 | ≤0.125~≥128 | 0.125 | 64 | 29.2 | 68.2 | ≤0.125~32 | 23.7 | 62.7 | ≤0.125~≥128 | 0.25 | 64 | 27.9 | 69.2 |
| 头孢吡肟 | ≤0.06~128 | 0.064 | 16 | 10.3 | 85.8 | ≤0.06~64 | 3.4 | 88.1 | ≤0.06~128 | 0.064 | 16 | 11.2 | 81.5 |
| 头孢比罗 | 0.06~≥ 64 | 0.125 | 32 | 30.7 | 69.3 | 0.06~0.125 | 33.9 | 57.6 | 0.06~≥ 64 | 0.064 | 32 | 26.4 | 73.6 |
| 头孢西丁 | 1~≥256 | 32 | 256 | 51.5 | 45.1 | 1~32 | 1.7 | 98.3 | - | - | - | - | - |
| 拉氧头孢 | 0.125~≥256 | 0.25 | 16 | 5.6 | 87.6 | 0.25~1 | 0 | 100.0 | 0.25~≥256 | 0.25 | 32 | 9.4 | 82.6 |
| 氨曲南 | ≤0.125~≥128 | 0.125 | 64 | 23.6 | 74.2 | ≤0.125~64 | 1.7 | 96.6 | ≤0.125~≥128 | 0.125 | 64 | 20.3 | 78.3 |
| 厄他培南 | ≤0.015~≥ 64 | 0.016 | 0.5 | 6.0 | 92.3 | 0.03~0.06 | 0 | 100.0 | ≤0.015~≥ 64 | 0.016 | 1 | 8.0 | 89.1 |
| 亚胺培南 | 0.06~≥ 64 | 0.125 | 0.5 | 5.6 | 92.3 | 0.06~4 | 5.1 | 93.2 | ≤0.015~≥ 64 | 0.125 | 0.5 | 3.6 | 93.5 |
| 美罗培南 | 0.015~≥ 64 | 0.032 | 0.125 | 4.7 | 94.0 | 0.03~0.25 | 0 | 100.0 | 0.015~32 | 0.016 | 0.064 | 2.5 | 94.6 |
| 阿米卡星 | ≤0.5~≥256 | 2 | 8 | 2.6 | 96.6 | ≤0.5~128 | 1.7 | 98.3 | ≤0.5~≥256 | 2 | 4 | 1.8 | 97.8 |
| 庆大霉素 | ≤0.25~≥256 | 1 | 4 | 7.7 | 91.4 | ≤0.25~128 | 8.5 | 79.7 | ≤0.25~≥256 | 1 | 16 | 10.1 | 88.0 |
| 环丙沙星 | ≤0.015~≥ 64 | 0.032 | 8 | 22.3 | 76.8 | 0.06~8 | 86.4 | 13.6 | ≤0.015~≥ 64 | 0.125 | 4 | 21.0 | 59.1 |
| 左氧氟沙星 | 0.06~32 | 0.064 | 4 | 14.2 | 79.0 | 0.06~32 | 30.5 | 49.2 | ≤0.015~32 | 0.064 | 2 | 13.4 | 77.9 |
| 复方磺胺甲噁唑 | ≤0.5~≥ 16 | 0.5 | 8 | 15.9 | 84.1 | ≤0.5~8 | 45.8 | 54.2 | ≤0.5~≥ 16 | 0.5 | 8 | 17.8 | 82.2 |
| 磷霉素 | ≤0.5~≥512 | 4 | 128 | 7.7 | 88.8 | ≤0.5~256 | 1.7 | 98.3 | ≤0.5~≥512 | 8 | 64 | 5.1 | 92.4 |
| 多黏菌素Ba | 0.25~≥ 32 | 0.5 | 1 | 2.6 | 97.4 | - | - | - | 0.25~≥ 32 | 1 | 32 | 36.6 | 63.4 |
| 米诺环素 | 0.5~≥128 | 2 | 8 | 5.6 | 83.3 | - | - | - | - | - | - | - | - |
| 替加环素b | ≤0.125~1 | 0.25 | 0.5 | 0 | 100.0 | - | - | - | ≤0.125~4 | 0.25 | 0.5 | 0 | 99.6 |
注:"-".无相关数据;a多黏菌素B的折点参考欧洲抗菌药物敏感性试验委员会标准(敏感≤2 mg/L,耐药>2 mg/L);b替加环素的折点参考美国食品和药品监督管理局标准(敏感≤2 mg/L,中敏4 mg/L,耐药>4 mg/L);MIC.最低抑菌浓度;R.耐药率;S.敏感率
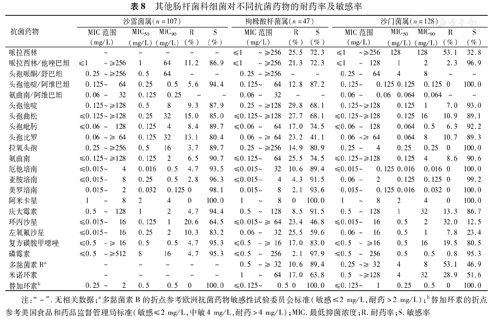
其他肠杆菌科细菌对不同抗菌药物的耐药率及敏感率
其他肠杆菌科细菌对不同抗菌药物的耐药率及敏感率
| 抗菌药物 | 沙雷菌属(n=107) | 枸橼酸杆菌属(n=47) | 沙门菌属(n=128) | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| MIC范围(mg/L) | MIC50(mg/L) | MIC90(mg/L) | R(%) | S(%) | MIC范围(mg/L) | R(%) | S(%) | MIC范围(mg/L) | MIC50(mg/L) | MIC90(mg/L) | R(%) | S(%) | |
| 哌拉西林 | - | - | - | - | - | ≤1 ~≥256 | 25.5 | 72.3 | ≤1 ~≥256 | 128 | 128 | 53.1 | 32.8 |
| 哌拉西林/他唑巴坦 | ≤1 ~≥256 | 1 | 64 | 11.2 | 86.9 | ≤1 ~≥256 | 21.3 | 72.3 | ≤1 ~128 | 1 | 2 | 2.3 | 96.9 |
| 头孢哌酮/舒巴坦 | 0.25~≥256 | 0.5 | 64 | - | - | 0.25~≥256 | - | - | 0.25~64 | 4 | 8 | - | - |
| 头孢他啶/阿维巴坦 | 0.125~64 | 0.25 | 0.5 | 5.6 | 94.4 | 0.125~64 | 12.8 | 87.2 | 0.125~0.125 | 0.125 | 0.125 | 0 | 100.0 |
| 氨曲南/阿维巴坦 | 0.06~32 | 0.125 | 0.25 | - | - | 0.06~32 | - | - | 0.06~0.06 | 0.064 | 0.064 | - | - |
| 头孢他啶 | 0.125~≥128 | 0.5 | 8 | 9.3 | 87.9 | 0.25~≥128 | 29.8 | 68.1 | 0.125~≥128 | 0.125 | 1 | 7.0 | 93.0 |
| 头孢曲松 | ≤0.125~≥128 | 0.25 | 32 | 15.0 | 85.0 | ≤0.125~≥128 | 27.7 | 68.1 | ≤0.125~≥128 | 0.125 | 16 | 10.9 | 89.1 |
| 头孢吡肟 | ≤0.06~128 | 0.125 | 4 | 8.4 | 89.7 | ≤0.06~64 | 17.0 | 74.5 | ≤0.06~128 | 0.064 | 0.5 | 6.3 | 92.2 |
| 头孢比罗 | 0.06~≥ 64 | 0.125 | 32 | 13.1 | 80.4 | 0.06~≥ 64 | 23.2 | 41.1 | 0.06~≥ 64 | 0.064 | 8 | 10.7 | 89.3 |
| 拉氧头孢 | 0.25~≥256 | 0.5 | 16 | 3.7 | 89.7 | 0.25~≥256 | 14.9 | 80.9 | 0.25~4 | 0.25 | 0.25 | 0 | 100.0 |
| 氨曲南 | ≤0.125~≥128 | 0.125 | 2 | 6.5 | 90.7 | ≤0.125~64 | 25.5 | 74.5 | ≤0.125~≥128 | 0.125 | 4 | 8.6 | 90.6 |
| 厄他培南 | ≤0.015~4 | 0.016 | 0.5 | 4.7 | 93.5 | ≤0.015~32 | 10.6 | 89.4 | ≤0.015~0.125 | 0.016 | 0.016 | 0 | 100.0 |
| 亚胺培南 | ≤0.015~8 | 0.25 | 0.5 | 2.8 | 96.3 | ≤0.015~4 | 4.3 | 91.5 | 0.06~2 | 0.125 | 0.125 | 0 | 99.2 |
| 美罗培南 | 0.015~2 | 0.032 | 0.125 | 0 | 98.1 | 0.015~8 | 2.1 | 93.6 | 0.015~0.125 | 0.016 | 0.032 | 0 | 100.0 |
| 阿米卡星 | 1~8 | 2 | 4 | 0 | 100.0 | 1~8 | 0 | 100.0 | 1~8 | 2 | 4 | 0 | 100.0 |
| 庆大霉素 | 0.5~128 | 1 | 2 | 4.7 | 94.4 | 0.5~128 | 8.5 | 91.5 | 0.5~128 | 1 | 32 | 13.3 | 86.7 |
| 环丙沙星 | ≤0.015~16 | 0.125 | 1 | 20.6 | 64.5 | ≤0.015~≥ 64 | 23.4 | 46.8 | ≤0.015~16 | 0.5 | 2 | 32.0 | 12.5 |
| 左氧氟沙星 | ≤0.015~16 | 0.25 | 2 | 10.3 | 83.2 | 0.06~32 | 25.5 | 59.6 | 0.06~16 | 0.5 | 1 | 7.8 | 23.4 |
| 复方磺胺甲噁唑 | ≤0.5~≥ 16 | 0.5 | 0.5 | 4.7 | 95.3 | ≤0.5~≥ 16 | 17.0 | 83.0 | ≤0.5~≥16 | 0.5 | 16 | 19.5 | 80.5 |
| 磷霉素 | ≤0.5~≥512 | 8 | 16 | 4.7 | 95.3 | ≤0.5~256 | 2.1 | 97.9 | ≤0.5~256 | 0.5 | 0.5 | 0.8 | 95.3 |
| 多黏菌素Ba | - | - | - | - | - | 0.5~≥ 32 | 10.6 | 89.4 | 0.25~≥ 32 | 4 | 8 | 53.1 | 46.9 |
| 米诺环素 | - | - | - | - | - | 1~64 | 17.0 | 63.8 | 0.5~≥128 | 4 | 32 | 28.9 | 51.6 |
| 替加环素b | 0.25~2 | 0.5 | 0.5 | 0 | 100.0 | ≤0.125~0.5 | 0 | 100.0 | ≤0.125~1 | 0.25 | 0.5 | 0 | 100.0 |
注:"-".无相关数据;a多黏菌素B的折点参考欧洲抗菌药物敏感性试验委员会标准(敏感≤2 mg/L,耐药>2 mg/L);b替加环素的折点参考美国食品和药品监督管理局标准(敏感≤2 mg/L,中敏4 mg/L,耐药>4 mg/L);MIC.最低抑菌浓度;R.耐药率;S.敏感率
耐碳青霉烯类鲍曼不动杆菌(Carbapenem-resistant Acinetobacter baumannii,CRAB)占63.0%(194/308)。鲍曼不动杆菌和CRAB仅对多黏菌素B和替加环素有较高的敏感率(均>88.0%),对其他抗菌药物敏感率均<50.0%(表9)。
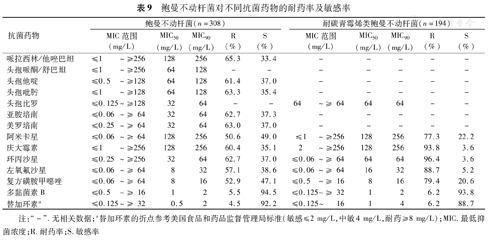
鲍曼不动杆菌对不同抗菌药物的耐药率及敏感率
鲍曼不动杆菌对不同抗菌药物的耐药率及敏感率
| 抗菌药物 | 鲍曼不动杆菌(n=308) | 耐碳青霉烯类鲍曼不动杆菌(n=194) | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| MIC范围(mg/L) | MIC50(mg/L) | MIC90(mg/L) | R(%) | S(%) | MIC范围(mg/L) | MIC50(mg/L) | MIC90(mg/L) | R(%) | S(%) | |
| 哌拉西林/他唑巴坦 | ≤1 ~≥256 | 128 | 256 | 65.3 | 33.4 | - | - | - | - | - |
| 头孢哌酮/舒巴坦 | ≤1 ~≥256 | 64 | 128 | - | - | - | - | - | - | - |
| 头孢他啶 | ≤0.5 ~≥128 | 64 | 128 | 61.4 | 37.0 | - | - | - | - | - |
| 头孢吡肟 | ≤1~≥128 | 64 | 128 | 63.3 | 35.4 | - | - | - | - | - |
| 头孢比罗 | ≤0.125~≥128 | 32 | 64 | - | - | 64 ~≥ 64 | 64 | 64 | - | - |
| 亚胺培南 | ≤0.06~≥ 64 | 32 | 64 | 62.7 | 37.3 | - | - | - | - | - |
| 美罗培南 | ≤0.25~≥ 64 | 32 | 64 | 63.0 | 37.0 | - | - | - | - | - |
| 阿米卡星 | ≤0.06~≥ 64 | 128 | 256 | 50.6 | 49.0 | ≤1 ~≥256 | 128 | 256 | 77.3 | 22.2 |
| 庆大霉素 | ≤1~≥256 | 128 | 256 | 60.4 | 35.1 | 2 ~≥256 | 128 | 256 | 93.8 | 3.6 |
| 环丙沙星 | ≤0.25~≥256 | 32 | 64 | 62.7 | 37.0 | ≤0.06~≥ 64 | 64 | 64 | 96.4 | 3.6 |
| 左氧氟沙星 | ≤0.06~≥ 64 | 8 | 32 | 57.1 | 38.6 | ≤0.06~≥ 64 | 16 | 32 | 88.7 | 5.2 |
| 复方磺胺甲噁唑 | ≤0.06~≥ 64 | 8 | 16 | 52.9 | 47.1 | ≤0.5~≥ 16 | 8 | 16 | 79.4 | 20.6 |
| 多黏菌素B | ≤0.5~≥ 16 | 1 | 2 | 5.5 | 94.5 | ≤0.125~≥ 32 | 1 | 2 | 6.2 | 93.8 |
| 替加环素a | ≤0.125~≥ 32 | 0.5 | 2 | 4.5 | 92.2 | ≤0.125~16 | 1 | 4 | 6.2 | 88.7 |
注:"-".无相关数据;a替加环素的折点参考美国食品和药品监督管理局标准(敏感≤2 mg/L,中敏4 mg/L,耐药≥8 mg/L);MIC.最低抑菌浓度;R.耐药率;S.敏感率
铜绿假单胞菌对美罗培南和亚胺培南的敏感率超过80.0%,而对除了环丙沙星外的其他抗菌药物敏感率均在75.0%以上;19.0%(76/401)为耐碳青霉烯类铜绿假单胞菌(Carbapenem-resistant Pseudomonas aeruginosa,CRPA)(表10)。
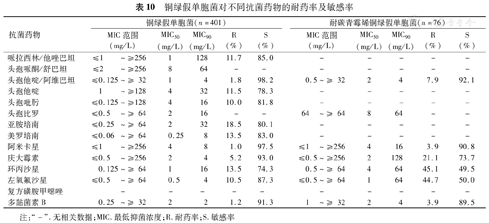
铜绿假单胞菌对不同抗菌药物的耐药率及敏感率
铜绿假单胞菌对不同抗菌药物的耐药率及敏感率
| 抗菌药物 | 铜绿假单胞菌(n=401) | 耐碳青霉烯铜绿假单胞菌(n=76) | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| MIC范围(mg/L) | MIC50(mg/L) | MIC90(mg/L) | R(%) | S(%) | MIC范围(mg/L) | MIC50(mg/L) | MIC90(mg/L) | R(%) | S(%) | |
| 哌拉西林/他唑巴坦 | ≤1 ~≥256 | 1 | 128 | 11.7 | 85.0 | - | - | - | - | - |
| 头孢哌酮/舒巴坦 | ≤2 ~≥256 | 8 | 64 | - | - | - | - | - | - | - |
| 头孢他啶/阿维巴坦 | ≤0.125~≥ 32 | 1 | 4 | 1.8 | 98.2 | 0.5~≥ 32 | 2 | 4 | 7.9 | 92.1 |
| 头孢他啶 | 1~≥128 | 4 | 32 | 11.5 | 78.3 | - | - | - | - | - |
| 头孢吡肟 | ≤0.125~≥128 | 4 | 16 | 10.0 | 81.8 | - | - | - | - | - |
| 头孢比罗 | ≤0.5~≥ 64 | 2 | 16 | - | - | 64~≥ 64 | 8 | 64 | - | - |
| 亚胺培南 | ≤0.25~≥ 64 | 2 | 32 | 18.5 | 80.1 | - | - | - | - | - |
| 美罗培南 | ≤0.06~≥ 64 | 0.25 | 8 | 13.5 | 83.0 | - | - | - | - | - |
| 阿米卡星 | ≤1~≥256 | 4 | 8 | 1.0 | 97.5 | ≤1~≥256 | 4 | 16 | 3.9 | 90.8 |
| 庆大霉素 | ≤0.5~≥256 | 2 | 4 | 5.2 | 93.0 | ≤0.5~≥256 | 2 | 128 | 21.1 | 73.7 |
| 环丙沙星 | 0.125~≥ 64 | 1 | 16 | 13.5 | 74.3 | 0.5~≥ 64 | 4 | 64 | 45.1 | 49.5 |
| 左氧氟沙星 | ≤0.5~≥ 64 | 0.5 | 4 | 10.5 | 87.3 | ≤0.5~≥ 64 | 1 | 64 | 44.7 | 50.0 |
| 复方磺胺甲噁唑 | - | - | - | - | - | - | - | - | - | - |
| 多黏菌素B | 0.25~≥ 32 | 2 | 2 | 1.2 | 91.3 | 1~≥ 32 | 2 | 4 | 3.9 | 89.5 |
注:"-".无相关数据;MIC.最低抑菌浓度;R.耐药率;S.敏感率
122株嗜麦芽窄食单胞菌对头孢他啶、左氧氟沙星和复方磺胺甲噁唑的敏感率均在70.0%以上(表11)。
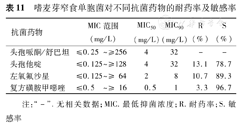
嗜麦芽窄食单胞菌对不同抗菌药物的耐药率及敏感率
嗜麦芽窄食单胞菌对不同抗菌药物的耐药率及敏感率
| 抗菌药物 | MIC范围(mg/L) | MIC50(mg/L) | MIC90(mg/L) | R(%) | S(%) |
|---|---|---|---|---|---|
| 头孢哌酮/舒巴坦 | ≤0.25~≥256 | 4 | 32 | - | - |
| 头孢他啶 | ≤0.125~≥128 | 4 | 32 | 13.1 | 78.7 |
| 左氧氟沙星 | ≤0.125~≥ 64 | 2 | 8 | 10.7 | 89.3 |
| 复方磺胺甲噁唑 | ≤0.5~≥ 16 | 0.5 | 1 | 3.3 | 96.7 |
注:"-".无相关数据;MIC.最低抑菌浓度;R.耐药率;S.敏感率
自2014年起,BRICS对全国不同地区引起血流感染的细菌进行耐药监测,并形成不同年度的监测报告。在2021年度中,革兰阴性菌引起的血流感染仍呈上升趋势。有研究表明,患者高龄,合并多种基础疾病,长期住院及耐药性改变等因素均可导致革兰阴性菌血流感染的发生[6,7]。值得注意的是,大肠埃希菌和肺炎克雷伯菌引起的血流感染超过50.0%。历年的BRICS监测显示,大肠埃希菌所占比例均在30.0%以上,与英国监测报告类似,大肠埃希菌引起近1/3的血流感染,约占革兰阴性菌的54.0%,且比例还在逐年增加[8]。有报道称,尿路感染、耐三代头孢菌素等都可能导致包括大肠埃希菌在内的革兰阴性菌引起血流感染[9,10]。因此,鉴于革兰阴性菌血流感染导致的病死率及产生的医疗经济负担,需要采取相应的措施减少发生率,包括强化院感措施减少院内血流感染的发生、更为合理地使用抗菌药物等。
金黄色葡萄球菌是引起血流感染的主要革兰阳性菌,在本次监测中,MRSA的流行率较前持续下降,由2014年的33.9%下降到25.3%[11]。欧洲MRSA的分离率也从2015年的19.0%下降到2019年的15.5%,本研究的监测结果与其类似[12]。据一项西班牙30年MRSA引起的血流感染监测报告显示,尽管CC5-Ⅳ为主要的流行克隆,但CC8-Ⅳ和CC22-Ⅳ有逐渐上升的趋势,同时MRSA对抗菌药物的耐药率也呈下降趋势[13]。但国外有报道称,在新型冠状病毒流行前,美国引起血流感染的MRSA呈逐年下降趋势,而在2020年下半年,MRSA引起的血流感染率则上升了近25%[14,15]。因此,在后疫情时期,我国MRSA血流感染是否具有类似的现象需要进一步监测和分析。根据英国治疗MRSA血流感染指南,首选万古霉素用于非复杂性感染,利奈唑胺为万古霉素的替代药物;达托霉素或替考拉宁为二线药物[16]。本监测中,未发现对上述抗菌药物耐药的金黄色葡萄球菌。尽管单瓶培养阳性的CNS被认为污染菌而排除,但CNS在血流感染病原谱中仍占有一定的比例。历年的BRICS监测显示,CNS约占总分离病原菌的6%~8%,且每年的抗菌谱基本保持稳定[17]。
与国外粪肠球菌引起血流感染为主不同[18],BRICS历年监测表明,在我国血流感染以屎肠球菌为主[17]。同时,全球SENTRY抗菌药物20年监测显示,在1997年有16%的肠球菌分离株对万古霉素耐药,且其耐药率稳步增加[19];但在BRICS的监测中,血流感染肠球菌对万古霉素始终保持较低的耐药率,这与国内其他报道相一致[20]。青霉素和第三、四代头孢菌素对肺炎链球菌和溶血链球菌具有较好的抗菌活性。因此,在治疗相应病原菌感染时,应结合菌株耐药谱来选择合适的抗菌药物。
根据瑞士ANRESIS研究,大肠埃希菌是引起血流感染最常见的病原菌,而三代头孢菌素耐药的大肠埃希菌感染是治疗面临的一大挑战[21]。与欧美国家ESBL(+)大肠埃希菌的分离率(11.9%~30.0%)相比[12,22],本监测中ESBL(+)大肠埃希菌的分离率为49.6%,与上一年度相比,保持稳定[23]。碳青霉烯类抗菌药物推荐用于治疗ESBL(+)大肠埃希菌引起的严重感染[24]。值得庆幸的是,历年的BRICS监测数据表明,CREC的分离率处于低水平状态[17]。CREC对头孢他啶/阿维巴坦的耐药率为22.8%,较上一年度有所下降[23],考虑部分CREC菌株可能是由于产碳青霉烯类酶所致。因此,上述监测数据表明,大肠埃希菌对碳青霉烯类抗菌药物的耐药机制可能发生变化[25],需要进一步进行监测。在本年度监测中,CRKP的分离率与上一年度相似,自2018年达到22.4%后呈下降趋势[17,23]。CHINET的2021年细菌耐药监测结果同样显示,分离自所有临床样本的肺炎克雷伯菌在2019至2021年间对碳青霉烯类的耐药率呈下降趋势[26]。对CRKP上升趋势的遏制,一方面说明通过监测和研究加强对CRKP的认识,同时微生物实验室也通过规范药敏试验报告,提高细菌检测数据的使用价值,有效提升临床合理选择抗菌药物进行治疗[27]。根据全国耐药细菌监测网(CARSS)的监测,CRKP则呈上升态势(http://www.carss.cn),这种差异可能受不同监测方式的影响,本研究为基于血流感染的主动监测;同时不同医院微生物实验室的质量控制和技术能力亦存在差异,而本研究菌株均在传染病诊治国家重点实验室完成,以确保监测结果的准确。头孢他啶/阿维巴坦对CRKP依然具有较高的抗菌活性,因此合理使用该药物可减少或减缓耐药的发生发展。本研究和CARSS均发现[28],有少部分肺炎克雷伯菌对替加环素不敏感,有研究报道称其耐药机制与RND外排泵表达上调相关[29],需要进一步进行研究和监测。
尽管鲍曼不动杆菌在血流感染中所占比例不高,但由于泛耐药鲍曼不动杆菌(Extensively-drug resistant Acinetobacter baumannii,XDRAB)和全耐药(Pan-drug resistant Acinetobacter baumannii,PDRAB)在临床菌株中的分离,导致临床治疗困难及病死率增加[30];而在许多情况下,多黏菌素B和替加环素是仅有可用于治疗多重耐药鲍曼不动杆菌感染的抗菌药物[31]。在本次监测中,CRAB分离率仍然较高,除了多黏菌素B和替加环素对鲍曼不动杆菌具有较高的抗菌活性外,其他检测的抗菌药物耐药率均超过50.0%。相比之下,CRPA的分离率较前一年度略有下降,但仍然接近20%。头孢他啶、氨基糖苷类和氟喹诺酮类抗菌药物对铜绿假单胞菌具有较好的抗菌活性。
在本次监测中,增加了头孢比罗和氨曲南/阿维巴坦的体外敏感试验。头孢比罗是一种第五代头孢菌素,在体外对葡萄球菌以及ESBLs(-)革兰阴性菌具有较强的抗菌活性[32]。据EUCAST折点标准,头孢比罗无论是MRSA或是MSSA均有很好的抗菌活性,其结果与欧美国家及中国的其他研究类似[33,34]。有报道称,由于头孢比罗不能与屎肠球菌低亲和力PBP5蛋白结合,导致其对屎肠球菌抑制活性较差[35],但头孢比罗对粪肠球菌的MIC50/90明显低于其对屎肠球菌的MIC50/90。除了对金黄色葡萄球菌和粪肠球菌外,头孢比罗对ESBLs(-)肠杆菌科细菌,其体外抗菌效果与头孢他啶、头孢曲松、头孢哌酮/舒巴坦、亚胺培南、阿米卡星、多黏菌素B和替加环素等相似;但对于ESBLs(+)肠杆菌科细菌,头孢比罗则没有优势。这与国内外其他报道相似[33,34]。头孢比罗对鲍曼不动杆菌的MIC50/90分别为32/64 mg/L,对铜绿假单胞菌MIC50/90分别为2/16 mg/L,与头孢他定、头孢比肟相似[36]。氨曲南/阿维巴坦复合制剂是利用氨曲南对金属β-内酰胺酶稳定,而阿维巴坦对非金属β-内酰胺酶抑制作用特点,以解决现有的主要产β-内酰胺酶的耐药问题。因此,氨曲南/阿维巴坦是有效针对产碳青霉烯酶及AmpC型β-内酰胺酶革兰阴性菌感染的选择之一[37]。与头孢他啶/阿维巴坦对CREC的MIC50/90相比,氨曲南/阿维巴坦的MIC50/90较低。
综上所述,在本年度监测中,引起血流感染的病原菌以革兰阴性菌为主,呈逐年上升的趋势,且大肠埃希菌增加明显;MRSA较前监测则呈下降态势,而CRE仍在较低水平。CRKP上升的趋势得到遏制,但仍需进一步监测。鲍曼不动杆菌中多重耐药菌分离率高,仅对多黏菌素B和替加环素有较高的敏感率。CRPA的分离率较前一年度监测略有下降,但仍然接近20%。
陈云波,嵇金如,刘志盈,等.全国血流感染细菌耐药监测(BRICS)2021年度报告[J].中华临床感染病杂志,2023,16(1):33-47.DOI:10.3760/cma.j.issn.1674-2397.2023.01.005.
所有作者均声明不存在利益冲突



























