
探讨继发型回状颅皮的临床特征,提高临床诊治水平。
对1例罕见继发型回状颅皮—脑回状真皮内痣并神经纤维瘤进行报道,并结合有关文献报道资料进行分析总结。
本例患儿4岁,自出生即被发现头部肿物,逐渐增大且呈多层折叠及凹陷,在郑州大学第一附属医院行病变组织分次切除术,术后病理示:(头皮肿物)符合神经纤维瘤,伴皮内痣。
结合本病例及文献分析,手术切除和利用整形技术修复是继发型回状颅皮首选的治疗方案。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
回状颅皮(CVG)临床特征类似于大脑表面的脊和沟[1],通常好发于头皮的枕部和顶部,可位于头皮的任意一侧,通常分界清楚[2]。文献中报道引起CVG的病因分为原发型和继发型两类[1,3],原发型CVG发病通常与精神缺陷、脑瘫、癫痫、癫痫发作或眼科疾病有关[4];继发型CVG的发病是由潜在的条件引起的,如脑回状颅皮内痣、淀粉样变性、梅毒、肢端肥大症、黏液性水肿、神经纤维瘤等[5]。本研究旨在探讨继发型CVG的临床特征。
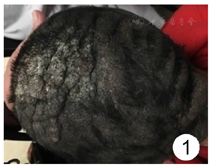
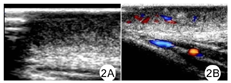
患儿,女,4岁,患儿出生时家长即发现其左侧头部约"核桃"大小黑褐色肿物,不明显突出于皮肤,表面颗粒状不光滑,随时间推移,肿物逐渐增大且呈多层折叠及凹陷,自发病以来,无头疼及头晕等神经症状。既往体健,患儿系第1胎第1产,足月顺产,无产伤窒息史,人工喂养。身高、体质量、智力发育与同龄儿相符。家族中无与患儿类似疾病者,无家族性遗传病史。实验室检查:血、尿常规及肝功能、肾功能、胸片、心电图均正常。专科检查:左侧头部大片黑褐色肿物,边界较清晰,如沟回状,折叠达10层,每层厚度为1.0~2.5 cm,枕部最大27 cm×15 cm,最小10 cm×8 cm,质韧,活动度小,回状区域脊部及沟中有稀疏的束状头发。见图1。行头部彩色多普勒超声示:左侧头部肿物探查,皮肤增厚并呈弥漫性回声改变。见图2。行头颅磁共振检查示:左侧额顶颞枕部皮下软组织异常信号,需结合临床及相关检查;脑实质磁共振成像(MRI)检查未见明显异常;双侧筛窦、左侧上颌窦炎。


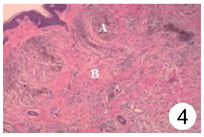
针对本例患儿,考虑患儿头部肿物面积较大,超过一半头皮面积,若行植皮术,则供皮区难以选择,且患儿年幼,不能配合扩张器植入术术后护理,故拟实施头部肿物分次切除术。完善相关检查,排除手术禁忌后于全身麻醉下行头部肿物部分切除术,将切除肿物送常规病理检查,结果回示,头皮肿物符合神经纤维瘤,伴皮内痣形成。见图3、图4。免疫组化:EMA(-),S-100(+),SOX-10(+),CD34(-),SMA(-),Ki-67(约1%+),Melan-A(部分+),HMB45(-),β-Catenin(-)。



患儿术区切口愈合良好,于术后第13天拆线出院。出院后半年对其进行电话随访,患者家属诉患儿恢复好,效果满意,但因经济原因暂未行二次手术治疗。
脑回状真皮内痣(CIN)也称为假性或继发型CVG,是一种罕见的疾病,通常出现在出生时或生命早期[6,7]。CIN是继发型CVG的少见病因,CIN通常是先天性的,但也可以是后天性的,常在出生时或生命早期表现为扩大的皮肤色素沉着或轻微色素沉着的不对称且无症状的病变,如小斑点、乳头瘤样结节、小隆起性肿块或斑秃,病变常在5~10岁时迅速变大[8]。CIN好发于在头皮的顶叶和枕叶区域,额叶和颞叶区域较少见[8],也有文献报道发生在颈部、臀部、阴囊、腹部和背部的病例[2]。CIN患者通常智力正常,女性群体发病率较高[8]。神经纤维瘤是神经来源的良性肿瘤,但部分肿瘤侵犯周围组织,神经纤维瘤可以独立存在,也可以作为Ⅰ型神经纤维瘤的一部分,同时头颈部神经纤维瘤多见[9],Ⅱ型以多发性颅内、脊髓及全身神经纤维瘤为主要表现。其中以Ⅰ型神经纤维瘤最为常见,约占神经纤维瘤病的90%。神经纤维瘤为常染色体显性遗传,其发病机制为Ⅰ型神经纤维瘤病肿瘤抑制基因的常染色体显性突变导致神经纤维蛋白功能受损,神经纤维蛋白是一种参与细胞增殖、分化和迁移的Ras-GTP途径失活的蛋白,最终导致雪旺氏细胞过度生长[10]。有研究认为,CVG通常与潜在的神经纤维瘤有关,有文献报道了1例34岁诊断为CVG的患者,自出生即有头皮孤立性神经纤维瘤存在,稍有疼痛[11]。
本研究病例中,结合患儿临床表现同时根据术后常规病理结果提示,CVG的发生是由于CIN和神经纤维瘤两者共同作用的结果,这在之前的病例中并未报道。CVG存在发展为恶性黑色素瘤的可能,是最严重的并发症,CIN中恶性黑色素瘤的发病率预测为4%~10%[12],因为文献中报道的病例很少,实际发病率仍然未知[5]。考虑到CVG临床表现影响美观及对患者心理方面的影响,以及发展为恶性黑色素瘤的可能性,因此手术切除和利用整形技术修复是首选的治疗方案,由于其存在恶变的可能性,在无法完全切除病灶的情况下,患者必须密切随访[5]。



























