
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
自从2005年国际上第一个肠促胰素类药上市以来,此类药物的研究和临床应用有了飞速的发展。目前在我国已经上市2种胰高血糖素样肽1(GLP-1)受体激动剂和5种二肽基肽酶Ⅳ(DPP-4)抑制剂,为了便于使用者全面和快速地了解此类药物的基本知识以及在我国的临床研究和应用情况,中华医学会糖尿病学分会达成以下共识。
胃肠道是机体重要的内分泌器官,肠道内分泌细胞在代谢调节中的作用日益受到重视。二十世纪初期,人们发现营养物质摄入后,从肠道分泌的某种激素可以刺激胰岛素分泌从而产生降低血糖的作用[1]。1929年,中国学者冯德培、侯祥川、林可胜教授在国际上率先发现并命名了肠抑胃素(enterogastrone)[2]。同年,Zunz和LaBarre教授[3]发现在狗身上应用这种物质后可引发低血糖,进而将该物质命名为"肠促胰素"(incretin)。1969年,Unger和Eisentraut等[4,5]首先以"肠-胰岛轴"来描述肠道与胰岛之间的关联,提示这样一个系统能够整合从肠道到胰岛细胞之间的营养、神经和激素信号,从而调控胰岛素、胰高糖素、生长抑素或胰多肽的分泌。营养物质尤其是碳水化合物可刺激这类激素的释放,当血糖升高时刺激胰岛素释放。
Elrick等[6]发现,在血糖变化水平相同的情况下,与静脉注射葡萄糖相比,口服葡萄糖可引起更多的胰岛素分泌,这种现象被称为"肠促胰素效应"。人体内主要有两种肠促胰素:葡萄糖依赖性胰岛素释放肽(GIP)和GLP-1。GIP早在1930年被发现,是第一个被发现的肠促胰素,它是从猪小肠提取物中分离出来的物质,由于其具有抑制胃酸和胃蛋白酶分泌的作用,早期被命名为抑胃肽[7,8]。但在1973年,Pederson等[9,10,11]学者发现它在狗、大鼠乃至人体内呈现出葡萄糖依赖性刺激胰岛素释放的特性,即被更名为葡萄糖依赖性胰岛素释放肽。1986至1987年间,Drucker等[12]和Orskov等[13]分别在对哺乳动物胰高糖素原基因的克隆和序列测定过程中,发现第二个可以刺激胰岛素释放的肠促胰素,即GLP-1。
肠促胰素引起的胰岛素分泌能力约占全部胰岛素分泌量的50%~70%[14],而且肠促胰素刺激胰岛素分泌的作用具有葡萄糖浓度依赖的特点,故在调节血糖的同时,引起低血糖的风险很低。GIP是人17号常染色体长臂基因编码的具有42个氨基酸的肽类物质,在碳水化合物和脂类刺激下,主要由十二指肠和空肠近端的K细胞分泌[15,16]。GIP与胰腺β细胞上的特异性受体结合,促进胰岛素分泌。但2型糖尿病患者的循环GIP水平正常或升高,同时GIP对β细胞的促胰岛素分泌作用显著降低,对α细胞也没有作用,因而限制了其临床应用[14]。GLP-1是人2号常染色体长臂的胰高血糖素原基因编码,而后经修饰的具有30个氨基酸的肠肽类激素,在食物的刺激下由回肠和结肠的L细胞分泌释放入血,从而发挥葡萄糖依赖性促进胰岛素的合成和分泌、抑制β细胞凋亡、抑制胰高糖素分泌等生理作用[12,13,17,18,19,20,21,22]。1993年,在Nauck等[23]发表的文章中,提示对磺脲类药物不能有效控制的2型糖尿病患者,持续静脉输注GLP-1后,能够显著降低血糖;当血糖达到正常水平时,持续输注GLP-1并未继续刺激胰岛素分泌、血糖呈稳定状态,进一步表明了GLP-1的葡萄糖浓度依赖性降糖的特征。此外,研究还发现肠促胰素,尤其是GLP-1可抑制胰腺α细胞分泌胰高糖素,并有减轻体重、改善β细胞功能和在动物模型中增加β细胞量的作用,可对2型糖尿病患者的代谢异常进行多方面的调控[24]。
GLP-1通过与其广泛存在于器官上的特异受体相结合,从而发挥相应的作用。目前明确存在GLP-1受体的器官包括胰岛细胞、胃肠、肺、脑、肾脏、下丘脑、心血管系统等。另外,肝脏、脂肪组织和骨骼肌也可能存在GLP-1受体[25,26,27,28,29,30,31,32,33,34,35,36,37,38,39]。
不像其他胰岛素促泌剂通过KATP通道释放胰岛素,GLP-1还通过刺激胰岛素前体基因表达而合成胰岛素。这个效应主要是通过GLP-1与β细胞的GLP-1受体结合后激活了cAMP依赖的PKA信号通路[40,41]。另外,GLP-1也可以通过抑制胰岛α细胞释放胰高糖素而降低血糖[42,43,44]。这个机制尚不明确,可能是通过存在于α细胞上的GLP-1受体直接作用或间接通过刺激分泌的胰岛素[45]和生长抑素的旁路效应[46,47]。在临床前研究中发现,GLP-1对胰腺的作用还包括保护β细胞、增加β细胞量(可能是通过促进β细胞分化、增殖、抑制细胞凋亡通路)[48,49,50]。
GLP-1除了对胰腺作用外,还通过与存在于其他脏器上的特异受体结合发挥胰腺外作用,其胰腺外作用可能涵盖多个方面:
1.作用于胃肠道,延缓胃排空和肠道蠕动的作用,并可以抑制胃酸和五肽胃泌素分泌,从而减少餐后血糖波动和减轻体重[51]。
2.作用于中枢神经系统,发挥抑制食欲、增加饱腹感等作用,从而达到减少摄食的目的[52,53,54]。
3.作用于心血管系统,降低收缩压、改善心肌缺血和心肌收缩功能[55,56,57,58,59]。
4.作用于肝、肾,抑制肝脏葡萄糖生成、降低肝酶、降低血脂、改善肝功能[60,61,62]。
5.增加肥胖者的钠排泄、减少H+分泌、降低肾小球高滤过,从而对肾脏可能起到保护作用[63]。
目前有两大类药物:分别为GLP-1受体激动剂和DPP-4抑制剂。
GLP-1受体激动剂通过模拟天然GLP-1激活GLP-1受体而发挥作用,且不容易被DPP-4快速降解,延长了半衰期,增加了活性GLP-1在体内的浓度。GLP-1受体激动剂主要通过外源性补充GLP-1以使体内的GLP-1水平达到药理浓度而发挥作用,其降糖效果显著,降低HbA1c幅度约0.8%~1.5%。目前,在中国上市的GLP-1受体激动剂有两种:一种是短效GLP-1受体激动剂艾塞那肽(exenatide,商品名百泌达),是两栖动物美洲毒蜥唾液中多肽exendin-4的人工合成多肽,其与人GLP-1的同源性为53%[64];另一种是长效人GLP-1类似物利拉鲁肽(liraglutide,商品名诺和力),通过对人GLP-1分子结构局部修饰加工而成,与GLP-1的同源性为97%[65]。
另外,根据降糖作用时间长短,可以把GPL-1受体激动剂分为短效和长效制剂,短效制剂对延迟胃排空作用较强,餐后血糖降低明显,长效制剂对延迟胃排空作用较弱,但通过刺激胰岛素分泌和抑制胰高糖素分泌,对空腹血糖降低明显。短效制剂有艾塞那肽,每天注射两次;利司那肽(lixisenatide),每天一次。长效制剂有利拉鲁肽,每天一次;艾塞那肽周制剂,每周一次;阿必鲁肽(albiglutide),每周一次;dulaglutide,每周一次。
DPP-4抑制剂通过阻止DPP-4酶降解体内GLP-1,使得GLP-1在生理浓度范围内有一定程度的升高,其降低HbA1c幅度约为0.4%~1.0%[66,67,68,69,70]。目前在中国已上市的DPP-4抑制剂药物有西格列汀(sitagliptin,商品名捷诺维)、沙格列汀(saxagliptin,商品名安立泽)、维格列汀(vildagliptin,商品名佳维乐)、利格列汀(linagliptin,商品名欧唐宁)和阿格列汀(alogliptin,商品名尼欣那)。
GLP-1受体激动剂不但具有显著的降糖效果,还同时兼有低血糖发生率低的优点。另外具有降低体重、收缩压,改善血脂紊乱的作用。
目前国内上市的GLP-1受体激动剂为艾塞那肽和利拉鲁肽,均需皮下注射。包括我国2型糖尿病患者在内的临床试验显示艾塞那肽可以使HbA1c降低0.8%,利拉鲁肽的疗效和格列美脲相当。
GLP-1受体激动剂适用于成人2型糖尿病患者。艾塞那肽是在国内最早上市的GLP-1受体激动剂,用于改善2型糖尿病患者的血糖控制,适用于单用二甲双胍、磺脲类,以及二甲双胍合用磺脲类,而血糖仍控制不佳的患者(表1)。在国外,艾塞那肽还可与噻唑烷二酮类、二甲双胍合用磺脲类、二甲双胍合用噻唑烷二酮类、以及基础胰岛素联合使用等。

胰高血糖素样肽(GLP)-1受体激动剂和二肽基肽酶(DPP)-4抑制剂国内批准的适应证
胰高血糖素样肽(GLP)-1受体激动剂和二肽基肽酶(DPP)-4抑制剂国内批准的适应证
| 药物 | 生活方式治疗血糖控制不佳时 | 二甲双胍单药治疗血糖控制不佳时 | 磺脲类单药治疗血糖控制不佳时 | 二甲双胍与磺脲类联合治疗血糖控制不佳时 |
|---|---|---|---|---|
| 艾塞那肽 | √ | √ | √ | |
| 利拉鲁肽 | √ | √ | ||
| 西格列汀 | √ | √ | ||
| 维格列汀 | √ | |||
| 沙格列汀 | √ | √ | ||
| 利格列汀 | √ | |||
| 阿格列汀 | √ | √ |
注:√表示有适应证;空白表示未提及
利拉鲁肽在国内适用于单用二甲双胍或磺脲类药物最大可耐受剂量治疗后血糖仍控制不佳的患者,与二甲双胍或磺脲类药物联合应用(表1)。在国外,利拉鲁肽在此应用基础上还有单药使用,与二甲双胍合用磺脲类或与二甲双胍合用噻唑烷二酮类或与胰岛素联合应用的适应证等。
GLP-1受体激动剂的主要不良反应为恶心、呕吐、腹泻、消化不良、食欲下降、低血糖等。罕见的不良反应包括胰腺炎、皮疹等。详细信息请参考各种GLP-1受体激动剂的说明书。
①GLP-1受体激动剂不能替代胰岛素,不适用于1型糖尿病患者或糖尿病酮症酸中毒的治疗。
②严重胃肠道疾病患者、妊娠期和哺乳期妇女以及儿童不推荐使用。
③艾塞那肽和利拉鲁肽使用中有少数急性胰腺炎病例报道,应当告知患者急性胰腺炎的特征性症状。如果怀疑发生了胰腺炎,应该立即停用。
④GLP-1受体激动剂在与磺脲类药物合用时低血糖发生率升高,适当减少磺脲类药物的剂量可减少低血糖风险。在联合使用GLP-1受体激动剂与磺脲类药物时,应告知患者在驾驶或操作机械时采取必要措施防止发生低血糖。
⑤艾塞那肽有罕见肾功能改变报告,不推荐艾塞那肽用于终末期肾病或严重肾功能不全(肌酐清除率<30 ml/min)的患者;利拉鲁肽由于经验有限,不推荐利拉鲁肽用于肾脏终末期患者。
⑥利拉鲁肽在纽约心脏病学会(NYHA)分级Ⅰ-Ⅱ级的充血性心力衰竭的患者中的治疗经验有限,尚无在Ⅲ-Ⅳ级充血性心力衰竭患者中的应用经验。
⑦利拉鲁肽不得用于有甲状腺髓样癌(MTC)既往史或家族史患者以及2型多发性内分泌肿瘤综合征患者(MEN2)。
GLP-1受体激动剂禁用于对该类产品活性成分或任何其他辅料过敏者。
DPP-4抑制剂可抑制DPP-4活性,有效减少GLP-1的失活,在生理范围内增加有活性的GLP-1水平,以葡萄糖浓度依赖的方式促进胰岛素释放,并降低胰高糖素水平,发挥降低糖化血红蛋白(HbA1c)、空腹血糖及餐后血糖的作用。最近临床试验的研究结果证实了阿格列汀和沙格列汀对心血管疾病(CVD)的长期良好安全性[71,72]。
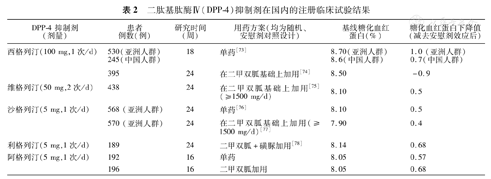
二肽基肽酶Ⅳ(DPP-4)抑制剂在国内的注册临床试验结果
二肽基肽酶Ⅳ(DPP-4)抑制剂在国内的注册临床试验结果
| DPP-4抑制剂(剂量) | 患者例数(例) | 研究时间(周) | 用药方案(均为随机、安慰剂对照设计) | 基线糖化血红蛋白(%) | 糖化血红蛋白下降值(减去安慰剂效应后) |
|---|---|---|---|---|---|
| 西格列汀(100 mg,1次/d) | 530(亚洲人群)245(中国人群) | 18 | 单药[73] | 8.70(亚洲人群)8.6(中国人群) | 1.0 (亚洲人群)0.7(中国人群) |
| 395 | 24 | 在二甲双胍基础上加用[74] | 8.50 | -0.9 | |
| 维格列汀(50 mg,2次/d) | 438 | 24 | 在二甲双胍基础上加用[75](≥1500 mg/d) | 8.10 | 0.5 |
| 沙格列汀(5 mg,1次/d) | 568 (亚洲人群) | 24 | 单药[76] | 8.10 | 0.5 |
| 570 (亚洲人群) | 24 | 在二甲双胍基础上加用(≥1500 mg/d)[77] | 7.90 | 0.4 | |
| 利格列汀(5 mg,1次/d) | 189 | 24 | 二甲双胍+磺脲加用[78] | 8.14 | 0.68 |
| 阿格列汀(5 mg,1次/d) | 192 | 16 | 单药 | 8.05 | 0.57 |
| 196 | 16 | 二甲双胍加用 | 8.05 | 0.68 |
DPP-4抑制剂国内注册研究的主要疗效见表1。此外,在以二甲双胍为基础治疗,再加用DPP-4抑制剂与其他多种降糖药物,包括磺脲类、噻唑烷二酮类的许多对比研究中,显示DPP-4抑制剂在降低HbA1c方面,与对照药的疗效相当。在中国2型糖尿病人群的对比研究中维格列汀与阿卡波糖降低HbA1c的作用相似。需要注意的是DPP-4抑制剂降低HbA1c程度与基线HbA1c水平有一定的关系,即基线HbA1c水平高的降低幅度明显。
DPP-4抑制剂适用于成人2型糖尿病患者的血糖控制。目前国内批准该类药物的适应证为:西格列汀可配合饮食控制与运动,进行单药或与二甲双胍联合使用治疗改善血糖控制;沙格列汀和阿格列汀可在饮食和运动基础上单药治疗,亦可在单独使用二甲双胍血糖控制不佳时与二甲双胍联合使用;维格列汀在二甲双胍作为单药治疗用至最大耐受剂量仍不能有效控制血糖时,与二甲双胍联合使用;利格列汀可配合饮食控制和运动,与二甲双胍和磺脲类药物联合使用改善血糖控制(表2)。
DPP-4抑制剂的主要不良反应有鼻咽炎,头痛、上呼吸道感染、低血糖等,低血糖的发生率比磺脲类低。其他一些很少见的不良反应有超敏反应、血管神经性水肿、肝酶升高、腹泻、咳嗽、淋巴细胞绝对计数降低等。最近完成的临床研究结果显示,沙格列汀可明显增加心力衰竭住院的风险,但不增加相关的死亡率。详细信息请参考各种DPP-4抑制剂的说明书。
①DPP-4抑制剂不能用于1型糖尿病或糖尿病酮症酸中毒的患者;不推荐用于妊娠期、哺乳期妇女以及儿童。
②DPP-4抑制剂在肾功能不全患者中的应用:
a.西格列汀通过肾脏代谢,用于中、重度肾功能不全及需要透析的终末期肾病的患者时需要根据肌酐清除率调整剂量。
b.维格列汀均在中度或重度肾功能不全患者或需要接受血液透析治疗的终末期肾脏疾病(ESRD)患者中的应用经验有限,因此不推荐此类患者使用。
c.沙格列汀在轻度肾功能不全的患者中无需调整剂量。中重度肾功能不全的患者应将剂量调整为2.5 mg,每日1次。在重度肾功能不全的患者中临床研究经验有限,因此不推荐使用。
d.利格列汀极少经过肾脏排泄,在不同程度肾功能不全的患者中使用,均不需要调整剂量。
e.阿格列汀在中度肾功能受损患者中使用剂量为推荐剂量减半,重度肾功能受损或终末期肾功能衰竭患者中使用剂量为推荐量的四分之一。推荐在开始使用阿格列汀前评估肾功能并定期复查。
③DPP-4抑制剂在肝功能不全患者中的应用
a.西格列汀用于轻度或中度肝功能不全的患者,不需要进行剂量调整;尚无严重肝功能不全患者使用的临床经验。
b.维格列汀不推荐用于开始给药前血清谷丙转氨酶或谷草转氨酶大于正常上限3倍的患者;罕见有肝功能障碍(包括肝炎)报告,需要进行定期检测肝酶;对于用药中发生肝酶异常者,在肝功能检测恢复正常后,不建议重新使用。
c.沙格列汀用于中度肝功能不全的患者时需谨慎,不推荐用于重度肝功能不全的患者。
d. 利格列汀在不同程度肝功能不全的患者中使用,均不需要调整剂量。
e. 阿格列汀在肝功能检查结果异常的患者中应慎重使用。如果患者报告发生可能提示肝损伤的症状,迅速进行肝功能检查。如果患者出现具有临床意义的肝酶升高,和肝功能检查异常结果持续或恶化,应停用阿格列汀。如果未发现引起肝功能检查异常的其他原因,不要在此类患者中再次使用阿格列汀。
④超敏反应
a.西格列汀在上市后发现有严重超敏反应,包括过敏反应、血管性水肿和剥脱性皮肤损害,包括Stevens-Johnson综合征。如怀疑发生超敏反应,应停止使用。
b.维格列汀和沙格列汀在对猴子进行的毒理学研究中,出现四肢皮肤的损伤报告,尽管未在临床中观察到皮肤损伤的发生率升高,但在合并有糖尿病皮肤并发症的患者中经验有限。建议观察皮肤病变,如水疱、皮疹或溃疡等情况。
c.阿格列汀在上市后发现严重皮肤不良反应,如怀疑发生严重过敏反应,停用阿格列汀。
d.沙格列汀和阿格列汀上市后有报告严重超敏反应(包括速发过敏反应和血管性水肿)。如果疑有沙格列汀严重超敏反应,则停止使用,评估是否还存在其他可能的原因,并改用别的方案治疗糖尿病。
e.利格列汀治疗的临床研究中报告的其他不良反应有高敏反应(例如荨麻疹、血管性水肿、局部皮肤剥脱或支气管高敏反应)。
⑤沙格列汀及维格列汀含有乳糖,罕见的半乳糖不耐受遗传疾病、Lapp乳糖酶缺乏症或葡萄糖-半乳糖吸收不良患者不得服用。
⑥维格列汀和沙格列汀在纽约心功能分级(NYHA)为Ⅰ-Ⅱ级的充血性心力衰竭的患者中经验有限,此类患者中慎用;尚未在Ⅲ-Ⅳ级充血性心力衰竭的患者中进行临床试验,不推荐在此类患者中使用。
⑦药物相互作用:西格列汀在与磺脲类药物合用时低血糖风险增加,需适当减少磺脲类药物的剂量。利格列汀在与胰岛素、磺脲类合用时低血糖风险增加,需适当减少胰岛素和磺脲类药物的剂量。沙格列汀的代谢主要由CYP3A4/5介导。沙格列汀的主要代谢产物也是DPP-4抑制剂,其抑制活性作用是沙格列汀的二分之一。因此,CYP3A4/5强抑制剂和强诱导剂能改变沙格列汀及其代谢物的药代动力学。与强效CYP3A4/5抑制剂(如酮康唑、阿扎那韦、克拉霉素、茚地那韦、伊曲康唑、奈法唑酮、奈非那韦、利托那韦、沙奎那韦和泰利霉素)合用时,应将沙格列汀的剂量限制为2.5 mg/d。
基于GLP-1类降糖药物的应用是2型糖尿病治疗中的一个重要发展,其药物作用的特点弥补了传统降糖药物治疗中的一些不足之处。多项研究结果显示GLP-1受体激动剂具有葡萄糖浓度依赖性降低血糖作用的特点,低血糖发生率低,还可减轻体重、降低收缩压、减少心血管疾病危险因素。目前GLP-1受体激动剂艾塞那肽和利拉鲁肽在国内均被批准可在一种口服药(二甲双胍或磺脲类)治疗失效后开始使用,艾塞那肽还可在二甲双胍与磺脲类联合治疗失效后开始使用。这为我国2型糖尿病患者降糖治疗提供了一种新的选择。
DPP-4抑制剂均为口服制剂,使用方便,也具有葡萄糖浓度依赖性降低血糖作用,低血糖发生率低,对体重的影响小,已有报告阿格列汀和沙格列汀对CVD的长期安全性良好,胃肠道不良反应少。目前DPP-4抑制剂在国内被批准用于单药或与二甲双胍或与磺脲类联合治疗。综上所述,作为新一类2型糖尿病的治疗药物,基于GLP-1的降糖药物为临床控制糖尿病提供了新的治疗手段。
执笔专家:陆菊明(解放军总医院内分泌科)
参与起草共识的专家(按姓名拼音排序):陈莉明(天津医科大学代谢病医院);郭晓蕙(北京大学第一医院内分泌科);姬秋和(第四军医大学附属西京医院内分泌科);纪立农(北京大学人民医院内分泌科);李焱(中山大学孙逸仙纪念医院内分泌科);粱瑜祯(广西医科大学第一附属医院内分泌科);刘建英(南昌大学第一附属医院内分泌科);冉兴无(四川大学华西医院内分泌科);石勇铨(第二军医大学附属长征医院内分泌科);时立新(贵阳医学院附属医院内分泌科);王颜刚(青岛大学医学院附属医院内分泌科);萧建中(中日友好医院内分泌科);许樟荣(解放军第三六医院内分泌科);杨立勇(福建医科大学附属第一医院内分泌科);姚孝礼(西安交通大学医学院第一附属医院内分泌科);周嘉强(浙江大学医学院附属邵逸夫医院内分泌科);周智广(中南大学湘雅二医院代谢内分泌研究所);邹大进(第二医科大学附属长海医院内分泌科);朱大龙(南京大学医学院附属鼓楼医院内分泌科);祝之明(第三军医大学大坪医院高血压内分泌科)

























