
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
近二十年来,我国超重/肥胖的患病率逐年增长,呈流行态势。中国健康营养调查(China Health and Nutrition Survey, CHNS)的数据显示[1],从1993年至2009年的17年间,成年人超重/肥胖的患病率从13.4%增加至26.4%,总体呈线性增长;成年人腹型肥胖的患病率从18.6%增长至37.4%,平均年增长1.1%,显著高于超重/肥胖的增长速度。肥胖是糖尿病、心血管疾病及其他代谢性疾病和肿瘤的潜在危险因素。减重治疗包括生活方式(膳食和体育运动)调整、内科药物及外科手术治疗等多种手段。科学合理的营养治疗联合运动干预仍是目前最有效、最安全的基础治疗。近年来,国际上对肥胖/超重的营养管理已经形成了一些共识[2,3]。然而,以营养和生活方式干预为核心的肥胖/超重管理必须与特定的地域性饮食习惯及社会文化相适应。为更好地发挥医学营养治疗在肥胖防治中的作用,结合国内外发表的诸多证据和专家的集体智慧,特制定本共识,以便使医学减重更加科学、规范和易于实施。
在制定本共识的过程中,首先参照世界卫生组织(World Health Organization, WHO)出版的《WHO指南编写手册》[4]和AGREE (Appraisal of Guideline Research and Evaluation)[5]协作网发表的临床指南编写的方法学原则(表1),结合中国现况,建立制定本共识的方法学,将2009年更新后的AGREEⅡ协作网推出的指南方法学质量评价标准作为质控标准[5]。2015年9月,成立了超重/肥胖医学营养治疗专家共识(2016)(以下简称"共识" )撰写证据方法学小组,负责起草方法学工作方案,并协助编委会进行证据评价的相关工作。证据级别与推荐意见分级标准的制定见表2。

证据检索——数据库和关键词
证据检索——数据库和关键词
| 检索时限 | 2000年1月1日至2015年9月1日 |
| 语言 | 英语、汉语 |
| 数据库 | 二级文献数据库:Guideline Clearing House、Cochrane Library、 SumSearch 一级文献数据库:Medline、EMBASE、SCI、中国生物医学文献数据库 |
| 筛选项目 | 人类 |
| 文献出版类型 | 有效性:指南、Meta分析、系统性综述、随机对照试验、观察研究、病例报告、共识意见安全性:指南、Meta分析、系统性综述、随机对照试验、不良反应报告、共识意见 |
| 主要检索词 | medical nutrition therapy、weight loss、weight management、obesity、营养治疗、减重、体重管理、减肥、肥胖等检索词 |

共识证据分级和推荐意见整合体系
共识证据分级和推荐意见整合体系
| 推荐意见 | 证据级别 | 描述 |
|---|---|---|
| A | 1 | 单个多中心RCT研究(原始数据开源);基于RCTs的系统性综述(有同质性,原始数据开源);大样本数据挖掘研究(原始数据开源);Meta分析和系统性综述 |
| B | 2a | 单个RCT(原始数据不开源);经典的基于病例对照研究的系统性综述(有同质性);大样本队列研究(原始数据开源) |
| 2b | 单个病例对照研究 | |
| C | 3 | 病例报道(低质量队列研究);横断面研究 |
| D | 4 | 专家意见或评论 |
注:RCT:随机对照试验;A、B、C、D:推荐意见优先级别从高到低
由中国医疗保健国际交流促进会营养与代谢管理分会以及中国医师协会营养医师专业委员会、中国营养学会的67位专家组成了本共识编写委员会。所有参与指南编写的人员均基于志愿工作。
通过"共识"的撰写与发布,期望能提高社会及专业人士对营养干预在代谢性疾病治疗中的重要性认识。并能进一步规范医学营养减重的原则和路径,设立标准化医学营养治疗减重管理工作流程,以便临床营养专业人员及医疗保健人员掌握和使用,更好地为减重者服务。
结合身高和体重用于判断人体超重/肥胖与否和程度的指数,计算公式为体重/身高2(kg/m2)。目前我国成人BMI的切点为:18.5≤BMI<24 kg/m2为正常体重范围,24≤BMI<28 kg/m2为超重,BMI≥28 kg/m2为肥胖。
由于体内脂肪的体积和(或)脂肪细胞数量的增加导致的体重增加,或体脂占体重的百分比异常增高,并在某些局部过多沉积脂肪,通常用BMI进行判定。在本共识中,肥胖的主要定义即基于BMI做出,在一些情况下(如代谢综合征),也酌情采纳权威国际学术组织(如WHO、美国糖尿病学会等)推荐的相关诊断指标(如腰围,腰臀比)。
介于正常和肥胖间的身体状态。通常以24≤BMI<28 kg/m2作为判断标准。
WHO推荐以身高标准体重法对儿童肥胖进行判定,同等身高、营养良好的儿童体重为标准体重(100%),±10%标准体重的范围为正常。>15%为超重,>20%为轻度肥胖,>30%为中度肥胖,>50%为重度肥胖。
一类在限制能量摄入的同时保证基本营养需求的膳食模式,其宏量营养素的供能比例应符合平衡膳食的要求。
一类在满足蛋白质、维生素、矿物质、膳食纤维和水这五大营养素的基础上,适量减少脂肪和碳水化合物的摄取,将正常自由进食的能量减去30%~50%的膳食模式。通常需要在医生监督下进行。
通常指每日只摄入400~800 kcal (1 kcal=4.2 kJ)能量,主要来自于蛋白质,而脂肪和碳水化合物的摄入受到严格限制。机体处于饥饿状态,因其能引起瘦体重减少、痛风发生风险增加以及电解质平衡紊乱等不良反应并不作推荐。该方法必须在医生严格指导下进行,预防并发症的发生。
高蛋白质膳食是一类每日蛋白质摄入量超过每日总能量的20%或1.5 g·kg-1·d-1,但一般不超过每日总能量的30%(或2.0 g·kg-1·d-1)的膳食模式。
也称间歇式断食,一类采用5+2模式,即1周中5天相对正常进食,其他2天(非连续)则摄取平常的1/4能量(约女性500 kcal/d,男性600 kcal/d)的膳食模式。
进食恒量的食物(含50 g碳水化合物)后,2~3 h内的血糖曲线下面积相比空腹时的增幅除以进食50 g葡萄糖后的相应增幅。通常定义GI≤55%为低GI食物,55%~ 70%为中GI食物,GI≥70%为高GI食物。
众所周知,肥胖的发生常常是由遗传、少动以及摄入过多能量共同导致的结果。从代谢研究角度看则是基于代谢紊乱(metabolic disorders),代谢紊乱是肥胖从基因到临床表现的中心环节。肥胖者多存在脂类代谢紊乱,脂肪合成过多,而脂肪水解和脂肪分解氧化无明显异常。血浆甘油三酯、游离脂肪酸和胆固醇一般高于正常水平。应用低能量饮食治疗肥胖症时,血浆酮体增加或酮血症倾向往往低于正常人。随着基因组学研究的快速进展,人们发现在基因多态性上的差异,使得在各年龄层次的人群都有对肥胖更易感者。在上述背景下,加之膳食结构变化后肠道菌群结构发生的适应性变化[6,7],使得这类具有遗传易感性者对三大宏量营养素(碳水化合物、蛋白质、脂肪)的应答出现显著差异,进而造成肥胖的发生。
CRD对于延长寿命、延迟衰老相关疾病的发生具有明确干预作用[8]。CRD目前主要有三种类型[9]:(1)在目标摄入量基础上按一定比例递减(减少30%~50%);(2)在目标摄入量基础上每日减少500 kcal左右;(3)每日供能1 000~ 1 500 kcal。
Huffman等[10]对超重者进行了6个月CRD干预(能量摄入减少25%),发现与非CRD相比,CRD组的胰岛素敏感性有明显改善,并认为这是降低体重的原因。Yoshimura等[11]对内脏脂肪面积≥100 cm2的成人进行12周CRD (CRD目标:25 kcal/kg,基线能量摄入约为30 kcal/kg)干预后,有效降低了体重、脂肪组织重量、内脏脂肪面积以及动脉粥样硬化的发生风险。
多项研究证实CRD的脂肪供能比例应与正常膳食(20%~30%)一致[12,13],过低或过高都会导致膳食模式的不平衡。在CRD中补充海鱼或鱼油制剂的研究均报道n-3多不饱和脂肪酸(polyunsaturated fatty acids,n-3PUFA)对肥胖者动脉弹性、收缩压、心率、血甘油三酯及炎症指标等均有明显改善,可增强CRD的减重效果[14,15]。
由于CRD降低了摄入的总能量,必然导致产热的宏量营养素摄入降低,应适当提高蛋白质供给量比例(1.2~1.5 g/kg,或15%~20%),这样就能在减重过程中维持氮平衡,同时具有降低心血管疾病风险、增加骨矿物质含量等作用[16,17,18]。不同来源蛋白质的减重效果可能不同,有研究发现大豆蛋白的减脂作用优于酪蛋白,且其降低血液中总胆固醇和低密度脂蛋白胆固醇的作用也更明显[19]。
根据蛋白质、脂肪的摄入量来确定碳水化合物的供给量(40%~55%)[20]。过高或过低都将导致膳食模式不平衡。碳水化合物的来源应参照《中国居民膳食指南》,以淀粉类复杂碳水化合物为主,保证膳食纤维的摄入量25~30 g/d。严格限制简单糖(单糖、双糖)食物或饮料的摄入。
肥胖与某些微量营养素的代谢异常相关,尤其是钙、铁、锌、维生素A、维生素D及叶酸的缺乏[20]。肥胖和膳食减重也可引起骨量丢失[18,21]。一项Meta分析显示肥胖群体患维生素D缺乏的风险比正常人群高35%,比超重人群高24%[22]。在减重干预的同时补充维生素D和钙可以增强减重效果[23,24]。
CRD除能量摄入限制之外,也对营养均衡提出推荐。近年研究认为采用营养代餐方法能兼顾体重减轻和营养均衡。Wadden等[25]对Look AHEAD研究(纳入5 145例肥胖合并糖尿病的患者)进行了后续分析,该后续分析考察了接受膳食支持和教育以及强化生活方式干预的减重情况。强化生活方式干预,在对患者进行均衡营养模式教育的同时也给以营养代餐作为一种支持措施。总的来说,配合营养代餐的强化生活方式干预比单纯的膳食支持和教育能更有效地降低患者的体重(强化生活方式干预组中37.7%的患者在干预第一年结束时达到了减重10%的目标,而膳食支持和教育组只有3.3%的患者达到此目标)。
具体意见见表3。
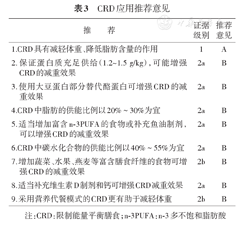
CRD应用推荐意见
CRD应用推荐意见
| 推荐 | 证据级别 | 推荐意见 |
|---|---|---|
| 1.CRD具有减轻体重、降低脂肪含量的作用 | 1 | A |
| 2.保证蛋白质充足供给(1.2~1.5 g/kg),可能增强CRD的减重效果 | 2a | B |
| 3.使用大豆蛋白部分替代酪蛋白可增强CRD的减重效果 | 2a | B |
| 4.CRD中脂肪的供能比例以20%~30%为宜 | 2a | B |
| 5.适当增加富含n-3PUFA的食物或补充鱼油制剂,可以增强CRD的减重效果 | 2a | B |
| 6.CRD中碳水化合物的供能比例以40%~55%为宜 | 2a | B |
| 7.增加蔬菜、水果、燕麦等富含膳食纤维的食物可增强CRD的减重效果 | 2b | B |
| 8.适当补充维生素D制剂和钙可增强CRD减重效果 | 2a | B |
| 9.采用营养代餐模式的CRD更有助于减轻体重 | 2b | B |
注:CRD:限制能量平衡膳食;n-3PUFA :n-3多不饱和脂肪酸
高蛋白膳食中,蛋白质的供给量一般为占供热比的20%以上,或至少在1.5 g/kg体重以上[26]。
研究表明,接受高蛋白膳食6个月的肥胖者比接受正常蛋白质饮食者体重下降更明显,1年随诊后高蛋白膳食仍较对照组多降低了10%腹部脂肪[27]。Noakes等[28]证实,采用高蛋白膳食比高碳水化合物膳食的肥胖人群体重下降更多(6.4 kg比3.4 kg,P=0.035 )。当受试者每日允许能量摄入为20 kcal/kg时,其蛋白质占总能量的30%,碳水化合物占45%,脂肪占25%,同时补充维生素和钾,12周后体重明显减轻(4.72±4.09)kg,BMI、腰围和腰臀比(WHR)也分别下降(1.87 ± 1.57)kg/m2、(3.73 ± 2.91 )cm和(0.017±0.029)[29]。Layman等[30]将健康成年肥胖个体随机分为高蛋白低碳水化合物组(PRO组)和低蛋白高碳水化合物饮食组(CHO组),4个月后,两组体重减少量虽无明显差别,但是PRO组的机体脂肪(体脂)含量减少更明显;相对于CHO组,PRO组对肥胖者血清中的甘油三酯、高密度脂蛋白胆固醇的改善更明显,并且依从性更高。一项为期2年的实验比较了高蛋白和高碳水化合物饮食在糖尿病超重者的减重效果,结果提示高蛋白膳食可能对存在糖尿病、心血管疾病和代谢综合征风险的患者有帮助[31]。113例中度肥胖患者经过4周的极低能量饮食的减重治疗后,体重降低了5%~ 10%,而随后6个月采用高蛋白膳食(18%)及正常蛋白饮食(15%)进行体重维持,结果显示高蛋白膳食体重反弹率更低[32]。由于慢性肾病患者可能因高蛋白饮食而增加肾脏血流负荷,建议合并慢性肾病患者应慎重选择高蛋白饮食。
具体推荐见表4。

高蛋白膳食推荐意见
高蛋白膳食推荐意见
| 推荐 | 证据级别 | 推荐意见 |
|---|---|---|
| 1.对于单纯性肥胖以及合并高甘油三酯血症者、高胆固醇症者采用高蛋白膳食较正常蛋白膳食更有利于减轻体重以及改善血脂情况;并有利于控制减重后体重的反弹 | 2a | B |
| 2.合并慢性肾病患者应慎重选择高蛋白饮食 | 4 | D |
轻断食模式也称间歇式断食(intermittent fasting)5︰2模式,即1周内5 d正常进食,其他2 d (非连续)则摄取平常的1/4能量(女性约500 kcal/d,男性600 kcal/d)的饮食模式[33]。
20世纪80年代,Vertes等[34]对519例门诊患者进行断食治疗,78%的患者体重下降超过18.2 kg,总体减重为每周1.5 kg,女性平均每周减重1.3 kg,男性每周减重2.1 kg,大多数均能接受该方案而无任何严重副作用。一项基于16例肥胖患者的研究显示[35],在隔日断食法干预8周后,患者体重平均下降(5.6 ± 1.0) kg,腰围平均缩小4.0 cm,体脂含量从原来的(45 ± 2)%降到(42 ± 2)%,收缩压由(124 ± 5)mmHg (1 mmHg=0.133 kPa)降到(116±3)mmHg ,总胆固醇、低密度脂蛋白胆固醇和甘油三酯浓度也分别下降(21±4)%、(25±10)%和(32±6)%,而高密度脂蛋白胆固醇水平无变化。Johnson等[36]的研究也发现,在隔日断食法干预8周后,肥胖患者的BMI较基线值下降8%,而低密度脂蛋白胆固醇和甘油三酯分别下降10%和40%。2013年发表的一项基于115例肥胖女性的研究[37]显示,干预3个月后,两日断食法的肥胖患者体重平均下降4 kg,而传统能量限制的肥胖患者体重平均下降2.4 kg,且前者胰岛素抵抗改善更明显。2014年一项关于2型糖尿病预防的Meta分析发现轻断食可有效减重及预防2型糖尿病,对超重和肥胖患者的血糖、胰岛素及低密度脂蛋白胆固醇、高密度脂蛋白胆固醇等代谢标记物均有改善[38]。
具体推荐见表5。

轻断食膳食推荐意见
轻断食膳食推荐意见
| 推荐 | 证据级别 | 推荐意见 |
|---|---|---|
| 1.轻断食模式有益于体重控制和代谢改善 | 2b | B |
| 2.轻断食模式在体重控制的同时,或可通过代谢和炎性反应改善,间接增加体重控制获益;同时增强糖尿病、心脑血管疾病及其他慢性疾病的治疗获益 | 2a | B |
运动对减肥的影响取决于运动方式、强度、时间、频率和总量。2013年美国关于成年人肥胖管理指南推荐[39],增加有氧运动(如快走)至每周150 min以上(每天30 min以上,每周的大多数天);推荐更高水平的身体活动(每周200~300 min),以维持体重下降及防止减重后的体重反弹(长期,1年以上)。
一项纳入35个随机对照试验的Meta分析发现,有氧运动对降低内脏脂肪有显著效果(干预时间4周~2年,每次运动20~75 min),而渐进性抗阻运动和有氧结合抗阻运动均无显著效果,建议有氧运动作为降低内脏脂肪的核心运动[40]。另一项Meta分析纳入了741例受试者,其BMI在27.8~33.8 kg/m2,运动干预时间为2.5~6.0个月,结果显示有氧运动的减肥效果更明显:抗阻运动对提高瘦体重更有效,与抗阻运动比较,有氧结合抗阻减肥效果更明显[41]。在一项单中心、平行随机对照试验中,比较了4种不同的运动量和运动强度,结果显示与对照组相比,各运动组体重和腰围均显著减少,各组间差异无统计学意义[42]。这项研究表明不同运动量和运动强度对腹型肥胖可能均具有减肥效果。
一项纳入了3 521名受试者的Meta分析[43],干预时间12~72个月,营养干预方式为降低能量摄入,主要为低脂(≤总能量的30%)、低饱和脂肪酸、增加水果蔬菜和膳食纤维的摄入。运动干预主要是在监督下进行有氧运动和抗阻训练,强度为50%~85%最大心率。结果发现与单纯饮食组或运动组相比,饮食结合运动的减重效果更加显著,同时可以看到在改善人体测量指标方面,营养干预优于运动治疗。Stephens等[44]在2014年对60项Meta分析和23个系统性综述进行了再评价,认为多种干预措施都可以帮助受试者达到减重目标,但其中营养干预研究得出的结论较为一致,即对于减重效果最为明确。而运动干预研究在不同的作者所做的Meta分析中得出的结论则有较大差异。这种结果的异质性与研究者选定的结局评价指标、研究设计存在很大关联。
一篇纳入了2项Meta分析的系统性综述[45],均显示体脂率有显著性降低。而其他肥胖指标(BMI、体重、中心性肥胖)则没有显著性差异。一篇纳入40项研究的系统性综述和Meta分析[46],评价了抗阻训练对肥胖儿童力量、体成分等的影响,显示抗阻运动对体成分有极小影响,且亚组分析显示运动量越大、年龄越小、随机对照设计产生更显著效果。一项纳入15个随机对照试验的系统性综述和Meta分析[47],比较仅饮食干预与饮食结合运动或仅运动干预对超重儿童减重和降低代谢风险的效果,结果显示,短期干预中仅饮食和饮食结合运动均产生了减重和代谢指标改善的效果,而长期干预显示饮食结合运动干预可以显著改善高密度脂蛋白胆固醇和空腹血糖、空腹胰岛素水平。
具体推荐见表6。
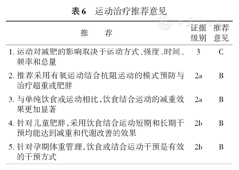
运动治疗推荐意见
运动治疗推荐意见
| 推荐 | 证据级别 | 推荐意见 |
|---|---|---|
| 1.运动对减肥的影响取决于运动方式、强度、时间、频率和总量 | 3 | C |
| 2.推荐采用有氧运动结合抗阻运动的模式预防与治疗超重或肥胖 | 2a | B |
| 3.与单纯饮食或运动相比,饮食结合运动的减重效果更加显著 | 2a | B |
| 4.针对儿童肥胖,采用饮食结合运动短期和长期干预均能达到减重和代谢改善的效果 | 2b | B |
| 5.针对孕期体重管理,饮食或结合运动干预是有效的干预方式 | 2b | B |
生活方式干预作为基础治疗,是一种囊括营养、运动、认知-行为及心理多方面的综合干预模式[50,51]。认知-行为及心理干预是通过调整超重和肥胖患者的生活环境及心理状态,帮助患者理解和认识体重管理、肥胖及其危害,从而做出行为改变。其中包括自我监控、控制进食、刺激控制、认知重建和放松技巧等[52]。
具体推荐见表7。

认知-行为及心理干预推荐意见
认知-行为及心理干预推荐意见
| 推荐 | 证据级别 | 推荐意见 |
|---|---|---|
| 1.对超重/肥胖者进行认知⁃行为干预能够达到减重效果,干预时间不少于6个月;若同时附加体力活动和饮食行为干预,减重效果更明显 | 2b | B |
| 2.对肥胖患者进行认知⁃行为干预和心理治疗有助于减重并维持减重效果 | 4 | D |
治疗后减重的维持非常重要。机体存在多种机制调控能量平衡以维持自身体重相对稳定,通常减重计划结束后一年,大部分人会恢复已减掉体重(复重)的30%~35%[62],4年内基本恢复到减重前水平[63]。发表于新英格兰医学杂志和美国医学会杂志的2项随机对照试验表明,适当的干预措施可在一定程度上延长减重后体重的维持时间[56,57]。世界胃肠病学会对肥胖管理制定的全球指南(WGO)强调,为了维持减重效果,医务人员和营养医师应向患者提供面对面或电话随访的减重维持计划,保持与患者的规律接触(每月或更加频繁),帮助其进行高强度体力活动(如200~ 300 min/周),规律监测体重变化(如每周或更加频繁),并保持低能量饮食(维持更低体重所必需)[64]。
英国国家卫生与临床优化研究所(NICE)指南认为肥胖管理包括节食、运动、行为改变,且需要长期随访并推荐低脂、高纤维饮食,增加体力活动,避免久坐,规律监测体重和腰围变化[61]。
一篇纳入了从1984年至2007年间42项随机对照试验的系统性综述认为,生活方式和行为干预措施[包括饮食控制和(或)代餐、体育锻炼、保持减重小组间人员交流等]配合一定的药物治疗,对减少减重后复重有效[65]。Dombrowski等[66]对非手术干预成人肥胖者减重后的长期维持进行了系统回顾和Meta分析,包含45项研究的7 788例患者,结果显示包括食物摄取和体力活动在内的行为干预可以使患者较对照组复重减少1.56 kg。
减重所引起的能量负平衡和能量储备的降低会促使关键中枢和外周调节因素发生改变,从而导致减重者食欲的增加和能量消耗的减少,而导致减重成功后的复重。这种调节作用不会在新的体重稳态形成后消退,这会促使减重成功者在心理和身体诱因的驱动下恢复减掉的体重[67]。
具体推荐见表8。

减重治疗后的维持推荐意见
减重治疗后的维持推荐意见
| 推荐 | 证据级别 | 推荐意见 |
|---|---|---|
| 1.医务人员应向减重者提供细致的减重后维持计划 | 3 | C |
| 2.生活方式和行为干预措施(包括饮食控制和/或代餐、体育锻炼、保持减重小组间人员交流等)配合药物治疗,对减轻减重后的复重有效 | 2a | B |
| 3.应适当进行减重者的心理辅导 | 4 | D |
| 4.网络干预对维持2年内减重效果有效 | 2b | B |
儿童期肥胖容易伴随焦虑、自卑等心理问题[69],同时也是成人肥胖、糖尿病、心血管疾病及其他代谢性疾病和肿瘤的潜在危险因素[70]。医学营养治疗主要通过培养良好的生活习惯而达到控制体重的目的。
一篇纳入25项研究的Meta分析[72]发现,相对于未母乳喂养过的新生儿,母乳喂养者发生儿童期肥胖的比率降低22%,且母乳喂养时间与肥胖发生率有剂量-效应关系。这与配方喂养提供了较高的脂肪和蛋白质,以及缺乏母乳中含有较多的活性物质可能有关[72,73]。
横断面研究表明,不爱吃早餐的群体发生超重和肥胖的比例更大[74,75]。芬兰一项出生队列研究发现,相对于规律进食早餐的青少年,很少吃早餐的群体更容易吸烟、喝酒、咖啡以及含有咖啡因的碳酸饮料,并且很少锻炼,BMI值更高[76]。
一项队列研究表明,高能量零食的摄入频率及进食时间与青少年肥胖有紧密联系。每日2次以上零食的青少年其肥胖风险比(risk ratio,RR)高于很少吃零食的青少年;以在早晨吃高能量零食的青少年为对照组,夜间进食零食的受试者发生肥胖和超重的RR为3.12[77]。一项长达19个月的队列研究表明,每天多喝12盎司(ounce, 1盎司=28.4 ml,12盎司约合340 ml)的含糖饮料,将会导致BMI升高0.24 kg/m2[78]。横断面研究发现,碳酸饮料与儿童期的肥胖有着密切关系,每周多摄入碳酸饮料240 ml的青少年发生肥胖的危险增加29%[79]。
一项队列研究表明,青少年女性膳食中血糖指数(glycemic-index)每升高1 SD,BMI和腰围分别增加0.77 kg/m2和1.45 cm;而膳食纤维摄入量每增加1 SD,会导致青少年女性BMI值降低0.44 kg/m2和青少年男性腰围降低1.45 cm[80]。
研究表明血清维生素B12和叶酸的浓度与青少年BMI值、躯干脂肪面积以及总脂肪面积呈负相关[81]。一项病例对照研究表明,肥胖儿童血清中维生素B12水平为400 ng/L,明显低于正常体重的儿童血清中维生素B12的水平(530 ng/L);相对于正常体重儿童,在调整性别和年龄等混杂因素的影响后,肥胖儿童血清中维生素B12偏低的风险比(odds ratio ,OR)高达4.33[82]。也有研究发现,肥胖儿童血清中含有更低水平的Zn、Se和Fe,但血清Cu的水平较高;血清Zn的水平和血清中总胆固醇水平有呈明显负相关,而与血清中HDL-C水平正相关[83]。维生素D的水平与儿童肥胖的负相关也得到了进一步的证实[84]。
具体推荐见表9。

儿童/青少年肥胖体重管理推荐意见
儿童/青少年肥胖体重管理推荐意见
| 推荐 | 证据级别 | 推荐意见 |
|---|---|---|
| 1.新生儿期应尽可能采用母乳喂养,并适当延长母乳喂养时间以减少儿童期肥胖发生风险 | 1 | A |
| 2.严格控制零食摄入,尤其是含糖类较高的零食以及碳酸饮料;应控制碳水化合物中高血糖指数食物的摄入 | 1 | A |
| 3.适量增加膳食纤维的摄入量 | 3 | C |
| 4.青少年肥胖与血B族维生素、维生素D、Zn、Se和Fe水平呈负相关,而与血清Cu水平呈正相关 | 2b | B |
大量研究显示,母体孕前及孕期的肥胖均与孕期合并症及不良妊娠结局相关,包括妊娠期糖尿病、妊娠高血压、子痫、早产、死胎、巨大儿、过期产、剖宫产、先天畸形等[85,86,87,88,89,90];远期不良影响包括产后母体及子代肥胖[91,92],增加母婴罹患2型糖尿病、高血压及其他代谢综合征的风险[93,94]。
一项前瞻性研究发现,超重女性生育能力下降8%,肥胖者下降达18%[95]。肥胖不仅影响自然受孕,同样影响辅助生殖的成功,增加自然流产及孕期并发症的风险[96,97]。应强调在辅助生殖实施前进行减重[98]。同时也有研究证实减重5%~10%就可以成功减掉30%的内脏脂肪[99],更有利于排卵发生[100]。
2009年美国医学研究所推荐建议孕早期增重0.5~ 2.0 kg,超重女性孕期增重7.0~ 11.5 kg,肥胖女性孕期增重5.0~ 9.0 kg[101]。相对于孕期增重超过7.0 kg的肥胖女性,孕期增重低于7.0 kg的肥胖女性发生子痫前期、剖宫产及巨大儿的几率明显降低[102]。美国一项涉及113 019例新生儿研究中,肥胖孕妇过低的体重增加加重孕妇早产的风险[103]。
在一项1 777例妊娠妇女队列研究中,用替代健康饮食指数(the alternative healthy eating index,AHEI)进行膳食评价,发现肥胖孕妇AHEI分数更低[104]。另一项2 247例妊娠妇女队列研究也发现,高能量、低营养素含量的食物(如碳酸饮料、果汁饮料、精制面粉)也是过高能量摄入的主要贡献者,同时此类膳食富含饱和脂肪酸[105]。小样本研究显示:当肥胖合并妊娠期糖尿病的孕妇能量限制在1 800 kcal左右时,孕妇体重能够得到控制且不出现酮症,也能够改善孕妇血糖水平并对新生儿出生体重无不良影响[106]。建议根据肥胖孕妇的身高、体重、年龄、活动水平等因素制定个体化的膳食能量计划。相对于BMI正常的孕妇,肥胖孕妇的新生儿神经管畸形发病率更高[90]。
具体推荐见表10。

围孕期体重管理推荐意见
围孕期体重管理推荐意见
| 推荐 | 证据级别 | 推荐意见 |
|---|---|---|
| 1.计划怀孕的肥胖女性应减重以提高自然受孕或辅助生殖的成功率,且可以减低不良妊娠结局 | 1 | A |
| 2.孕前叶酸建议摄入量为400 μg /d | 2b | B |
| 3.肥胖孕妇应依据身高、体重、年龄、活动水平等进行个体化的膳食能量计划,以使体重适度增长 | 2b | B |
| 4.建议孕早期增重0.5~2.0 kg,超重女性孕期增重7.0~11.5 kg,肥胖女性孕期增重5.0~9.0 kg | 3 | C |
| 5.肥胖女性产后哺乳至少6个月有利于产后体重恢复 | 3 | C |
| 6.膳食及运动干预可以帮助孕妇产后恢复到孕前体重 | 4 | D |
在我国19~45岁的女性中PCOS的发病率约为5.6%[109]。不同国家的研究显示PCOS患者肥胖的发生率在30%~70%[110,111]。系统性综述表明,与正常体重的PCOS女性相比,肥胖PCOS患者所有代谢和生殖的指标(除多毛症外),包括性激素结合球蛋白(sex hormone-binding globulin)下降,总睾酮、空腹血糖、空腹胰岛素增加和血脂升高[112]。
临床研究显示,PCOS患者对富含碳水化合物、高血糖指数食物以及高饱和脂肪的食物摄入均显著增加;同时具有总能量摄入过高以及久坐的特点[113]。一项系统性综述表明,对于PCOS患者,在减轻体重、改善胰岛素抵抗及高雄激素血症等方面,生活方式干预(饮食、运动和行为干预)比药物治疗更有效[114]。研究表明,超重或肥胖的PCOS患者轻度体重减轻(减少5%~10%)即可使血清睾酮浓度下降,也可恢复正常的排卵周期,并提高妊娠成功率[115,116]。因此,对于超重和肥胖的PCOS患者,建议首先进行生活方式干预(饮食和运动)以减轻体重。
(1)限制总能量摄入:超重和肥胖的PCOS患者在减重时应以CRD为首选治疗。随机对照试验表明,CRD可改善肥胖PCOS女性的代谢及激素水平,每日饮食总能量中减少500~1 000 kcal,即在6~12个月减少7%~10%的原体重[117,118]。(2)宏量营养素和血糖指数的选择:国内外研究显示,在限制总能量的基础上,高蛋白/低碳水化合物饮食(蛋白质30%、碳水化合物40%、脂肪30%,MHCD)和低蛋白/高碳水化合物饮食(蛋白质15%、碳水化合物55%、脂肪30%,CHCD)相比,均可降低体重和雄激素水平,MHCD明显增加胰岛素敏感性、减轻高胰岛素血症继而减轻胰岛素抵抗;低血糖指数饮食亦可通过降低PCOS患者(无论是否肥胖)胰岛素、睾酮水平,改善多毛和痤疮[119,120,121]。因此,在限制总能量基础上,无论宏量营养素如何配比,均可实现体重减轻及改善临床结局的目的。
在限制总能量、减轻体重的前提下,宏量营养素比例和质量选择对PCOS患者的生育、代谢、心理的影响存在着细微差别。低碳水化合物或低血糖指数饮食可更明显降低胰岛素抵抗、纤维蛋白原、总胆固醇和高密度脂蛋白胆固醇,低血糖指数饮食明显改善月经周期和生活质量,高蛋白膳食可明显改善抑郁和增强自尊;反之,高碳水化合物饮食明显增加游离睾酮指数[122]。有研究显示,肥胖PCOS患者使用限能量代餐可降低患者BMI,改善代谢及激素指标,增加受孕几率[117,123]。
PCOS体重管理推荐见表11。

多囊卵巢综合征(PCOS )体重管理推荐意见
多囊卵巢综合征(PCOS )体重管理推荐意见
| 推荐 | 证据级别 | 推荐意见 |
|---|---|---|
| 1.超重/肥胖的PCOS患者减轻体重,可改善其生殖功能和代谢紊乱。对于有妊娠要求者,首先推荐其减轻体重 | 2a | B |
| 2.在减重时应以限制能量饮食为首选方案 | 2b | B |
| 3.限能量摄入基础上的高蛋白/低碳水化合物饮食和低蛋白/高碳水化合物饮食均能获得代谢改善,前者可增加胰岛素敏感性 | 2a | B |
| 4.个体化方案、密切随访、医师监督以及社会支持都能促进体重达标与维持 | 4 | D |
代谢综合征是以超重/肥胖为中心并伴有一系列代谢紊乱的病症。随着社会生活水平的提高,以及国人膳食模式的变化,代谢综合征的流行呈现快速上升趋势,2000年至2001年的全国性横断面调查显示,男性和女性代谢综合征的患病率分别为10.0%和23.3%[129]。2011年美国Joslin糖尿病中心发布了合并糖尿病的肥胖患者临床营养指南,整部指南的目标人群实际是代谢综合征患者,其将体重管理置于营养管理的首要目标[3]。与此同时,该指南还提出将膳食管理与胰岛素治疗相配合,同时需要考虑与营养有关的代谢并发症的控制。
对于合并代谢综合征的肥胖患者,临床证据中较为一致的将生活行为方式干预作为减重和改善代谢紊乱的基础治疗措施。同时,对于各种膳食模式的比较发现,在控制总能量摄入的前提下,它们的总体效果相似。需要指出的是,目前的研究样本量均不大,且干预时间较短(12~24周)[130,131,132,133,134,135,136],尚欠缺长时间干预的研究证据。2015年,澳大利亚启动了一项针对中老年(50~ 69岁)MS患者的大样本(500例)减重干预研究,旨在检验综合性行为、营养和心理干预的影响,或将在未来几年得出一些有指导意义的结论[137]。
具体推荐见表12。

超重/肥胖者合并代谢综合征的体重管理推荐意见
超重/肥胖者合并代谢综合征的体重管理推荐意见
| 推荐 | 证据级别 | 推荐意见 |
|---|---|---|
| 1.生活方式干预是代谢综合征患者减重的基础治疗,干预内容应包括:加强体育锻炼、强化营养咨询、行为教育、心理疏导与小组支持 | 2b | B |
| 2.有效实现生活方式干预应该建立包括医师、营养师、心理咨询师、健身教练等在内的多学科干预指导小组 | 4 | D |
| 3.控制总能量摄入条件下,各种旨在减重的干预性膳食模式均可能有效,目前证据尚不支持哪一种膳食模式对于代谢综合征的改善特别有效 | 3 | C |
| 4.在控制总能量前提下,在膳食中添加核桃、亚麻籽或鳄梨可能有助于代谢改善 | 3 | C |
本共识制定委员会成员名单(按姓氏拼音排序):常翠青(北京大学第三医院运动医学研究所)、陈洁文(上海交通大学医学院附属第九人民医院营养科)、陈伟(中国医学科学院北京协和医院肠外肠内营养科)、陈怡(成都军区总医院营养科)、窦攀(北京大学第一医院营养科)、冯颖(复旦大学附属华山医院营养科)、葛声(上海交通大学附属第六人民医院临床营养科)、顾萍(青岛市中心医院营养科)、韩磊(青岛大学医学院附属医院营养科)、韩婷(上海市第十人民医院营养科)、洪莉(上海交通大学医学院附属上海儿童医学中心临床营养科)、胡怀东(重庆医科大学附属第二医院营养科)、胡雯(四川大学华西医院临床营养科)、华鑫(首都医科大学附属北京佑安医院营养科)、江华(四川省人民医院创伤代谢组学科实验室)、江涛(广西中医药大学第一附属医院临床营养科)、景洪江(空军总医院临床营养科)、李增宁(河北医科大学第一医院营养科)、李莉(新疆医科大学第一附属医院营养科)、李丽(华中科技大学附属同济医院肾内科)、李响(北京阜外心血管病医院营养科)、林宁(成都军区总医院营养科)、刘景芳(复旦大学附属华山医院营养科)、刘晓军(白求恩国际和平医院营养科)、刘燕萍(中国医学科学院北京协和医院营养科)、刘英华(解放军总医院营养科)、柳鹏(北京大学人民医院营养科)、柳萍(北京市第一中西医结合医院内科)、吕阳梅(西安市中心医院营养科)、马方(中国医学科学院北京协和医院营养科)、马文君(广东省人民医院营养科)、钮丹叶(苏州市立医院东区营养科)、邱小文(广州军区总医院营养科)、沈旸(南京医科大学附属淮安第一医院临床营养科)、施万英(中国医科大学附属第一医院营养科)、孙明晓(北京怡德医院)、孙萍(山西医科大学第一医院营养科)、孙新(吉林省人民医院营养科)、谭桂军(天津市第一中心医院营养科)、谭荣韶(暨南大学医学院附属第四医院营养科)、汤庆娅(上海交通大学医学院附属新华医院临床营养科)、唐琼雄(香港大学玛丽医院上消化道外科)、陶晔璇(上海交通大学医学院附属新华医院临床营养科)、滕越(北京市海淀区妇幼保健院营养科)、王静(南京大学医学院附属鼓楼医院临床营养科)、王朝霞(郑州大学附属洛阳中心医院营养科)、辛宝(陕西中医药大学第二附属医院营养科)、谢雯霓(深圳市第三人民医院营养科)、许红霞(第三军医大学第三附属医院营养科)、闫雅更(哈尔滨医科大学附属第一医院营养科)、杨大刚(贵阳医科大学附属医院营养科)、杨勤兵(北京清华长庚医院营养科)、姚颖(华中科技大学附属同济医院肾内科)、袁文臻(兰州大学第一医院临床营养科)、张春梅(首都医科大学附属北京潞河医院临床营养科)、张明(北京大学深圳医院营养科)、张片红(浙江大学医学院附属第二医院营养科)、张胜康(中南大学湘雅二医院营养科)、张勇胜(广西医科大学第一附属医院营养科)、赵秋玲(兰州军区兰州总医院营养科)、郑锦锋(南京军区南京总医院营养科)、郑璇(第二军医大学长海医院临床营养科)、周春凌(哈尔滨医科大学附属第四医院营养科)、周莉(苏州大学附属第一医院临床营养科)、周芸(大连医科大学附属第二医院临床营养科)、朱翠凤(南方医科大学深圳医院营养科)、朱惠莲(中山大学公共卫生学院营养学系)
利益冲突声明 所有参编人员均未接受任何利益相关公司的资金支持,未持有任何与本共识涉及领域的专利
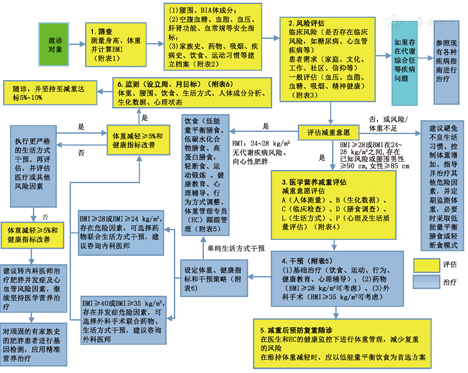

注:BMI:体质指数;BIA:生物电阻测量法;HC:体重管理专员
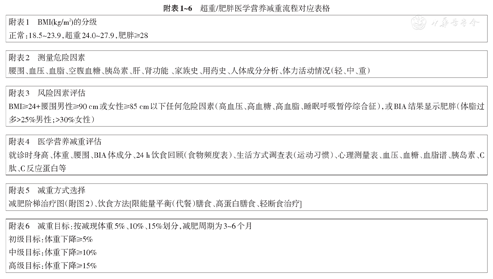
超重/肥胖医学营养减重流程对应表格
超重/肥胖医学营养减重流程对应表格
| 附表1 BMI(kg/m2)的分级 |
| 正常:18.5~23.9,超重24.0~27.9,肥胖≥28 |
| 附表2测量危险因素 |
| 腰围、血压、血脂、空腹血糖、胰岛素、肝、肾功能、家族史、用药史、人体成分分析、体力活动情况(轻、中、重) |
| 附表3风险因素评估 |
| BMI≥24+腰围男性≥90 cm或女性≥85 cm以下任何危险因素(高血压、高血糖、高血脂、睡眠呼吸暂停综合征),或BIA结果显示肥胖(体脂过多>25%男性;>30%女性) |
| 附表4医学营养减重评估 |
| 就诊时身高、体重、腰围、BIA体成分、24 h饮食回顾(食物频度表)、生活方式调查表(运动习惯)、心理测量表、血压、血糖、血脂谱、胰岛素、C肽、C反应蛋白等 |
| 附表5减重方式选择 |
| 减肥阶梯治疗图(附图2)、饮食方法[限能量平衡(代餐)膳食、高蛋白膳食、轻断食治疗] |
| 附表6减重目标:按减现体重5%、10%、15%划分,减肥周期为3~6个月 |
| 初级目标:体重下降≥5% |
| 中级目标:体重下降≥10% |
| 高级目标:体重下降≥15% |
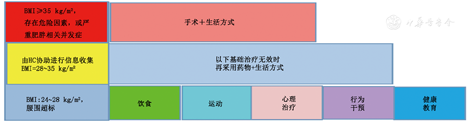

注:BMI:体质指数;HC:体量管理专员
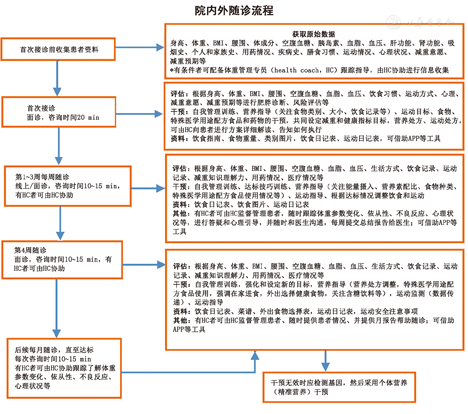

注:BMI:体质指数;HC:体重管理专员;APP:应用程序

























