
“糖尿病前期”是指通过流行病学研究识别出来的血糖水平偏高但尚未达到糖尿病诊断标准的人群,该人群无论发生糖尿病还是心血管疾病的风险均较血糖正常人显著增加。糖尿病前期人群包括空腹血糖受损(IFG)和葡萄糖耐量受损(IGT)人群。近几十年来,虽然已开展了大量糖尿病相关预防研究,且多数糖尿病预防研究均证实不同干预措施可以降低2型糖尿病发生风险,但这一结论仅在IGT人群中得到了广泛验证,尚未在单纯IFG人群中获得充足的证据。而在糖尿病前期人群中是否可以通过一定的干预措施降低微血管及大血管并发症的发生风险目前尚不能得出确切结论,在单纯空腹血糖受损人群中就更不足为知了。因此,目前尚没有充足的临床证据证实对单纯空腹血糖受损人群进行干预,能够带来代谢指标的改善,以及微血管、大血管并发症方面的长期获益。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
2型糖尿病已经成为危害全球公众健康的头号杀手之一,2019年国际糖尿病联盟(International Diabetes Federation,IDF)最新发布的全球糖尿病地图(9th IDF Diabetes Atlas)数据显示,2019年全球约有4.63亿20~79岁成人患有糖尿病(每11个成年人中即有1人为糖尿病患者);预计到2045年,这一数字将达到7.002亿。而我国糖尿病患病人数目前位列全球榜首[1]。既往研究显示,糖尿病前期人群是最主要的2型糖尿病高危人群[2],因此长期以来国内外在糖尿病前期人群中开展了大量2型糖尿病的预防研究。
“糖尿病前期”是指通过流行病学研究识别出来的血糖水平偏高但尚未达到糖尿病诊断标准的人群,该人群无论发生糖尿病还是心血管疾病的风险均较血糖正常人显著增加。不同学术组织对糖尿病前期的定义稍有不同,美国糖尿病学会(American Diabetes Association,ADA)定义糖尿病前期人群为空腹血浆血糖水平在5.6~6.9 mmol/L之间,或75 g口服葡萄糖耐量试验糖负荷后2 h血浆血糖在7.8~11.0 mmol/L之间,或糖化血红蛋白(glycated hemoglobin A1c,HbA1c)在5.7%~6.4%之间[3]。中华医学会糖尿病学分会(Chinese Diabetes Society,CDS)在2017版中国2型糖尿病防治指南中对糖尿病前期的定义则沿用了1999年WHO对糖代谢状态分类的标准,即糖尿病前期包括空腹血糖受损(impaired fasting glucose,IFG)和葡萄糖耐量受损(impaired glucose tolerance,IGT),IFG是指6.1 mmol/L≤空腹血浆葡萄糖<7.0 mmol/L且糖负荷后2 h血糖<7.8 mmol/L;IGT是指空腹血糖<7.0 mmol/L,且7.8 mmol/L≤糖负荷后2 h血糖<11.1 mmol/L[4]。
我国近十余年来有三项较为重要的大规模流行病学研究报道了糖尿病前期人群的患病率,但由于这三项研究中所调查的对象以及对糖尿病前期人群的定义不尽相同,因此所报道的患病率差异较大。其中2007至2008年CDS组织全国14个省市开展的糖尿病流行病学调查研究结果显示,我国20岁及以上成年人的糖尿病前期患病率为15.5%[5];2010年中国疾病预防控制中心和中华医学会内分泌学分会进行的全国调查显示,中国18岁及以上人群糖尿病前期的患病率为50.1%[6];而 2013年我国慢性病及其危险因素监测则显示,18岁及以上人群糖尿病前期患病率为35.7%[7]。在后两项研究中,均采用ADA建议的糖尿病前期诊断标准(包括加入HbA1c这一指标),而2007~2008年的全国流行病学调查则仅依据静脉血浆血糖水平诊断糖尿病前期,且采用的是1999年WHO诊断标准,因此患病率低于后两项研究。
在2007至2008年全国流行病调查研究中,虽然糖尿病前期的患病率为15.1%,但单纯IFG的患病率仅为3.2%,占全部糖尿病前期人群的1/4左右(24.7%);而在2010年的全国调查中,因为将诊断IFG的切点选择在了5.6 mmol/L,因此在该研究中,糖尿病前期人群中IFG的人群比例大大增加,按照研究发表论著所提供的数字计算,单纯IFG的患病率在该研究中为21.3%,占该研究中糖尿病前期人群的42.7%;在2013年所进行的全国慢性病及其危险因素监测研究中,同样是按照ADA的诊断标准对糖尿病前期人群进行了分类,但因原文未提供具体空腹血糖升高及口服葡萄糖耐量试验2 h血糖升高的具体人数,因此无法从该研究中推算单纯IFG的患病率。总之,根据现有数据,单纯IFG的人群在我国糖尿病前期人群中的占比约为25%~40%[5, 6, 7]。
当前,国际上多个指南均建议对糖尿病前期人群进行干预,但尚无任何指南对不同糖代谢状态的糖尿病前期人群提出了分层的干预措施建议。在CDS出版的中国2型糖尿病防治指南(2017版)中虽然引用了针对IGT人群通过强化生活方式干预或药物干预减少糖尿病发生风险的临床证据,但指南所给出的干预建议是针对全部糖尿病前期人群的[4]。美国糖尿病学会同样是对糖尿病前期人群提出了统一的干预策略,即建议所有糖尿病前期人群接受强化生活方式干预,对体质指数(body mass index,BMI)≥ 35 kg/m2,年龄<60岁,以及曾罹患妊娠期糖尿病的妇女建议应用二甲双胍进行干预[2]。
正如前文所述,糖尿病前期包括单纯IFG和IGT(单纯IGT以及IGT+IFG),且单纯IFG的人群在糖尿病前期人群中占有一定比例,既往研究显示,IFG人群具有较为严重的肝脏胰岛素抵抗,肌肉的胰岛素敏感性仅轻度降低或接近正常,而IGT则刚好相反,以肌肉的胰岛素抵抗尤为明显。在β细胞功能缺陷方面,虽然IFG和IGT均显示出早相胰岛素分泌降低,但是IGT同时还伴有明显的晚时相胰岛素分泌降低[8]。在临床结局方面,流行病学研究虽然看到IFG与IGT人群发生2型糖尿病的风险均明显升高,但IGT与心血管风险事件相关关系更强[9]。既然IFG与IGT在病理生理机制、临床转归方面均显示出截然不同的特点,那么既往在以IGT为主的糖尿病前期人群中获得的与糖尿病预防相关的临床证据适合于外推到所有糖尿病前期人群吗?在单纯IFG人群中有充足与糖尿病预防相关的临床证据吗?本文将对上述问题进行分析与讨论。
目前已经具有研究证据的糖尿病预防策略即包括生活方式干预,同时也包括药物干预。随着各种具有不同机制的降糖药、降压药、减重药上市,近三十年来,强化生活方式干预、降糖药物、减重药物、降压药物均有研究显示可能降低糖尿病前期人群发生2型糖尿病的风险。表1概括了较为重要的糖尿病预防研究或具有相关重要信息的研究的主要特征及研究结果。
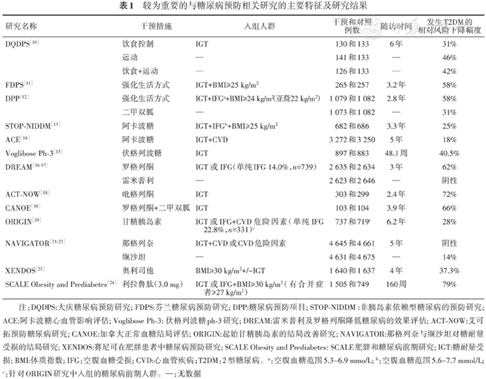
较为重要的与糖尿病预防相关研究的主要特征及研究结果
较为重要的与糖尿病预防相关研究的主要特征及研究结果
| 研究名称 | 干预措施 | 入组人群 | 干预和对照 例数 | 随访时间 | 发生T2DM的 相对风险下降幅度 |
|---|---|---|---|---|---|
| DQDPS[10] | 饮食控制 | IGT | 130和133 | 6年 | 31% |
| 运动 | — | 141和133 | — | 46% | |
| 饮食+运动 | — | 126和133 | — | 42% | |
| FDPS[11] | 强化生活方式 | IGT+BMI≥25 kg/m2 | 265和257 | 3.2年 | 58% |
| DPP[12] | 强化生活方式 | IGT+IFGa+BMI≥24 kg/m2(亚裔22 kg/m2) | 1 079和1 082 | 2.8年 | 58% |
| 二甲双胍 | — | 1 073和1 082 | — | 31% | |
| STOP-NIDDM[13] | 阿卡波糖 | IGT+IFGb+BMI≥25 kg/m2 | 682和686 | 3.3年 | 25% |
| ACE[14] | 阿卡波糖 | IGT+CVD | 3 272和3 250 | 5年 | 18% |
| Voglibose Ph-3[15] | 伏格列波糖 | IGT | 897和883 | 48.1周 | 40.5% |
| DREAM[16-17] | 罗格列酮 | IGT 或 IFG(单纯IFG 14.0%, n=739) | 2 635和2 634 | 3年 | 62% |
| 雷米普利 | — | 2 623和2 646 | — | 阴性 | |
| ACT-NOW[18] | 吡格列酮 | IGT | 303和299 | 2.4年 | 72% |
| CANOE[19] | 罗格列酮+二甲双胍 | IGT | 103和104 | 3.9年 | 66% |
| ORIGIN[20] | 甘精胰岛素 | IGT或IFG+CVD危险因素(单纯IFG 22.8%,n=331)c | 737和719c | 6.2年 | 28% |
| NAVIGATOR[21-22] | 那格列奈 | IGT+CVD或CVD危险因素 | 4 645和4 661 | 5年 | 阴性 |
| 缬沙坦 | — | 4 631和4 675 | — | 14% | |
| XENDOS[23] | 奥利司他 | BMI≥30 kg/m2+/-IGT | 1 640和1 637 | 4年 | 37.3% |
| SCALE Obesity and Prediabetes[24] | 利拉鲁肽(3.0 mg) | IGT或IFG+BMI≥30 kg/m2(有合并症者≥27 kg/m2) | 1 505和749 | 160周 | 79% |
注:DQDPS:大庆糖尿病预防研究; FDPS:芬兰糖尿病预防研究; DPP:糖尿病预防项目; STOP-NIDDM :非胰岛素依赖型糖尿病的预防研究; ACE:阿卡波糖心血管影响评估; Voglibose Ph-3: 伏格列波糖ph-3研究; DREAM:雷米普利及罗格列酮降低糖尿病的效果评估; ACT-NOW:艾可拓预防糖尿病研究; CANOE:加拿大正常血糖结局评估; ORIGIN:起始甘精胰岛素的结局改善研究; NAVIGATOR:那格列奈与缬沙坦对糖耐量受损的结局研究; XENDOS:赛尼可在肥胖患者中糖尿病预防研究; SCALE Obesity and Prediabetes: SCALE肥胖和糖尿病前期研究; IGT:糖耐量受损; BMI:体质指数; IFG:空腹血糖受损; CVD:心血管疾病;T2DM:2型糖尿病。a:空腹血糖范围5.3~6.9 mmo/L; b:空腹血糖范围5.6~7.7 mmol/L; c:针对ORIGIN研究中入组的糖尿病前期人群。—:无数据
在表1所列出的13项糖尿病预防研究中,仅有三项研究包括了单纯IFG人群,分别是DREAM研究、ORIGIN研究以及SCALE Obesity and Prediabetes研究,其余研究均为IGT人群(包括单纯IGT以及IGT+IFG人群)。其中DREAM研究中单纯IFG人群所占比例为14%(共计739人),ORIGIN研究中单纯IFG人群占全部糖尿病前期受试者的比例为22.8%(共计331人),而SCALE Obesity and Prediabetes研究则未报告单纯IFG所占比例或具体例数,但是从该研究受试者平均空腹血糖水平仅为(5.5±0.6)mmol/L(干预组)和(5.5±0.5)mmol/L(对照组)不难看出,虽然入组标准中包括了IFG人群,但实际入组的空腹血糖升高的人群比例应该较低。
汇总表1列举的13项研究可以看到,入组不同糖尿病预防研究的糖尿病前期人群总数高达36 327人,而其中明确为单纯IFG的人群仅为1 070人,占总受试人群的比例仅仅为2.9%。因此,基于如此之低的单纯IFG受试人数,无论某一糖尿病预防研究得出了何种结论,均难以将其推广至IFG人群中予以实施。
已被指南推荐应用于糖尿病前期人群延缓糖尿病发生的干预措施在单纯IFG人群中的证据明显不足。
从表1中可以看出,多数糖尿病预防相关研究的结果显示通过某些干预措施,能够降低受试人群的2型糖尿病的发生风险。但我们也注意到,在预防糖尿病方面得出阳性结论的众多研究所入组的人群多为IGT人群,而非单纯IFG。在众多干预措施中,仅接受罗格列酮每日8 mg(DREAM研究)及甘精胰岛素(ORIGIN研究)两项干预措施的受试者中包括了单纯IFG人群。而在这两项研究中,仅DREAM研究明确报告了罗格列酮对于单纯IFG人群预防糖尿病发生的效果。在DREAM研究中,亚组分析显示,无论基线糖代谢状态如何(单纯IFG,单纯IGT,IGT+IFG),罗格列酮每日8 mg在减少糖尿病发生风险上的作用基本相同 [初级终点HR:单纯IFG组0.30(0.19~0.49) ,单纯IGT组0.45(0.36~0.55),IFG+IGT组0.36(0.29~0.43)]。到目前为止,已被指南推荐应用于糖尿病前期人群,延缓糖尿病发生的干预措施包括强化生活方式干预、二甲双胍、阿卡波糖等均未获得充分的在单纯IFG人群中可以预防糖尿病的研究证据。
各种干预措施在IFG人群中是否能够减少各种糖尿病微血管并发症仍然存在争议。
糖尿病与远期微血管并发症发生风险之间的相关关系是不容置疑的,糖尿病诊断标准的血糖切点就是基于血浆葡萄糖水平与糖尿病特异的微血管并发症(主要是视网膜病变)之间的相关关系所确定,因此,预防糖尿病,从理论上讲应该也可以预防微血管并发症,包括糖尿病视网膜病变、糖尿病肾病以及糖尿病神经病变[25]。
目前进行了长期随访的两项最著名的糖尿病预防研究是大庆糖尿病预防研究及其长期随访结局研究(DQDPS/DQDPOS)[26],以及美国糖尿病预防研究及其长期随访结局研究(DPP/DPPOS)[27]。虽然DQDPOS随访30年的数据显示,微血管并发症复合终点在强化生活方式干预组(包括饮食、运动、饮食+运动)中较对照组下降35%(95% CI 5%~55%, P=0.025) ,但该研究并未纳入单纯IFG人群[26]。DPPOS同样未入组单纯IFG的人群,但其对微血管并发症复合终点的主要研究结论却与DQDPOS不同,在随访结束时,微血管并发症复合终点(肾病、神经病变、视网膜病变)在不同干预措施(强化生活方式干预、二甲双胍、对照)之间并未显示出统计学差异(微血管并发症患病率11%~13%)[27]。
DREAM研究中包括了单纯IFG人群,该研究是应用罗格列酮和雷米普利进行干预的糖尿病预防研究,在该研究36个月随访结束时,罗格列酮干预组较安慰剂组肾脏终点(肾脏复合终点包括:从正常尿蛋白进展到微量白蛋白尿或蛋白尿,或从微量白蛋白尿进展至蛋白尿,或预估肾小球滤过率下降≥30%,或需要进行透析或者移植治疗的肾功能不全)风险下降20%(12.3%和15%, P=0.005)[28]。在该研究中所纳入的单纯IFG人群中,虽未详细报道罗格列酮干预是否能够降低单纯IFG人群肾脏并发症的发生风险,但是在未发生肾脏终点及发生了肾脏终点的人群中,单纯IFG所占比例相差无几(13.2%和14.2%)[28]。
综上所述,各种干预措施在预防糖尿病的同时是否能够减少各种糖尿病微血管并发症的发生在糖尿病前期人群,包括单纯IFG人群中仍然存在争议,有待于进一步研究验证。
对于单纯IFG人群,目前尚无任何干预措施被证实可以减少该人群发生大血管并发症的风险。
大血管并发症的发生与多重危险因素相关,除血糖外,还包括血压、血脂、吸烟等等,有些针对糖尿病前期的干预措施如强化生活方式干预、胰岛素增敏剂不但能改善血糖、还可以改善胰岛素抵抗及其他的心血管危险因素如血压、血脂和炎症指标等,因此干预糖尿病前期对糖尿病相关大血管并发症的影响可能会与对微血管并发症产生的影响有所不同。
虽然几十年来已经开展了众多糖尿病预防研究,但是报道了心血管事件结局的研究屈指可数,这首先是由于以心血管事件作为终点的研究大多需要较长时间、较大样本量才能够完成,而多数糖尿病预防研究并没有充足的样本量及研究时长来完成上述分析;另外多数糖尿病预防研究在设计之初多以血糖或其他代谢指标作为终点,而未将心血管事件列为研究终点之一[25]。
表2中总结了主要的糖尿病预防研究或具有相关重要信息的研究对于心血管事件发生风险的影响。从表2可以看出,目前在糖尿病前期人群中进行干预是否能够减少心血管事件发生风险尚存在争议,仅少数研究显示出阳性结果。
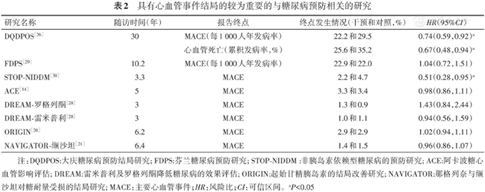
具有心血管事件结局的较为重要的与糖尿病预防相关的研究
具有心血管事件结局的较为重要的与糖尿病预防相关的研究
| 研究名称 | 随访时间(年) | 报告终点 | 终点发生情况(干预和对照,%) | HR(95%CI) |
|---|---|---|---|---|
| DQDPOS[26] | 30 | MACE(每1 000人年发病率) | 22.2和29.5 | 0.74(0.59,0.92)a |
| 心血管死亡(累积发病率,%) | 25.6和35.2 | 0.67(0.48,0.94)a | ||
| FDPS[29] | 10.2 | MACE(每1 000人年发病率) | 22.9和22.0 | 1.04(0.72,1.51) |
| STOP-NIDDM[30] | 3.3 | MACE | 2.2和4.7 | 0.51(0.28,0.95)a |
| ACE[14] | 5 | MACE | 3.3和3.4 | 0.98(0.86,1.11) |
| DREAM-罗格列酮[28] | 3 | MACE | 1.3和0.9 | 1.43(0.84,2.44) |
| DREAM-雷米普利[28] | 3 | MACE | 1.0和1.1 | 0.94(0.56,1.59) |
| ORIGIN[20] | 6.2 | MACE | 2.9和2.9 | 1.02(0.94,1.11) |
| NAVIGATOR-缬沙坦[21] | 6.4 | MACE | 1.4和1.5 | 0.96(0.86,1.07) |
注:DQDPOS:大庆糖尿病预防结局研究; FDPS:芬兰糖尿病预防研究; STOP-NIDDM :非胰岛素依赖型糖尿病的预防研究; ACE:阿卡波糖心血管影响评估; DREAM:雷米普利及罗格列酮降低糖尿病的效果评估; ORIGIN:起始甘精胰岛素的结局改善研究; NAVIGATOR:那格列奈与缬沙坦对糖耐量受损的结局研究; MACE:主要心血管事件;HR:风险比;CI:可信区间。aP<0.05
而在纳入了单纯IFG人群的两项研究中,DREAM研究和ORIGN研究均未获得对于糖尿病前期人群具有能够减少心血管事件发生风险的阳性结果,因此,对于单纯IFG人群,目前尚无任何干预措施被证实可以减少该人群发生大血管并发症的风险。
糖尿病前期人群包括单纯IFG以及IGT人群,正如前文所述,在本文所讨论的众多较大规模、具有较为重要影响的糖尿病预防研究中,我们可以看到,受试者大多均为IGT人群,即糖负荷后血糖异常,而空腹血糖可为正常或异常。在表1所列出的研究中,仅有三项研究包括了单纯IFG人群(DREAM、ORIGIN和SCALE Obesity and Prediabetes研究),其中仅DREAM(单纯IFG 739例)及ORIGIN(单纯IFG 331例)研究明确列出了受试者中所包含的单纯IFG的例数,而这一数字仅占全部受试者的不足3%。
因此,虽然多数糖尿病预防研究均证实不同干预措施可以降低2型糖尿病发生风险,但这一结论仅在IGT人群中得到了广泛验证,尚未在单纯IFG人群中获得充足的证据。而在糖尿病前期人群中是否可以通过一定的干预措施降低微血管及大血管并发症的发生风险目前尚不能得出确切结论,在单纯IFG人群中就更不足为知了。
综上所述,目前尚没有充足的临床证据证实对单纯IFG人群进行干预,能够带来代谢指标的改善,以及微血管、大血管并发症方面的长期获益。
1.既往已有基础和临床研究显示,单纯IFG和IGT 的病理生理存在差异[8]。针对以IGT为特征的有效干预手段是否在IFG人群中依然有效,在科学上尚无答案。因此需要在不同糖代谢异常特征的人群中探索更具有针对性的精准干预手段。建议开展进一步阐明单纯IFG及IGT人群的自然病程研究及精准干预研究。
2.世界卫生组织、美国糖尿病联合会及其学术组织已推荐采用HbA1c作为诊断糖尿病和糖尿病前期的指标。但在IGT人群获得的糖尿病前期干预的临床证据是否可外延到通过HbA1c水平5.7%~6.4%诊断的糖尿病前期患者同样面临着与本文所讨论的与IFG相关的内容相同的问题,也需要科学的答案。
3.建议未来应在单纯IFG人群开展糖尿病预防研究,或者在糖尿病前期人群的干预研究中根据糖代谢状态进行分层,从而为建立针对单纯IFG人群的干预措施提供更充分的临床证据。
所有作者均声明不存在利益冲突



























