
2021年诺贝尔生理学或医学奖颁予辣椒素受体瞬时受体电位香草酸亚家族成员1(TRPV1)的发现者美国科学家David Julius,TRPV1的发现揭示了温度感知的机制,丰富了人们对温度感知和适应周围环境的认识。TRPV1在脂肪、肝脏和肌肉等代谢器官也有丰富的表达,但其生物学意义并不清楚。为此,国内外学者对TRPV1调控糖脂代谢的作用及辣膳食对代谢病的治疗效益进行了积极探索,开辟了TRPV1防治代谢病的新领域。

我们如何感知世界?人类的感官机制一直激发着科学家们的好奇心。1944年Joseph Erlanger和Herbert Gasser发现了不同类型的感觉神经纤维传导,2004年Richard Axel和Linda Buck因揭示了气味分子和嗅觉感受器的机制,先后获得了诺贝尔生理学或医学奖。1997年美国神经生物学家David Julius发现了辣椒素感应基因,该基因编码了一种可被辣椒素激活的离子通道,称为“辣椒素受体”[1],因其与瞬时受体电位通道(transient receptor potential,TRP)家族同源,其配体辣椒素等含香草酸结构,也称之为瞬时受体电位香草酸亚家族成员1(transient receptor potential vanilloid-1,TRPV1)。近年辣椒素受体TRPV1晶体结构已被解析,并揭示了TRPV1如何感知温度和痛觉,从而适应周围环境的机制,这为以TRPV1为靶点,研发新的镇痛药物,治疗急慢性疼痛提供了新思路。为此,2021年诺贝尔生理学或医学奖授予了David Julius。TRPV1的发现揭示了温度及疼痛感知的机制,丰富了人们对温度感知和适应周围环境的认识。TRPV1在脂肪、肝脏和肌肉等代谢器官也有丰富的表达,但其生物学意义并不清楚。为此,国内外学者对TRPV1调控糖脂代谢的作用及辣膳食对代谢病的治疗效益进行积极探索,开辟了TRPV1防治代谢病的新领域。
TRPV1作为TRP通道家族中TRPV(Vanilloid)亚家族成员,是一种对钠、钙等通透的非选择性阳离子通道,人源TRPV1由838个氨基酸组成,其结构包含6个跨膜结构域,C端和N端均位于细胞膜内,并在第5段与第6段之间形成阳离子可渗透孔区域。TRPV1通道通常以四聚体形式定位于细胞膜上,此外线粒体膜上也发现有TRPV1通道表达。与电压依赖的离子通道不同,TRPV1通道无典型的电压感受器,主要被热(>42 ℃)、酸性(pH值<6)、辣椒素和其他植物来源的香草素等刺激激活。此外,机体内源性物质(如花生四烯酸代谢物、过氧化氢、一氧化氮等)也可激活TRPV1[2]。TRPV1蛋白翻译后的磷酸化对其功能的发挥至关重要。蛋白激酶A(protein kinase A,PKA)和钙/钙调蛋白依赖性蛋白激酶Ⅱ(calcium/calmodulin-dependent protein kinase Ⅱ,CAMKⅡ)可磷酸化TRPV1使其活性增加,而钙调磷酸酶使TRPV1去磷酸化可导致通道脱敏[3, 4]。磷脂酶C水解磷脂酰肌醇-4,5-二磷酸也可增加TRPV1活性[5]。在神经系统,TRPV1通过调控细胞钙信号或胞膜去极化,介导机体对内、外源性化学刺激和温度等物理刺激做出反应,引起伤害信号向中枢神经传递并产生痛觉。
除在神经系统外,TRPV1在哺乳动物的心血管、代谢、消化、呼吸和泌尿等系统的组织细胞中广泛表达,但TRPV1在非神经系统中的作用及其机制研究甚少。为此,国内外学者对TRPV1的非温度感知作用进行了探索。2004年以来,笔者团队围绕TRPV1在糖脂代谢调节中的作用及其与代谢病的关联开展了系统的研究。
1.TRPV1在脂肪的分布及作用:能量摄入过多而消耗减少,使脂肪在体内过度堆积导致肥胖。脂肪分为白色、棕色和米色脂肪。TRPV1可通过改变食欲相关激素水平或调节胃肠道迷走神经传入信号影响食欲。笔者首先报道了TRPV1在脂肪细胞及脂肪组织中表达,辣椒素激活脂肪细胞TRPV1增加细胞钙信号,通过抑制过氧化物酶体增殖物激活受体(peroxisome proliferators activated receptor γ,PPARγ)和脂肪酸合酶减少脂质生成[6],并发现辣椒素激活脂肪TRPV1增加缝隙连接蛋白43介导的脂肪细胞间Ca2+内流,从而促进脂肪分解[7]。我们和其他团队合作发现棕色脂肪也有丰富的TRPV1表达,辣椒素激活TRPV1增加棕色脂肪Sirt-1表达,促进其乙酰化以及PPARγ和PRDM-16的相互作用,增加能量消耗[8]。
2.TRPV1与血糖稳态:TRPV1在大鼠胰岛β细胞和β细胞系中有表达,辣椒素可剂量依赖性的增加胰岛素分泌,予辣椒素可增加大鼠血浆胰岛素水平,TRPV1拮抗剂可阻断这种作用。TRPV1也存在于支配胰岛的传入感觉神经中,通过刺激感觉神经调节胰岛素的分泌。辣膳食可增加人血浆胰高糖素样肽-1(glucagon like peptide-1,GLP-1)水平,降低Ghrelin水平。我们的研究结果显示,TRPV1也存在于表达GLP-1的肠细胞,激活TRPV1通过Ca2+依赖机制刺激GLP-1的释放。辣椒素可促进小鼠GLP-1分泌,这种作用被TRPV1拮抗剂抑制,而在TRPV1敲除小鼠中则不存在,抑制GLP-1信号可部分阻断辣椒素引起的胰岛素水平增加[9]。
3.TRPV1与肝脏和肌肉:肝脏涉及糖、蛋白质和脂肪三大代谢,对维持机体糖脂代谢稳态有重要作用,而肌肉参与脂肪酸氧化和糖酵解。TRPV1在肝脏及肌肉均有丰富表达,辣椒素激活肝脏TRPV1可上调解耦蛋白2(uncoupling protein 2,UCP2)及过氧化物酶体增殖物激活受体δ(peroxisome proliferators activated receptor δ,PPARδ)表达,增强肝脏自噬作用,减少肝细胞的脂质沉积[10, 11]。辣椒素激活TRPV1增加肌细胞的钙信号及过氧化物酶体增殖物激活受体γ共激活因子-1α(peroxisome proliferator-activated receptor γ coactivator-1α,PGC-1α)表达,上调骨骼肌PGC-1α,促进脂肪酸氧化和线粒体能量代谢,增加慢肌纤维功能,从而增强运动耐力[12]。此外,辣椒素激活TRPV1还可增加肌细胞腺苷酸激活蛋白激酶(adenosine monophosphate-activated protein kinase,AMPK)表达,促进肌肉葡萄糖氧化和ATP生成。
肥胖时内脏脂肪TRPV1表达下降,激活TRPV1可增加棕色脂肪去乙酰化酶Sirt-1的磷酸化和表达,促进能量代谢,抑制高脂诱导的肥胖[8]。笔者的研究表明,激活TRPV1抑制高脂诱导的脂肪合成和棕色脂肪白色化,其机制与线粒体去乙酰化酶Sirt-3活化有关[13]。此外,激活胃肠道TRPV1通过支配胃肠道神经促进棕色脂肪产热[14]。胰岛素的缺乏和(或)抵抗是导致糖尿病的主要病因,胰岛素β细胞有辣椒素敏感的感觉神经纤维分布,激活TRPV1可增加β细胞内钙离子,从而促进胰岛素释放[15]。对1型糖尿病,辣椒素刺激神经元的TRPV1释放P物质和降钙素基因相关肽等神经递质,促进β细胞的神经源性炎症反应,加重糖尿病及其并发症[16],应予TRPV1拮抗剂干预,而对2型糖尿病,辣椒素激活代谢组织的TRPV1可改善糖脂代谢及高血糖所致的内皮功能损害和糖尿病肾病[17]。在骨骼肌,辣椒素激活TRPV1促进肌肉脂肪酸氧化和PGC-1α表达,增加运动耐力与肌肉能量代谢[12],其改善肌肉的葡萄糖氧化及ATP生成与胰岛素信号通路无关[18]。非酒精性脂肪肝与糖脂代谢紊乱关系密切,辣椒素激活肝脏TRPV1可以拮抗高脂诱导的脂肪肝及肝脏炎症反应,这与膳食辣椒素增加肝脏UCP2表达,促进肝脏磷酸化激素敏感脂肪酶、肉碱棕榈酰转移酶1和PPARδ增加肝脏脂质分解和肝细胞自噬相关蛋白的表达有关[11]。总之,TRPV1除感知温度外,对糖脂代谢也有重要影响,TRPV1功能异常可导致糖脂代谢紊乱,而辣椒素激活TRPV1可改善代谢异常(图1)。
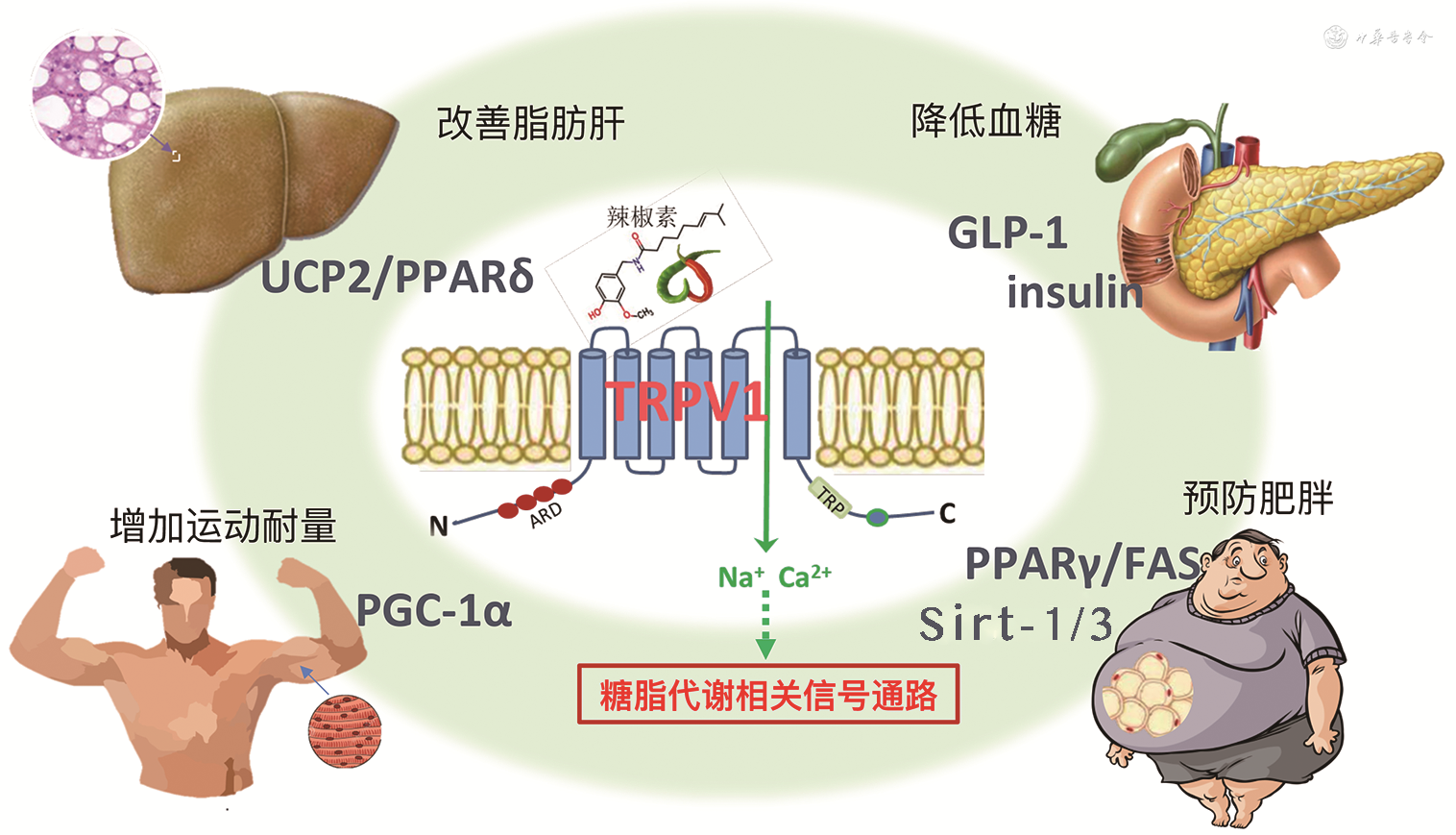

注:TRPV1为瞬时受体电位香草酸亚家族成员1;UCP2为解耦蛋白2;PPARδ为过氧化物酶体增殖物激活受体δ;GLP-1为胰高糖素样肽-1;insulin为胰岛素;PGC-1α为过氧化物酶体增殖物激活受体γ共激活因子-1α;PPARγ为过氧化物酶体增殖物激活受体γ;FAS为脂肪酸合酶;Sirt-1/3为去乙酰化酶1/3
基础研究结果显示,辣椒素激活TRPV1能改善糖脂代谢紊乱,但目前研发的一系列TRPV1的激动剂或拮抗剂主要用于镇痛,改变体温是其主要不良反应。人群研究显示辣膳食可改善糖脂代谢,这可能与辣椒素及其衍生物的主要活性成分辣椒素激活TRPV1有关[19]。一项近50万的人群研究发现,辛辣食物摄入与中国成年人群肥胖存在地区差异,在食辣地区的肥胖风险减少[20]。一项荟萃分析表明食辣可增加能量消耗(245 kJ/d),减少能量摄入(309.9 kJ/d),增加脂肪氧化,从而减轻体重。辣椒素类似物摄入可激活人体棕色脂肪功能增加能量代谢,从而降低体重[21]。多项研究显示辣膳食能减少体脂,增加血5-羟色胺[22]。
China Kadoorie Biobank研究显示,食用辛辣食物的频率与发生糖尿病风险呈负相关[23],食辣者可增加胰岛素的敏感性[24]。经常食辣可改善妊娠糖尿病患者餐后高血糖和高胰岛素血症,降低巨大胎儿的风险[25]。此外,国内外人群调查均显示辣膳食与酒精性脂肪肝呈负相关[26],常食辣者还可降低患肌少症的风险,增加握力及改善肠道菌群[27, 28]。这些人群研究的结果进一步佐证了辣椒素改善糖脂代谢的基础研究发现,也为辣膳食的推广应用提供了人群依据。目前,生酮饮食、轻断食等各种膳食疗法尝试用于防治肥胖和糖尿病,如能在前瞻性临床试验中进一步验证辣膳食对糖脂代谢的益处,则将提供一种低成本、易于推广的防治代谢病的新措施。
综上所述,TRPV1的发现不仅揭示了机体感知温度和痛觉的原理,也丰富了人们对TRPV1在非神经领域作用的认识,尤其是TRPV1对糖脂代谢的调控作用[29],为代谢病的防治提供了新的干预途径。
所有作者均声明不存在利益冲突



























