动脉粥样硬化性心血管疾病(ASCVD)是2型糖尿病(T2DM)患者重要的伴发疾病,也是其致死和致残的主要原因。近年来,随着心血管结局研究(CVOT)证据的不断积累,胰高糖素样肽-1受体激动剂(GLP-1RA)在各大指南中的地位不断提升。大量研究表明,GLP-1RA可以通过多种途径发挥心脑血管保护作用。笔者对GLP-1RA心血管获益的可能机制及其循证证据进行了系统梳理分析,旨在深入理解GLP-1RA在T2DM患者高血糖管理和ASCVD防治中的作用。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
中国慢性病及其危险因素的监测结果显示,中国成人糖尿病患病率已从2013年的10.9%增加至2018年的12.4%[1]。动脉粥样硬化性心血管疾病(atherosclerotic cardiovascular disease,ASCVD)是2型糖尿病(type 2 diabetes mellitus,T2DM)患者的主要致死和致残病因,国外研究报道,一半以上的T2DM患者死亡和心血管并发症相关[2]。中国Kadoorie生物样本库协作组数据显示,糖尿病人群的心血管死亡风险是非糖尿病人群的2.1倍,心血管死亡占中国糖尿病人群总死因的43.2%[3]。大庆研究23年随访资料也显示,中国糖尿病患者中有47.5%的男性和49.7%的女性死于心血管疾病(cardiovascular disease,CVD)[4]。
近年来,随着以胰高糖素样肽-1受体激动剂(glucagon-like peptide-1 receptor agonist,GLP-1RA)为代表的新型降糖药物心血管结局试验(cardiovascular outcome trial,CVOT)证据的不断积累,糖尿病合并CVD或心血管高风险患者的管理正向着进一步降低主要心血管不良事件(major adverse cardiovascular event,MACE)风险、降低心血管和全因死亡风险的目标转变。GLP-1RA在各大指南中的地位也不断提升。《中国成人2型糖尿病合并心肾疾病患者降糖药物临床应用专家共识》推荐,对于T2DM合并ASCVD或心血管风险极高危患者,不论糖化血红蛋白(glycated hemoglobin A1c,HbA1c)是否达标,都建议在二甲双胍的基础上优先联合具有心血管获益证据的GLP-1RA或钠-葡萄糖共转运蛋白2抑制剂(sodium-glucose cotransporter 2 inhibitor,SGLT2i)[5]。2022年美国糖尿病学会(American Diabetes Association,ADA)指南推荐:对于合并ASCVD或心血管高危因素的T2DM患者,可选择已证实有心血管获益的GLP-1RA或SGLT2i作为起始治疗方案,无须考虑HbA1c水平或二甲双胍的使用[6]。大量研究表明,GLP-1RA可以通过多种途径发挥心脑血管保护作用。笔者对GLP-1RA心血管获益的可能机制及其循证证据进行了系统梳理分析。
1.改善心肌缺血:基础和临床研究结果均显示,GLP-1RA可以保护心肌细胞的缺血再灌注损伤,改善心肌缺血状态,减少心肌梗死面积。1项纳入172例急性心肌梗死患者的临床试验结果显示,在再灌注时(介入治疗前15 min至介入治疗后6 h)给予艾塞那肽可以提高心肌挽救率,减少心肌梗死面积[7]。另1项纳入了96例急性心肌梗死患者的研究证实,利拉鲁肽可以改善心肌梗死后的心肌挽救率和梗死面积,提高左心室射血分数,其机制可能与减少再灌注损伤有关[8]。基础研究结果也证明,GLP-1RA在急性心肌梗死的实验模型中可以减少坏死面积、改善左室功能[9]。其机制可能与GLP-1RA增加心肌细胞对葡萄糖的摄取、改善心脏能量代谢有关[10]。
2.保护心肌细胞:心肌细胞凋亡与CVD的发生发展密切相关,也是糖尿病心肌病的重要发病机制之一。细胞实验显示,GLP-1RA可通过抑制晚期糖基化终产物受体的表达来减轻高糖诱导的心肌细胞凋亡[11]。不同基础研究亦证实,艾塞那肽、利拉鲁肽、司美格鲁肽可能通过激活Epac-1/Akt通路、AMPK通路、诱导mTOR依赖性自噬来减轻高糖诱导的心肌细胞损伤,显著提高心肌细胞存活率,改善心肌形态学变化[12, 13, 14]。
1.改善内皮功能障碍:内皮功能障碍是动脉粥样硬化发生的重要机制。GLP-1RA一方面可以调节血管张力,维持内皮屏障的稳定性;另一方面可以通过抗黏附和抗血栓作用保护内皮功能。离体试验证实,艾塞那肽通过激活胰高糖素样肽-1(glucagon-like peptide-1,GLP-1)受体依赖的AMPK通路,在内皮细胞中诱导内皮型一氧化氮合酶活化和一氧化氮生成,抑制高糖和高脂诱导的人小动脉内皮功能障碍,改善糖尿病患者餐后的内皮功能[15]。还有研究者探讨了GLP-1RA改善内皮功能障碍、延缓动脉粥样硬化进展的分子机制,包括晚期糖基化终产物和晚期糖基化终产物受体信号通路[16]、抑制血管内皮细胞纤溶酶原激活物抑制剂-1和细胞间黏附分子-1活性[17]、抑制内皮-间质转化[18]等。在临床试验中,对T2DM患者和正常血糖对照组进行高糖钳夹试验,通过评估血流介导的血管舒张功能证实了GLP-1能改善内皮功能[19]。
2.抑制炎症反应:炎症反应是CVD和动脉粥样硬化病理生理的重要组成部分。临床前研究表明,GLP-1RA可以抑制血管内单核细胞和巨噬细胞浸润,减少高血糖小鼠主动脉表面的脂质沉积和斑块体积[20]。利拉鲁肽通过下调ACAT1表达抑制巨噬细胞源性泡沫细胞形成,延缓动脉粥样硬化进展[21]。Chaudhuri等[22]在24例糖尿病患者中证实艾塞那肽在细胞水平和分子水平上具有抗炎作用,经过12周治疗后,活性氧生成减少,包括JNK-1、单核趋化蛋白1、基质金属蛋白酶9等系列炎症因子水平显著下降。其他学者也在T2DM患者中证实,GLP-1RA治疗后巨噬细胞活化分子水平下降,炎症因子肿瘤坏死因子-α、白细胞介素-1β、白细胞介素-6水平下降,具有抗炎作用的脂联素水平升高[23]。GLP-1RA除降低活性氧水平、降低黏附分子聚集从而减少斑块形成、维持斑块稳定性外,还可通过降低全身炎症水平,降低脂质堆积从而减少斑块形成[24]。
3.抑制血管平滑肌细胞增殖:血管平滑肌细胞增殖是动脉粥样硬化形成的细胞病理基础之一。利拉鲁肽通过增强AMPK通路、调节细胞周期进程来抑制血管平滑肌细胞增殖,延缓动脉粥样硬化进展[25]。利拉鲁肽可通过下调心肌蛋白、抑制核因子-κB通路、激活蛋白激酶A信号通路来抑制晚期糖基化终产物诱导的血管平滑肌细胞表型转换,增加血管平滑肌细胞收缩标记物的表达,减少胶原蛋白的生成[26]。
4.抑制血小板聚集、抗血栓形成:艾塞那肽可显著抑制凝血酶、ADP和胶原诱导的血小板聚集,预防血栓形成[27]。利拉鲁肽可激活血小板中GLP-1受体,通过环磷酸腺苷依赖性蛋白激酶机制减少微血管血栓形成,抑制全身炎症反应,预防血管功能障碍[28]。有研究者认为,天然、完整的GLP-1是生理流动条件下血栓生长的天然抑制剂,其抑制血小板聚集的作用不依赖于血小板上的GLP-1受体[29]。
1.GLP-1RA对血压的影响:高血压是CVD的重要危险因素之一。在高血压小鼠模型中和糖尿病临床试验中均可观察到GLP-1RA的降压作用。Ⅲ期临床研究显示,利拉鲁肽1.2、1.8 mg/d单药治疗可以分别使T2DM患者收缩压降低2.1、3.6 mmHg(1 mmHg=0.133 kPa)[30];度拉糖肽0.75、1.50 mg/周单药治疗可分别使T2DM患者收缩压降低2.6、1.9 mmHg[31]。Meta分析显示,GLP-1RA可使T2DM患者收缩压降低2.856 mmHg,舒张压降低0.898 mmHg[32]。基础研究表明,GLP-1RA通过促进心房心肌细胞分泌心房钠尿肽、抑制血管炎症反应、增加一氧化氮水平等途径发挥降压作用[24,33, 34]。
2.GLP-RA的降脂、减重作用:GLP-1RA的减重效应已通过多个大型临床试验结果得到证实,其通过抑制下丘脑食欲中枢、延缓胃排空来减少食物摄入,从而改善血脂水平、减少内脏脂肪并降低体重[35],并可调节脂肪重新分布,增加静息状态下能量消耗,降低血液中游离脂肪酸水平,改善胰岛素抵抗[36]。Meta分析显示,与安慰剂相比,GLP-1RA可使T2DM患者体重下降达1.34 kg,体重指数下降1.10 kg/m2,腰围缩小1.28 cm[37];加用GLP-1RA治疗可使超重或肥胖的T2DM患者体重下降2.8 kg[38]。
根据分子结构和药代动力学的不同,GLP-1RA类药物包括以Exendin-4为有效成分的艾塞那肽和利司那肽,以人源性GLP-1为结构基础的贝那鲁肽和利拉鲁肽,以及延长作用时间的周制剂阿必鲁肽、度拉糖肽、司美格鲁肽、洛塞那肽和艾塞那肽周制剂,其中阿必鲁肽已于2018年因商业原因退市。
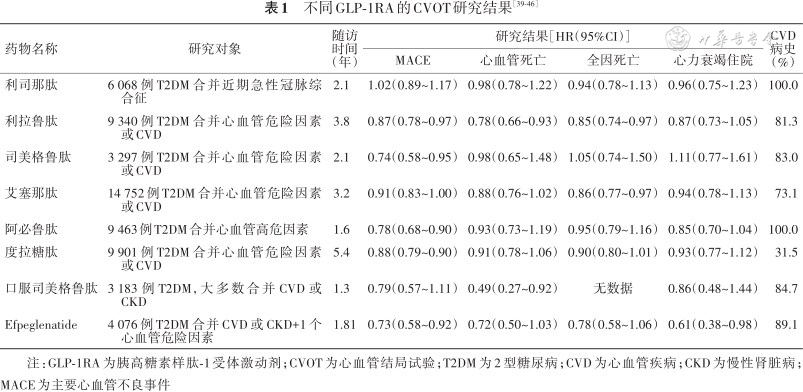
2010年以来,针对新上市的GLP-1RA已完成了8项多国家、多中心的长期CVOT研究,包括ELIXA研究(利司那肽)[39]、LEADER研究(利拉鲁肽)[40]、SUSTAIN-6研究(司美格鲁肽周制剂)[41]、EXSCEL研究(艾塞那肽)[42]、Harmony研究(阿必鲁肽)[43]、REWIND研究(度拉糖肽)[44]、PIONEER-6研究(口服司美格鲁肽)[45]和AMPLITUDE O研究(Efpeglenatide)[46],这些CVOT研究证实了GLP-1RA具有多重心血管保护效应(表1)。在标准治疗基础上,加用利司那肽(20 μg/d)对于近期曾发生过急性冠脉综合征的T2DM患者的MACE结局无影响[39];加用利拉鲁肽(1.8 mg/d)治疗可使已确诊CVD或伴有心血管危险因素的T2DM患者的MACE(心血管死亡、非致死性心肌梗死、非致死性卒中的复合终点)事件风险显著下降13%,心血管死亡风险显著下降22%,全因死亡风险显著下降15%[40];加用司美格鲁肽0.5或1.0 mg(1次/周)可显著降低MACE发生风险达26%,降低非致死性卒中风险达39%[41];加用艾塞那肽周制剂2 mg(1次/周)对于合并CVD或伴心血管危险因素的T2DM患者的心血管效应为中性[42];加用阿必鲁肽可使主要复合终点发生率降低22%[43];加用度拉糖肽1.5 mg(1次/周)可使伴有心血管危险因素或已确诊CVD的T2DM患者的MACE风险显著下降12%,非致死性卒中风险显著下降24%[44];口服司美格鲁肽(14 mg/d)不增加MACE风险,心血管死亡风险降低51%[45];加用4或6 mg(1次/周)Efpeglenatide可使MACE发生风险降低27%[46]。
| 药物名称 | 研究对象 | 随访 时间 (年) | 研究结果[HR(95%CI)] | CVD 病史 (%) | |||
|---|---|---|---|---|---|---|---|
| MACE | 心血管死亡 | 全因死亡 | 心力衰竭住院 | ||||
| 利司那肽 | 6 068例T2DM合并近期急性冠脉综合征 | 2.1 | 1.02(0.89~1.17) | 0.98(0.78~1.22) | 0.94(0.78~1.13) | 0.96(0.75~1.23) | 100.0 |
| 利拉鲁肽 | 9 340例T2DM合并心血管危险因素或CVD | 3.8 | 0.87(0.78~0.97) | 0.78(0.66~0.93) | 0.85(0.74~0.97) | 0.87(0.73~1.05) | 81.3 |
| 司美格鲁肽 | 3 297例T2DM合并心血管危险因素或CVD | 2.1 | 0.74(0.58~0.95) | 0.98(0.65~1.48) | 1.05(0.74~1.50) | 1.11(0.77~1.61) | 83.0 |
| 艾塞那肽 | 14 752例T2DM合并心血管危险因素或CVD | 3.2 | 0.91(0.83~1.00) | 0.88(0.76~1.02) | 0.86(0.77~0.97) | 0.94(0.78~1.13) | 73.1 |
| 阿必鲁肽 | 9 463例T2DM合并心血管高危因素 | 1.6 | 0.78(0.68~0.90) | 0.93(0.73~1.19) | 0.95(0.79~1.16) | 0.85(0.70~1.04) | 100.0 |
| 度拉糖肽 | 9 901例T2DM合并心血管危险因素或CVD | 5.4 | 0.88(0.79~0.90) | 0.91(0.78~1.06) | 0.90(0.80~1.01) | 0.93(0.77~1.12) | 31.5 |
| 口服司美格鲁肽 | 3 183例T2DM,大多数合并CVD或CKD | 1.3 | 0.79(0.57~1.11) | 0.49(0.27~0.92) | 无数据 | 0.86(0.48~1.44) | 84.7 |
| Efpeglenatide | 4 076例T2DM合并CVD或CKD+1个心血管危险因素 | 1.81 | 0.73(0.58~0.92) | 0.72(0.50~1.03) | 0.78(0.58~1.06) | 0.61(0.38~0.98) | 89.1 |
注:GLP-1RA为胰高糖素样肽-1受体激动剂;CVOT为心血管结局试验;T2DM为2型糖尿病;CVD为心血管疾病;CKD为慢性肾脏病;MACE为主要心血管不良事件
需要探讨的是,由于研究目的和设计不同、侧重人群不同,各项CVOT研究结果的临床意义也不尽相同。
1.研究设计不同:如SUSTAIN-6研究和PIONEER-6研究是采用非劣效设计以满足上市要求,ELIXA研究和EXSCEL研究是采用非劣效设计以验证药物的心血管安全性,而REWIND研究则是采用优效性设计以验证药物有心血管保护作用。不同的研究设计导致各项CVOT所需的样本量、事件数和研究所需时长有较大差异。
2.纳入人群和患者特征不同:REWIND研究包括了68.5%既往无CVD病史的T2DM患者(即心血管一级预防人群),而Harmony研究100%为既往有CVD或伴有急性冠脉综合征的T2DM患者,ELIXA研究入组180 d内发生过急性冠脉综合征的T2DM患者,这些受试者处于T2DM发展的不同阶段,也在一定程度上导致了研究结果的差异。
3.心血管结局不同:(1)主要终点:ELIXA、EXSCEL和PIONEER-6研究达成了非劣效检验的原始研究目标,未发现研究中的GLP-1RA具有降低CVD风险的获益。LEADER、SUSTAIN-6、REWIND、Harmony和AMPLITUDE O这5项研究显示,与安慰剂相比,利拉鲁肽(13%)、司美格鲁肽(26%)、度拉糖肽(12%)、阿必鲁肽(22%)和Efpeglenatide(27%)治疗组MACE发生率显著降低。(2)全因死亡风险:与安慰剂组比较,LEADER和PIONEER‐6研究中,利拉鲁肽组和口服司美格鲁肽组全因死亡风险均显著降低(分别为15%和49%);而ELIXA、SUSTAIN‐6、Harmony和REWIND研究则显示两组全因死亡风险无显著差异。(3)心血管死亡风险:LEADER和PIONEER-6研究显示,应用利拉鲁肽、口服司美格鲁肽可使T2DM患者心血管死亡风险显著降低(分别为22%和51%)。(4)非致死性心肌梗死风险:SUSTAIN-6和Harmony研究显示,应用司美格鲁肽、阿必鲁肽可使非致死性心肌梗死发生风险降低(分别为26%和25%)。(5)非致死性卒中风险:SUSTAIN-6和REWIND研究中,应用司美格鲁肽和度拉糖肽分别使非致死性卒中风险降低达39%和24%。(6)心力衰竭住院风险:Harmony研究显示,与安慰剂相比,阿必鲁肽可降低29%的心力衰竭住院风险,其余CVOT结果提示GLP-1RA治疗不增加心力衰竭住院风险。
如前所述,不同的试验设计、不同的药物暴露时间、不同的人群基线特征可能导致了CVOT结局的差异。基于Exendin-4结构的Efpeglenatide在AMPLITUDE O研究中使MACE发生风险降低27%[46],此项心血管获益证据提示GLP-1RA心血管效应的差异不能用GLP-1RA的分子结构是否为人源性来解释。
1项纳入了上述8项CVOT研究(共60 080例受试者)数据的荟萃分析显示,GLP-1RA可整体降低MACE发生风险14%(HR为0.86,95%CI为0.80~0.93,P<0.000 1),全因死亡风险降低12%(HR为0.88,95%CI为0.82~0.94,P=0.000 1),因心力衰竭入院的风险降低11%(HR为0.89,95%CI为0.82~0.98,P=0.013)[47]。关于SUSTAIN-6和PIONEER-6研究联合数据的事后分析显示,司美格鲁肽综合降低MACE事件风险24%(HR为0.76,95%CI为0.62~0.92),降低非致死性卒中风险35%(HR为0.65,95%CI为0.43~0.97)[48]。
1.中国人群外推性研究:在上述一系列CVOT研究中,有的研究纳入的受试者全部为CVD患者或以CVD患者为主的人群,而有的研究既包含了CVD患者也包含了具备心血管高危风险、但尚未发生CVD的患者。中国心血管代谢病系列登记(CCMR)-3B研究纳入了全国25 817例门诊T2DM患者,是中国具有代表性的T2DM患者人群,结果表明,我国T2DM患者中一半以上(57.4%)有代谢综合征,72%合并高血压、血脂异常等CVD的高危因素[49]。外推性研究结果显示:(1)在4项GLP-1RA的CVOT研究中,31.1%的CCMR-3B人群符合REWIND研究的纳排标准,符合SUTAIN-6、LEADER和EXSCEL研究纳排标准的人群比例分别为15.04%、12.97%和11.30%;(2)在人群基线数据中,REWIND纳入人群的性别比例、糖尿病病程、HbA1c、舒张压、低密度脂蛋白胆固醇水平、冠心病病史和心肌梗死病史与CCMR-3B人群更为接近;(3)中国外推性研究结果提示,度拉糖肽在CVOT研究中体现的长期心血管获益在中国T2DM人群中均同样适用[50]。
2.其他研究:多项临床研究结果显示,GLP-1RA的心血管保护作用独立于减少低血糖的发生,独立于基线体重指数、血脂水平,独立于降糖、降脂、减重、二甲双胍、他汀类药物和SGLT2i的应用[51, 52, 53]。
糖尿病是卒中和认知功能障碍的共同危险因素。REWIND研究结果显示,在5.4年的中位随访期间,度拉糖肽组卒中风险显著降低(HR为0.76,95%CI为0.60~0.94,P=0.01),其中缺血性卒中风险降低25%(HR为0.75,95%CI为0.59~0.94,P=0.012),对出血性卒中无明显影响,致残性卒中风险降低26%(HR为0.74,95%CI为0.56~0.99,P=0.042),卒中的严重程度在治疗组间无显著差异[54]。针对REWIND研究的进一步探索性分析提示,应用度拉糖肽治疗的T2DM患者的实质性认知障碍风险降低了14%(HR为0.86,95%CI为0.79~0.95,P=0.001 8)[55]。SUSTAIN-6研究中,司美格鲁肽治疗组非致死性卒中风险显著下降39%。利拉鲁肽治疗12周后T2DM患者认知功能有明显改善,且与血糖、血压和体重控制无关[56]。1项纳入7个CVOT研究(56 004例患者)的荟萃分析提示,使用GLP-1RA治疗的T2DM患者卒中总风险降低16%,非致死性卒中风险降低15%,而卒中风险降低与HbA1c水平改善或体重下降无关[57]。
GLP-1RA对脑血管和神经保护的机制,可能与其增加微血管血流量、减少氧化应激、增加NO生成、抑制动脉粥样硬化形成、调节血脑屏障通透性、减少脑水肿和细胞凋亡、促进神经细胞存活、减少脑梗死面积等有关[58, 59, 60]。《中国脑卒中防治指导规范(2021版)》推荐,有心血管危险因素的T2DM患者应用GLP-1RA可以减少心血管事件(包括卒中)的发生;对于卒中/短暂性脑缺血发作的T2DM患者,如降血糖治疗方案为两药联合治疗或多种药物联合治疗且HbA1c已达标,可考虑将其中一种药物换为GLP-1RA或SGLT2i[61]。
综上,大量研究结果证实:GLP-1RA在安全有效降糖的同时,还可以通过多种途径发挥心脑血管保护作用。基于基础和临床研究证据,GLP-1RA在各大指南中的地位不断提升,其临床应用范围逐渐拓展。GLP-1RA的非降糖作用对CVD多效性影响的研究正日益深入,未来GLP-1RA在内分泌科、心血管内科及神经内科的交叉合作领域具有前景。
所有作者声明无利益冲突