
回顾性分析西安交通大学第一附属医院收治的1例长病程、超重2型糖尿病患者使用胰岛素泵强化治疗方案,加用二甲双胍、达格列净及利拉鲁肽,在持续葡萄糖监测辅助下快速平稳降糖并实现方案转换的过程。患者女性,49岁,以“血糖升高20年,控制不佳1年余”为主诉入院。院前应用地特胰岛素10 U每晚1次皮下注射联合门冬胰岛素10、8、8 U三餐前皮下注射,入院糖化血红蛋白12.9%。入院后予以胰岛素泵强化治疗并行持续葡萄糖监测。全天胰岛素泵佩戴期间每日最大胰岛素总量为54 U,血糖控制后加用二甲双胍片(500 mg,4次/d)联合达格列净(10 mg,1次/d)和利拉鲁肽(0.6 mg,皮下注射,1次/d)治疗,胰岛素迅速减量至停用。二甲双胍片、达格列净、利拉鲁肽联合方案可减少患者胰岛素用量、带来心血管获益并有显著减重疗效,值得推广。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
对于初诊或病程长、血糖控制不佳的2型糖尿病(type 2 diabetes mellitus,T2DM)患者,胰岛素强化治疗是目前常规治疗手段。临床中使用持续皮下胰岛素输注(continuous subcutaneous insulin infusion,CSII)和持续葡萄糖监测系统(continuous glucose monitoring system,CGMS)配合的“双C”疗法[1],可通过全面了解患者的血糖情况,从而精准调整胰岛素泵中胰岛素剂量,使血糖平稳快速达标,缩短住院时间。强化后需根据患者并发症及合并症情况,进行个体化方案选择。我们报道1例长期血糖控制不达标的T2DM患者,入院使用“双C”疗法,转化期间使用利拉鲁肽与胰岛素泵进行剂量调整,入院10 d血糖从居高不下,到快速、平稳血糖达标,为优化此类患者的治疗提供参考。
患者 女,49岁。以“血糖升高20年,控制不佳1年余”入院。20年前体检发现血糖升高,空腹血糖8.0 mmol/L,餐后血糖12 mmol/L,诊断“T2DM”,口服二甲双胍,血糖控制尚可。5年前因心肌炎后换用精蛋白生物合成人胰岛素注射液(预混30R)10、8 U早晚餐前皮下注射,测空腹血糖6~7 mmol/L,餐后血糖11.0 mmol/L。2年前因血糖控制不佳换用四针方案。近1年使用地特胰岛素10 U睡前,门冬胰岛素10、8、8 U三餐前皮下注射,多次测空腹血糖8~12 mmol/L,餐后血糖14~16 mmol/L。近1周空腹血糖14.0~15.6 mmol/L,餐后血糖13.0~16.4 mmol/L,近1年体重增加5 kg,为进一步诊治,门诊以“T2DM”收住院。入院查体:体温36.5 ℃,心率90 次/min,呼吸20 次/min,血压130/74 mmHg(1 mmHg=0.133 kPa),身高169 cm,体重79 kg,体重指数27.7 kg/m2。神志清,精神可,心、肺、腹查体未见显著异常,双下肢无水肿,双侧病理征阴性。辅助检查:空腹血糖9.80 mmol/L,空腹胰岛素10.69 mmol/L,空腹C肽1.82 ng/ml。糖化血红蛋白12.9%。尿白蛋白/肌酐比值14.77 mg/g。总胆固醇5.27 mmol/L,甘油三酯2.78 mmol/L,低密度脂蛋白胆固醇3.59 mmol/L。颈部血管超声:双侧颈动脉粥样斑块形成。眼底照相、肌电图及尿白蛋白/肌酐比值未见异常。甲状腺B超未见异常。入院诊断:(1)T2DM、糖尿病周围血管病变;(2)高脂血症。入院治疗经过:入院前已经“三短一长”治疗2年,近1年血糖控制不佳,入院后予以CSII强化降糖治疗并行CGM。因患者存在糖尿病周围血管病变,同时体重指数>24 kg/m2,故入院第4天起加用利拉鲁肽、二甲双胍及达格列净协助降糖治疗(“221”方案),此后据每日血糖逐步减少胰岛素剂量并直至停用(表1)。同时患者血糖均值及血糖变异系数(coefficient of variation,CV)减少,葡萄糖在目标范围内时间(time in range,TIR)增加,葡萄糖高于目标范围内时间(time above range,TAR)减少(表2)。整个住院期间血糖控制较好且低血糖风险低(TIR为93.9%、TAR为6%及葡萄糖低于目标范围内时间为0.1%)。比较各治疗阶段每日血糖图谱,加用“221”方案后餐后血糖改善显著,血糖波动减少,控制血糖有效达标。出院时患者血糖达标,体重减轻2 kg。出院后继续利拉鲁肽1.2 mg/d皮下注射,达格列净10 mg/d,二甲双胍片500 mg早餐前、睡前口服协助降糖治疗,血糖控制达标(表2)。随诊时血糖达标,目前继续上述治疗方案。
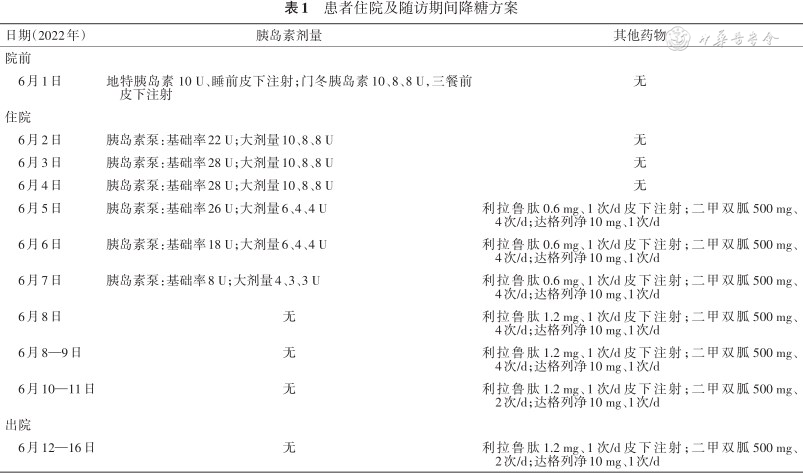
患者住院及随访期间降糖方案
患者住院及随访期间降糖方案
| 日期(2022年) | 胰岛素剂量 | 其他药物 |
|---|---|---|
| 院前 | ||
| 6月1日 | 地特胰岛素 10 U、睡前皮下注射;门冬胰岛素10、8、8 U,三餐前皮下注射 | 无 |
| 住院 | ||
| 6月2日 | 胰岛素泵:基础率22 U;大剂量10、8、8 U | 无 |
| 6月3日 | 胰岛素泵:基础率28 U;大剂量10、8、8 U | 无 |
| 6月4日 | 胰岛素泵:基础率28 U;大剂量10、8、8 U | 无 |
| 6月5日 | 胰岛素泵:基础率26 U;大剂量6、4、4 U | 利拉鲁肽0.6 mg、1次/d皮下注射;二甲双胍500 mg、4次/d;达格列净10 mg、1次/d |
| 6月6日 | 胰岛素泵:基础率18 U;大剂量6、4、4 U | 利拉鲁肽0.6 mg、1次/d皮下注射;二甲双胍500 mg、4次/d;达格列净10 mg、1次/d |
| 6月7日 | 胰岛素泵:基础率8 U;大剂量4、3、3 U | 利拉鲁肽0.6 mg、1次/d皮下注射;二甲双胍500 mg、4次/d;达格列净10 mg、1次/d |
| 6月8日 | 无 | 利拉鲁肽1.2 mg、1次/d皮下注射;二甲双胍500 mg、4次/d;达格列净10 mg、1次/d |
| 6月8—9日 | 无 | 利拉鲁肽1.2 mg、1次/d皮下注射;二甲双胍500 mg、4次/d;达格列净10 mg、1次/d |
| 6月10—11日 | 无 | 利拉鲁肽1.2 mg、1次/d皮下注射;二甲双胍500 mg、2次/d;达格列净10 mg、1次/d |
| 出院 | ||
| 6月12—16日 | 无 | 利拉鲁肽1.2 mg、1次/d皮下注射;二甲双胍500 mg、2次/d;达格列净10 mg、1次/d |
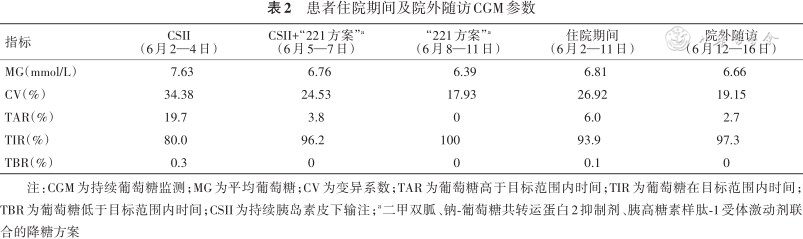
患者住院期间及院外随访CGM参数
患者住院期间及院外随访CGM参数
| 指标 | CSII (6月2—4日) | CSII+“221方案”a (6月5—7日) | “221方案”a (6月8—11日) | 住院期间 (6月2—11日) | 院外随访 (6月12—16日) |
|---|---|---|---|---|---|
| MG(mmol/L) | 7.63 | 6.76 | 6.39 | 6.81 | 6.66 |
| CV(%) | 34.38 | 24.53 | 17.93 | 26.92 | 19.15 |
| TAR(%) | 19.7 | 3.8 | 0 | 6.0 | 2.7 |
| TIR(%) | 80.0 | 96.2 | 100 | 93.9 | 97.3 |
| TBR(%) | 0.3 | 0 | 0 | 0.1 | 0 |
注:CGM为持续葡萄糖监测;MG为平均葡萄糖;CV为变异系数;TAR为葡萄糖高于目标范围内时间;TIR为葡萄糖在目标范围内时间;TBR为葡萄糖低于目标范围内时间;CSII为持续胰岛素皮下输注;a二甲双胍、钠-葡萄糖共转运蛋白2抑制剂、胰高糖素样肽-1受体激动剂联合的降糖方案
本文我们回顾了1例病史20年,胰岛素治疗5年、入院前显著高血糖状态的T2DM患者。为了尽快解除高糖毒性,入院初应用CSII强化降糖,后续依据并发症及减重需求加用利拉鲁肽、达格列净及二甲双胍降糖。与传统指血测定相比,CGM可以提供更全面的血糖信息,发现不易被传统监测方法所检测到的高血糖和低血糖[2],为治疗方案调整及药物剂量调整提供准确的临床依据[3]。在强化降糖及治疗调整期间,我们根据CGM调整胰岛素泵剂量。住院期间完成方案转换,血糖平稳、安全达标,患者治疗满意度高。
胰高糖素样肽-1(glucagon-like peptide-1,GLP-1)是一种肠促胰素,半衰期不足2 min,分泌入血后迅速被二肽基肽酶Ⅳ降解并被肾小球滤过清除[4]。GLP-1受体激动剂(GLP-1 receptor agonist,GLP-1RA)则通过激活GLP-1受体,以葡萄糖浓度依赖的方式增强胰岛素分泌,抑制胰高糖素分泌,延缓胃排空,并可通过中枢性的食欲抑制减少进食量,从而发挥降低血糖作用,尤其以降低餐后血糖为主,并可进一步减少血糖波动性[5]。同时,有研究报道利拉鲁肽联合胰岛素可使胰岛素剂量减少66%[6]。因此,我们加用利拉鲁肽后胰岛素迅速减量,在出院前停用。同时从CGM每日图谱可见,加用利拉鲁肽后患者餐后血糖以及TAR明显改善、日内血糖波动减少。
从远期获益角度,由于GLP-1RA可降低主要心血管不良事件,美国糖尿病学会及欧洲心脏病学会均把GLP-1RA作为合并动脉硬化性心血管疾病(atherosclerotic cardiovascular disease,ASCVD)的二联治疗的首选[7, 8]。我国《中国2型糖尿病防治指南(2020年版)》[9]也指出,合并ASCVD或心血管风险高危的T2DM患者,不论HbA1c是否达标,都应加用具有ASCVD获益证据的GLP-1RA或钠-葡萄糖共转运蛋白2抑制剂(sodium-glucose cotransporter 2 inhibitor,SGLT2i)。而GLP-1RA中的利拉鲁肽在改善胰岛素抵抗和糖脂代谢中发挥重要作用[10],并且能促进β细胞增殖和减少凋亡、改善胰岛功能[11]。除外心血管获益,利拉鲁肽显著的减重优势也是我们选择该药物的原因[6]。
针对超重或肥胖T2DM患者,可优先选用具有减重作用的降糖药物,打破不良代谢循环,改善糖尿病不良结局,在治疗时可采用2种甚至3种不同作用机制的药物联合治疗[9],目前临床常用的有二甲双胍、SGLT2i和GLP-1RA,即“221”方案。其中,二甲双胍作为治疗T2DM一线药物,其本身通过抑制内源性葡萄糖的生成,增加外周组织对葡萄糖摄取、抑制食欲、增加胰岛素敏感性等作用发挥降糖作用,也具有减轻体重的作用。SGLT2i通过抑制肾脏对葡萄糖的重吸收,增加葡萄糖在尿液中的排泄来达到降低血糖的目的,降糖同时亦有减重效果。连同GLP-1RA,三种药物机制互补,协同降糖、减重效果显著。
综上所述,“双C”治疗作为一种“人工胰岛”的前身,对T2DM强化治疗效果明显;而长期方案治疗选用“221”方案兼顾降糖、减重和心血管远期获益;CGM则全面提供血糖信息,有助降糖方案平稳转换,值得临床推广。
所有作者声明无利益冲突



























