
报道1例在中国人民解放军联勤保障部队第九八八医院内分泌中医科就诊的新诊断的2型糖尿病患者使用胰岛素泵强化治疗后,转换为利拉鲁肽序贯治疗的诊疗过程并进行文献复习。患者为30岁男性,体型肥胖,因“口渴、多饮、多尿、消瘦1个月”为主诉收入住院,入院后完善相关检查,明确诊断为2型糖尿病(T2DM)。予胰岛素泵联合口服降糖药物治疗,后调整为利拉鲁肽(0.6 mg,1次/d)皮下注射,联合地特胰岛素(22 U,1次/d)睡前皮下注射,14 d后血糖控制平稳且达标。利拉鲁肽是一种新型的胰高糖素样肽-1类似物,能够在控制血糖的同时减轻体重,同时增加胰岛素敏感性,可作为单一疗法或与其他降糖药物联合使用来治疗T2DM。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
利拉鲁肽是一种新型的胰高糖素样肽-1(glucagon-like peptide-1,GLP-1)类似物,不仅能够控制血糖,还能够减轻体重,尤其适合肥胖型2型糖尿病(type 2 diabetes mellitus,T2DM)患者。同时利拉鲁肽还可增加胰岛素的敏感性,可作为单一疗法或与其他降糖药物联合使用来治疗T2DM。现报道1例新诊断的T2DM患者使用胰岛素强化治疗后,转换为利拉鲁肽联合地特胰岛素皮下注射治疗的诊疗经过,期望为临床同类患者的治疗提供参考。
患者 男,30岁,因“口渴、多饮、多尿、消瘦1个月”为主诉收入住院。患者1个月前无明显诱因出现口渴、多饮(每天约3 000 ml)、多尿(每天约3 000 ml)、消瘦(体重近1个月下降12 kg),无视物模糊,无四肢麻木疼痛不适,无间歇性跛行,无发热、咳嗽、咳痰,无胸闷、气短,无腹痛、腹泻等不适,就诊于我院,查糖化血红蛋白(glycated hemoglobin A1c,HbA1c)12.87%(参考值4.0%~6.0%),糖耐量试验及C肽释放试验结果见表1,为求进一步诊治,门诊以糖尿病收入我科。自患病以来,患者精神、饮食、睡眠可。既往有高血压病史3年,血压最高220/180 mmHg(1 mm Hg=0.133 kPa),平素口服硝苯地平控释片(30 mg,1次/d)、缬沙坦(80 mg,1次/d)治疗,血压控制在(110~160)/(90~110)mmHg之间,高尿酸血症1年,3个月前出现左足跟部肿痛,未予诊治,后自行好转。否认手术史,否认外伤史,否认输血史,对青霉素类、头孢类药物过敏。家族中姥姥、舅舅患有糖尿病,否认高血压、冠心病家族史。
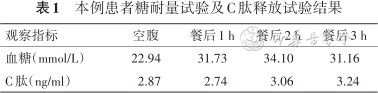
本例患者糖耐量试验及C肽释放试验结果
本例患者糖耐量试验及C肽释放试验结果
| 观察指标 | 空腹 | 餐后1 h | 餐后2 h | 餐后3 h |
|---|---|---|---|---|
| 血糖(mmol/L) | 22.94 | 31.73 | 34.10 | 31.16 |
| C肽(ng/ml) | 2.87 | 2.74 | 3.06 | 3.24 |
入院查体:身高175 cm,体重128 kg,体重指数41.80 kg/cm2,腰围122 cm,臀围131.5 cm,血压140/90 mmHg,神志清、精神可,心脏、肺、腹无明显异常。双下肢无水肿。病理征未引出。双侧足背动脉搏动正常,双下肢痛觉、温度觉、振动觉正常,双侧10 g弹力丝试验阴性。辅助检查结果如下。(1)常规化验:天冬氨酸转氨酶42 U/L(参考值9~50 U/L)、总胆红素30.5 μmol/L(参考值5.1~28.0 μmol/L)、间接胆红素24.4 μmol/L(参考值0~18.0 μmol/L)、胆碱酯酶12 553 U/L(参考值4 620~11 500 U/L),尿酸748 μmol/L(参考值208~428 μmol/L),血脂:甘油三酯5.33 mmol/L(参考值0.23~1.70 mmol/L)、高密度脂蛋白胆固醇0.79 mmol/L(参考值0.90~1.55 mmol/L)、低密度脂蛋白胆固醇2.89 mmol/L(参考值0~3.37 mmol/L),尿常规:葡萄糖4+、酮体3+,电解质、心肌酶谱、感染四项、凝血四项、便常规、血常规未见明显异常。(2)糖尿病相关化验:空腹血糖(fasting plasma glucose,FPG)18.53 mmol/L,尿微量白蛋白76.2 mg/L、尿白蛋白/肌酐比值83.16 mg/g(参考值0~30.00 mg/g),HbA1c 12.87%,糖尿病抗体四项(谷氨酸脱羧酶抗体、胰岛自身抗体、酪氨酸磷酸酶抗体和胰岛细胞抗体)均为阴性。(3)甲状腺相关化验:甲状腺功能未见异常。(4)影像学检查:心电图示窦性心律 T波改变。腹部彩超示脂肪肝(重度)。心脏彩超、甲状腺彩超、颈部动脉血管彩超、双下肢动脉彩超未见异常。眼底检查:双眼屈光不正、双高眼压。双下肢肌电图:左侧胫运动神经、右侧腓浅感觉神经可见波幅降低,提示轻度脱髓鞘样改变,余被检感觉及运动神经传导未见明显异常。
结合病史及检查结果,明确诊断为T2DM。入院后给予胰岛素泵(0:00—3:00用量为0.4 U/h,3:00—9:00用量为0.8 U/h,9:00—12:00用量为0.6 U/h,12:00—16:00用量为0.5 U/h,16:00—20:00用量为0.6 U/h,20:00—24:00用量为0.5 U/h)强化治疗,加用盐酸二甲双胍片(0.5 g,3次/d)口服降糖改善胰岛素抵抗,同时给予补液纠酮,逐步调整胰岛素泵泵速,患者血糖控制较前改善,FPG控制在5.5~7.0 mmol/L之间,餐后2 h血糖在5.6~8.3 mmol/L之间。患者无甲状腺、胰腺炎等疾病病史,无低血糖、终末期肾病,患者无GLP-1禁忌证,降糖方案过渡为利拉鲁肽0.6 mg每天皮下注射1次和地特胰岛素22 U每天睡前皮下注射1次,患者血糖平稳过渡,FPG在5.8~7.1 mmol/L之间,餐后2 h血糖在6.7~8.7 mmol/L之间,14 d后患者血糖控制良好(表2),过程中患者无药物不良反应,体重下降2.5 kg,遵医嘱出院。
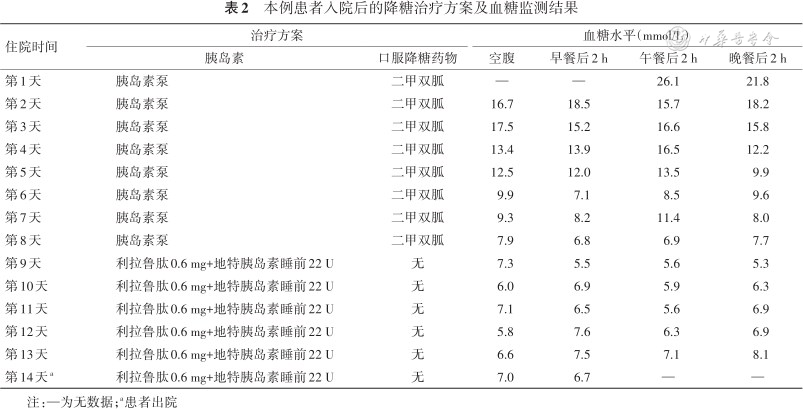
本例患者入院后的降糖治疗方案及血糖监测结果
本例患者入院后的降糖治疗方案及血糖监测结果
| 住院时间 | 治疗方案 | 血糖水平(mmol/L) | ||||
|---|---|---|---|---|---|---|
| 胰岛素 | 口服降糖药物 | 空腹 | 早餐后2 h | 午餐后2 h | 晚餐后2 h | |
| 第1天 | 胰岛素泵 | 二甲双胍 | — | — | 26.1 | 21.8 |
| 第2天 | 胰岛素泵 | 二甲双胍 | 16.7 | 18.5 | 15.7 | 18.2 |
| 第3天 | 胰岛素泵 | 二甲双胍 | 17.5 | 15.2 | 16.6 | 15.8 |
| 第4天 | 胰岛素泵 | 二甲双胍 | 13.4 | 13.9 | 16.5 | 12.2 |
| 第5天 | 胰岛素泵 | 二甲双胍 | 12.5 | 12.0 | 13.5 | 9.9 |
| 第6天 | 胰岛素泵 | 二甲双胍 | 9.9 | 7.1 | 8.5 | 9.6 |
| 第7天 | 胰岛素泵 | 二甲双胍 | 9.3 | 8.2 | 11.4 | 8.0 |
| 第8天 | 胰岛素泵 | 二甲双胍 | 7.9 | 6.8 | 6.9 | 7.7 |
| 第9天 | 利拉鲁肽0.6 mg+地特胰岛素睡前22 U | 无 | 7.3 | 5.5 | 5.6 | 5.3 |
| 第10天 | 利拉鲁肽0.6 mg+地特胰岛素睡前22 U | 无 | 6.0 | 6.9 | 5.9 | 6.3 |
| 第11天 | 利拉鲁肽0.6 mg+地特胰岛素睡前22 U | 无 | 7.1 | 6.5 | 5.6 | 6.9 |
| 第12天 | 利拉鲁肽0.6 mg+地特胰岛素睡前22 U | 无 | 5.8 | 7.6 | 6.3 | 6.9 |
| 第13天 | 利拉鲁肽0.6 mg+地特胰岛素睡前22 U | 无 | 6.6 | 7.5 | 7.1 | 8.1 |
| 第14天a | 利拉鲁肽0.6 mg+地特胰岛素睡前22 U | 无 | 7.0 | 6.7 | — | — |
注:—为无数据;a患者出院
本例患者为30岁男性,急性病程,“三多一少”症状明显,体型肥胖,有糖尿病家族史,HbA1c 12.87%,胰岛功能试验提示胰岛素高峰延迟,糖尿病抗体四项阴性,考虑为T2DM。患者发病时间短,糖尿病酮症起病,C肽水平尚可,可除外1型糖尿病,但需警惕成人隐匿性自身免疫糖尿病可能,该患者糖尿病抗体四项均阴性,暂不考虑该病可能。患者无急慢性胰腺炎、胰腺肿瘤、胰腺切除、腹部外伤、肾上腺疾病等病史,无特殊用药、感染性疾病病史,可除外上述因素导致的特殊类型糖尿病。均符合T2DM特点。
肥胖和T2DM的患病率都在逐年增加,肥胖与T2DM患者的胰岛素抵抗密切相关。2020年中国居民营养与慢性病状况报告统计,中国18岁以上人口超重率和肥胖率分别为34.3%和16.4%[1]。滕卫平教授最新一项流行病学调查结果显示,中国成人糖尿病患病率为12.8%,中国成人糖尿病前期比例高达35.2%,中国大陆糖尿病患者总数估计为1.298亿[2]。目前糖尿病已成为威胁人类健康的最主要的慢性非传染性疾病之一,糖尿病的防治面临巨大的挑战。《中国糖尿病防治指南(2020年版)》建议,对于HbA1c≥9.0%或FPG≥11.1 mmol/L同时伴明显高血糖症状的新诊断T2DM患者,建议实施短期(2周至3个月)胰岛素强化治疗[3]。本例患者发病时HbA1c 12.87%,FPG 22.94 mmol/L且伴有明显“三多一少”症状,入院后即刻给予胰岛素泵强化治疗解除高糖毒性,经过治疗后,患者血糖达标且平稳,但因患者体型肥胖,胰岛素抵抗明显,血糖达标时胰岛素用量较大,且患者难以坚持每日4次胰岛素注射,我们为其调整为地特胰岛素联合利拉鲁肽皮下注射,地特胰岛素剂量与胰岛素泵基础量一致,利拉鲁肽使用起始剂量0.6 mg每日1次皮下注射,患者血糖平稳过渡,且使用过程中血糖达标且平稳,无低血糖发生,体重较入院时减少2.5 kg,效果理想,患者满意。
利拉鲁肽是一种酰化GLP-1类似物,GLP-1是一种内源性肠促胰素,由回肠末端和结肠近端的小肠L细胞在摄入葡萄糖和其他碳水化合物后分泌,主要表达于胰腺、中枢神经系统和胃肠道,也见于心脏、肾脏、血管和周围神经系统[4]。利拉鲁肽与天然GLP-1具有97%的氨基酸同源性,作用时间显著延长,每日1次皮下注射给药,广泛用于T2DM的治疗[5]。与其他GLP-1受体激动剂一样,其与GLP-1受体结合后,可使细胞内环磷酸腺苷水平增加,胰岛β细胞以葡萄糖依赖性方式增加胰岛素的产生,其还可促进胰岛β细胞的存活和增殖。此外,其还可抑制胰岛α细胞分泌胰高糖素,从而减少肝糖原的输出[6]。其他生物学效应包括减缓胃排空、增加餐后饱腹感以及通过干扰中枢神经系统来降低食欲和食物消耗[7]。利拉鲁肽还可降低心血管疾病、肾脏疾病风险以及改善血脂异常[8, 9, 10, 11]。
利拉鲁肽可作为单一疗法或与其他降糖药物联合使用来治疗T2DM,同时具有减重和低血糖发生率低的优点。LEADER各期研究均证实了利拉鲁肽在糖尿病中的作用,在这些研究中,无论是作为单药治疗还是与二甲双胍、格列美脲、罗格列酮或胰岛素联合治疗,利拉鲁肽均可使HbA1c降低0.8%~1.5%[12, 13, 14, 15]。
利拉鲁肽主要通过增加胰岛素分泌和降低胰高糖素水平来改善空腹和餐后血糖,同时具有心肾保护和减重、改善胰岛素抵抗的作用。值得注意的是,利拉鲁肽也可能会引起胃肠道反应(恶心、呕吐、消化不良等)、免疫反应等不良反应,在孕妇及哺乳期等特殊人群中还没有充足的研究。临床上降糖药物种类有很多,还有源源不断的新药在研发,我们在临床选择降糖药物时要结合患者病程、胰岛功能、年龄、职业等因素,制定个性化的方案,才能提高患者依从性和血糖达标率。
所有作者声明无利益冲突



























