
胰岛素抵抗是常见的临床现象,是肥胖、糖尿病等多种疾病的共同病理生理基础。该文简要介绍了胰岛素抵抗和胰岛素抵抗综合征的历史、胰岛素抵抗的机制和管理策略。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
胰岛素抵抗不仅是2型糖尿病、非酒精性脂肪性肝病、动脉粥样硬化性心血管疾病、多囊卵巢综合征等多种代谢相关疾病的“共同土壤”,还是一些少见病和罕见病的病理生理学基础。本文对胰岛素抵抗和胰岛素抵抗综合征的概念、历史、机制和管理作简要介绍,以期增进临床医师对胰岛素抵抗及相关问题的认识,并提高胰岛素抵抗和胰岛素抵抗综合征的管理水平。
胰岛素抵抗目前尚无统一而严谨的定义。我们可从胰岛素剂量-反应曲线来理解胰岛素抵抗及相关概念。如图1所示,胰岛素的最大生物学效应称为胰岛素反应,达到胰岛素最大反应一半的胰岛素浓度称为半最大效应浓度(concentration for 50% of maximal effect,EC50)。如果胰岛素反应不变,而EC50增大,即剂量-反应曲线右移,此时胰岛素敏感性降低,出现胰岛素不敏感,但通过加大胰岛素浓度仍可达到最大效应(图1中曲线A)。如果胰岛素最大效应降低而EC50不变,即剂量-反应曲线下移,此时胰岛素反应降低但敏感性无变化,通过加大胰岛素浓度,不能达到最大效应(图1中曲线B)。如果胰岛素最大效应降低,同时EC50增大,剂量-反应曲线既右移又下移,则胰岛素反应和敏感性均降低,通过加大胰岛素浓度也不能达到最大效应(图中曲线C)。可见,胰岛素抵抗的实质是胰岛素敏感性的降低(图1中曲线A)或胰岛素反应的下降(图1中曲线B),或两者兼而有之(图1中曲线C)。如果胰岛素在靶组织完全不能发挥作用,则称为胰岛素无反应,这是一种极端的胰岛素抵抗。
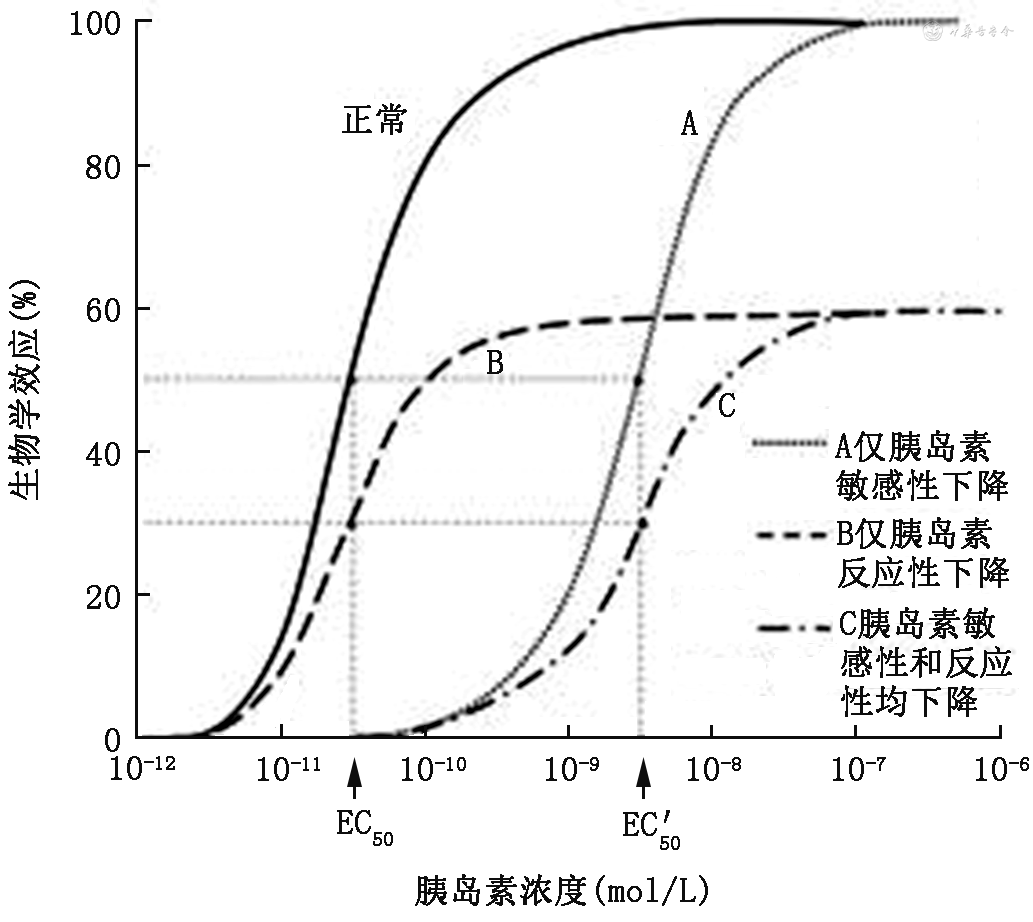

注:EC50为曲线B和正常曲线的半最大效应浓度;EC'50为曲线A和曲线C的半最大效应浓度
胰岛素抵抗的概念最早来自临床医师对糖尿病患者胰岛素治疗剂量的观察。在胰岛素问世不久,一些临床医师就发现部分糖尿病患者需要大剂量的胰岛素才能控制血糖,遂将这种现象称为胰岛素抵抗,但当时对日胰岛素剂量达到多少才算胰岛素抵抗并无统一标准。有人认为日剂量超过50 U就可视为胰岛素抵抗,也有人认为超过100 U才算胰岛素抵抗,还有人将标准定为>200 U/d[1]。20世纪30年代,英国学者Himsworth(1905—1993年)根据患者对外源性胰岛素的反应,将糖尿病分为胰岛素敏感和胰岛素不敏感2种临床类型[2],并指出胰岛素敏感型糖尿病是由于胰岛素缺乏产生的,而胰岛素不敏感型糖尿病是由于胰岛素作用缺陷引起的,创造性地将胰岛素抵抗和糖尿病的发病机制联系起来。Himsworth时代无法精确测定循环胰岛素水平,因此胰岛素抵抗学说缺少强有力的证据。1960年,Berson和Yalow通过放射免疫分析测定了人血浆胰岛素浓度,发现早期的成年起病型糖尿病患者血浆胰岛素水平不仅没有降低,反而略高于正常人,有力地证明了胰岛素抵抗的存在。1961—1962年,Rabinowitz和Zierler通过前臂动脉内注射胰岛素观察外源性胰岛素的作用,发现肥胖者外源性胰岛素促进前臂肌肉摄取葡萄糖和钾的能力明显弱于正常人,促进前臂脂肪组织摄取葡萄糖及抑制前臂脂肪组织释放游离脂肪酸的能力也较正常人为低[3],首次为人类胰岛素抵抗提供了直接证据。1970年,Shen等[4]通过稳态外源性胰岛素和葡萄糖输注发现早期糖尿病患者全身胰岛素介导的葡萄糖摄取显著低于正常人,进一步从整体水平提供了胰岛素抵抗的证据。
胰岛素抵抗与其他代谢性疾病关系的研究可追溯到胰岛素问世前。早在1921年,Joslin[5](1869—1962年)就发现糖尿病和高血压及高尿酸血症相关。1923年,Kylin也注意到上述现象,并将其命名为高血压-高血糖-高尿酸综合征[6]。1947年,Vague[7]发现上半身肥胖可诱发糖尿病、动脉粥样硬化、痛风和结石。1988年Reaven基于血糖紊乱、高血压、甘油三酯升高、高密度脂蛋白胆固醇降低具有聚集性,提出X综合征的概念,并指出胰岛素抵抗为其共同机制。X综合征中的X有未知的意思,且易与心脏X综合征(冠状动脉正常的心绞痛)混淆。随着认识的深入,Ferrannini和Kashyap等学者拓展了X综合征的外延,将其更名为胰岛素抵抗综合征及代谢综合征[8, 9]。Reaven因其在胰岛素抵抗研究中的卓越贡献而被誉为“胰岛素抵抗之父”,而胰岛素抵抗综合征也被冠名为Reaven综合征[10]。
代谢综合征一词刚问世时只是作为胰岛素抵抗综合征的同义词,并无明确的诊断标准。1999年,世界卫生组织首次对代谢综合征作出工作定义。此后,一些学术组织陆续发布了若干代谢综合征的工作定义,根据这些工作定义临床上可明确诊断代谢综合征(虽然诊断标准尚未统一)。胰岛素抵抗综合征则强调了一些代谢相关疾病具有聚集性,缺乏严谨的定义和诊断标准。美国内分泌学院关于胰岛素抵抗综合征的立场声明对胰岛素抵抗综合征的定义为:组织对胰岛素的敏感性降低导致胰岛素分泌代偿性增加的疾病[11]。该定义并不严格,而且没有考虑胰岛素分泌的动态演变:合并糖代谢紊乱的胰岛素抵抗综合征在早期确实存在胰岛素分泌代偿性增加,但随着病程的进展其胰岛素分泌逐渐减少,最后可出现胰岛素的显著缺乏。
值得注意的是,“胰岛素抵抗综合征”一词在不同背景下的含义是不同的。通常情况下,“胰岛素抵抗综合征”和“代谢综合征”是同义词,只是代谢综合征有严格的诊断标准,而胰岛素抵抗综合征相对模糊。但是,在上述“胰岛素抵抗综合征”的概念问世之前,Kahn等[12]就将胰岛素受体缺陷和胰岛素受体抗体引起的疾病称为“syndromes of insulin resistance”,并分出A、B两型:A型为胰岛素受体缺陷所致,B型为胰岛素受体自身抗体所致。1988年,首次在A型胰岛素抵抗综合征家系中发现胰岛素受体基因突变。此后,一些胰岛素受体后信号分子基因突变相继被发现[13, 14]。此外,一些非胰岛素信号通路的基因突变及染色体异常也可引起胰岛素抵抗。上述胰岛素抵抗多较严重,且病因明确,为区别于代谢综合征的胰岛素抵抗,有人称其为严重胰岛素抵抗综合征或极端胰岛素抵抗综合征,但目前仍有学者直接将这类疾病称为胰岛素抵抗综合征[13]。可见,胰岛素抵抗综合征实际上包含两个临床类别:其一与代谢综合征相似,病因不明确,系特定遗传背景下由环境因素诱发而产生;另一为病因相对明确的严重胰岛素抵抗综合征。
胰岛素抵抗是遗传因素和获得性因素综合作用的结果,其病因包括遗传、获得性因素两方面。严重胰岛素抵抗综合征多由基因突变或染色体异常所致,病因以遗传因素为主,而代谢综合征的胰岛素抵抗一般是在遗传易感性的基础上由获得性因素(如不良生活方式引起的肥胖)所诱发。
1.基因突变:可以分为以下2类。(1)胰岛素信号通路的基因突变:胰岛素信号通路相关的基因突变可引起严重胰岛素抵抗综合征,目前发现的有胰岛素受体基因突变、磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)基因突变等[13, 14]。也有学者将胰岛素基因突变引起的突变胰岛素综合征也归入胰岛素抵抗的范畴。不过,突变胰岛素综合征虽然有显著的高胰岛素血症,对内源性胰岛素抵抗,但机体对正常的外源性胰岛素并无抵抗。(2)非胰岛素信号通路的基因突变:一些非胰岛素信号通路相关的基因突变也可引起胰岛素抵抗,其中多数是与脂质沉积有关的基因,如4型促黑皮质素受体、阿黑皮素原、瘦素、瘦素受体等基因突变可引起严重的肥胖和胰岛素抵抗[13, 14]。一些基因突变可引起脂肪组织发育不良,表现为脂肪组织减少乃至缺如伴显著的胰岛素抵抗。目前已发现一些与脂肪组织发育不良有关的基因突变,如AGPAT2、BSCL2、CAV1、PTRF基因突变可引起先天性全身性脂肪组织发育不良(congenital generalized lipodystrophy,CGL),LMNA、PPARG、PLIN1、CIDEC、LIPE等基因突变可引起家族性部分性脂肪组织发育不良(familial partial lipodystrophy,FPLD)[15]。此外,ALMS1基因突变引起的Alström综合征、WRN基因突变引起的Werner综合征、DMPK基因突变引起的肌强直性营养不良、ATM基因突变引起的共济失调毛细血管扩张症、BLM基因突变引起的Bloom综合征均有胰岛素抵抗[15]。
2.染色体异常:一些染色体疾病也可引起胰岛素抵抗,如Down综合征、Turner综合征、Klinefelter综合征、Prader-Willi综合征。此外,染色体16p11.2区的缺失也能引起严重的胰岛素抵抗[16]。
3.遗传易感性:代谢综合征的胰岛素抵抗虽不能鉴定出特定的基因突变和染色体异常,但也有遗传因素参与。目前已发现一些遗传易感性与胰岛素抵抗相关[17]。
胰岛素抵抗的机制极为复杂,且不同患者、不同组织胰岛素抵抗的机制也有差异。如图2所示,胰岛素的降糖作用依赖于胰岛素受体-胰岛素受体底物-PI3K-磷脂酰肌醇磷酸依赖的激酶(phosphoinositide-dependent kinase,PDK)通路,该通路的任何环节的异常皆能引起胰岛素抵抗[18, 19]。此外,炎症、氧化应激、内质网应激、线粒体功能紊乱、胰岛素的清除、外泌体、miRNA均与胰岛素抵抗有关。一些非蛋白类信号分子,如二酰基甘油、神经酰胺等在胰岛素抵抗中也发挥重要作用[18, 19]。
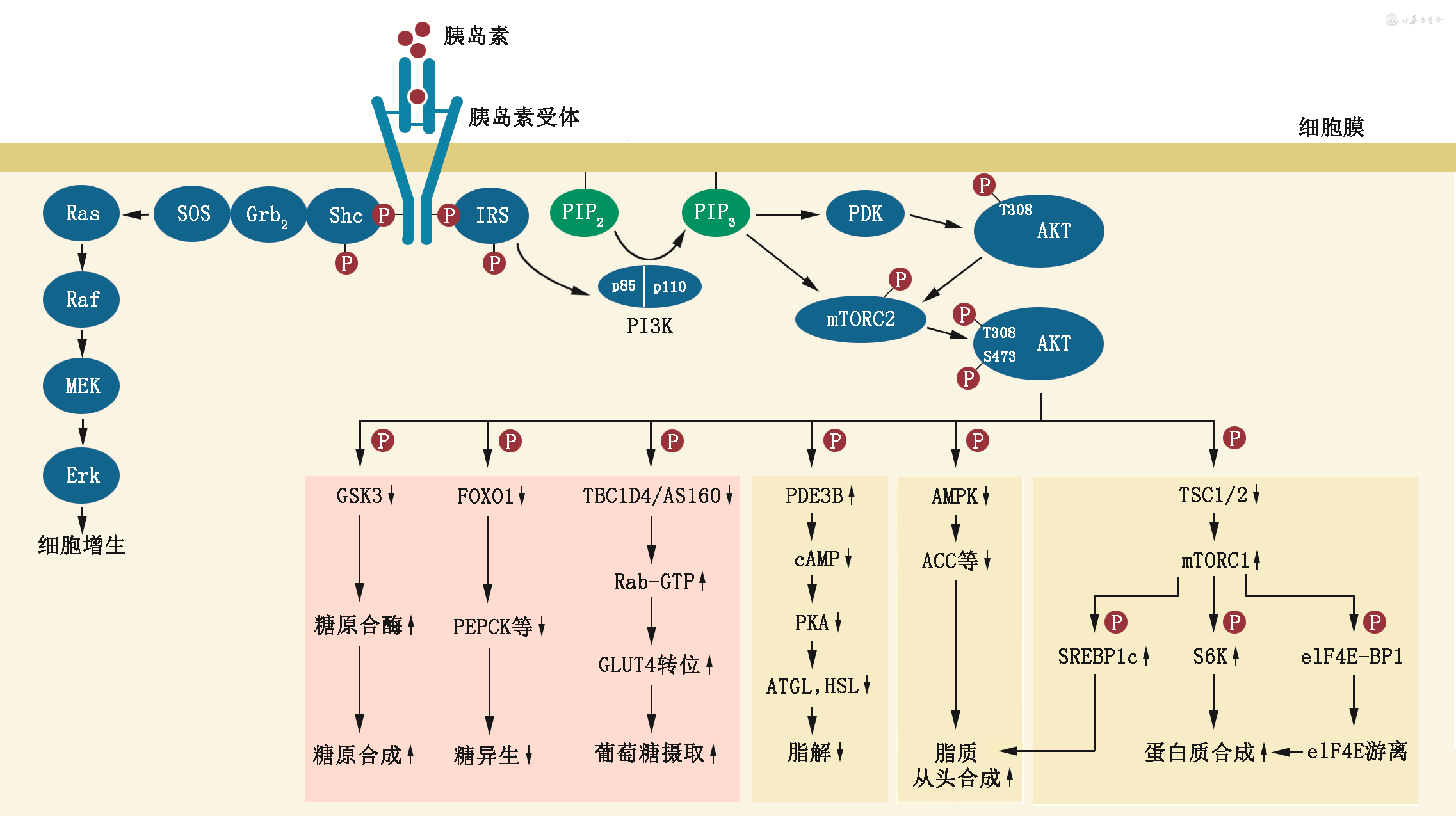

注:Erk为细胞外信号调节的激酶;MEK为丝裂原激活的蛋白激酶/细胞外信号调节的激酶;Raf为迅速加快的纤维肉瘤激酶;Ras为大鼠肉瘤病毒蛋白;SOS为“无七之子(son of sevenless)”蛋白;Grb2为生长因子受体结合的蛋白2;Shc为含Src同源域2蛋白;红圈的P代表磷酸化;IRS为胰岛素受体底物;p85为磷脂酰肌醇3-激酶相对分子质量为85 000的亚单位;p110为磷脂酰肌醇3-激酶相对分子质量为110 000的亚单位;PI3K为磷脂酰肌醇3-激酶;PIP2为磷脂酰肌醇-4,5-二磷酸;PIP3为磷脂酰肌醇-3,4,5-三磷酸;PDK为磷脂酰肌醇磷酸依赖的激酶;T308为308位苏氨酸;AKT为AKR小鼠胸腺瘤病毒癌基因编码的蛋白激酶;mTORC2为哺乳类雷帕霉素靶复合物2;S473为473位丝氨酸;GSK3为糖原合酶激酶3;FOXO1为叉头盒蛋白O1;PEPCK为磷酸烯醇式丙酮酸羧激酶;TBC1D4为TBC1域家族成员4;AS160为相对分子质量为160 000的AKT底物;Rab-GTP为结合了三磷酸鸟苷的小G蛋白Rab;GLUT4为葡萄糖转运蛋白4;PDE3B为磷酸二酯酶3B;cAMP为环一磷酸腺苷;PKA为蛋白激酶A;ATGL为脂肪甘油三酯酯酶;HSL为激素敏感酯酶;AMPK为AMP激活的蛋白激酶;ACC为乙酰辅酶A羧化酶;TSC1/2为结节性硬化复合物1/2;mTORC1为哺乳类雷帕霉素靶复合物1;SREBF1c为固醇调节元件结合的转录因子1c;S6K为核糖体蛋白S6激酶;elF4E-BP1为真核翻译起始因子4E结合蛋白1;elF4E为真核翻译起始因子4E
超重、肥胖是引起胰岛素抵抗最重要的获得性因素,尤其是内脏性肥胖。超重、肥胖诱发胰岛素抵抗的机制较为复杂,与脂肪组织缺氧、炎症、氧化应激、游离脂肪酸增加、脂联素分泌减少等因素有关[18, 19,22, 23]。游离脂肪酸增加不仅使得脂肪在骨骼肌细胞沉积,还通过二酰基甘油、神经酰胺等形成脂毒性,是造成骨骼肌胰岛素抵抗的重要原因[18, 19,22, 23]。
脂肪过少亦能引起胰岛素抵抗。脂肪组织是主要的能量储存器官,进餐后源自膳食的游离脂肪酸需要进入脂肪组织(尤其是皮下脂肪组织)储存,部分葡萄糖也进入脂肪组织。如果脂肪组织过少,其储存能力降低,可导致餐后游离脂肪酸和血糖升高,诱发胰岛素抵抗。不能进入脂肪组织储存的游离脂肪酸进入其他组织,形成异位脂肪沉积,进一步加重胰岛素抵抗,并可导致器官损伤[14,22]。皮下脂肪组织过少,还使得瘦素和脂联素产生不足,亦是引起胰岛素抵抗的重要原因[14]。CGL、FPLD、获得性全身性脂肪组织发育不良(acquired generalized lipodystrophy,AGL)和获得性部分性脂肪组织发育不良(acquired partial lipodystrophy,APL)均有显著的脂肪组织减少,这些疾病都有严重的胰岛素抵抗。CGL和FPLD系基因突变所致,AGL和APL则由获得性因素所引起[14]。根据是否与人类免疫缺陷病毒(human immunodeficiency virus,HIV)有关,APL分为HIV相关的APL和非HIV相关的APL两种,以前者多见[14,22]。值得注意的是,脂肪组织发育不良并不是所有脂肪组织都减少,患者的内脏脂肪往往增多[14,22]。
肌肉组织减少也会引起胰岛素抵抗。肌肉量与胰岛素抵抗密切相关[24, 25]。一方面,进餐后约70%的膳食葡萄糖由骨骼肌摄取,如果骨骼肌量减少则影响骨骼肌对膳食葡萄糖的摄取,导致胰岛素抵抗。另一方面,胰岛素抵抗也会造成骨骼肌的减少。Meex等[24]认为,胰岛素抵抗和肌肉萎缩是“同一枚硬币的两面”。
膳食与胰岛素抵抗有密切的联系。膳食总热卡、膳食成分及进食时间均影响胰岛素敏感性[26]。膳食总热卡过高可引起肥胖,导致胰岛素抵抗。膳食饱和脂肪可诱发肥胖和胰岛素抵抗,不饱和脂肪则有一定的改善胰岛素抵抗的作用。膳食饱和脂肪诱发的胰岛素抵抗最先出现在肝脏和脂肪,随后肌肉也发生胰岛素抵抗。与膳食脂肪一样,膳食碳水化合物也具有异质性。单糖(尤其是果糖)、二糖及升糖指数高的碳水化合物刺激胰岛素分泌,引起高胰岛素血症及肥胖,导致胰岛素抵抗,而膳食纤维则减轻胰岛素抵抗[27]。膳食蛋白质也能影响胰岛素敏感性。研究显示,高蛋白膳食较地中海膳食更能改善胰岛素抵抗[28]。还有研究显示,动物蛋白通过刺激胰高糖素分泌而诱发胰岛素抵抗,而植物蛋白则减轻胰岛素抵抗[28]。
增龄可引起胰岛素清除减少,造成高胰岛素血症,导致胰岛素抵抗[29]。增龄还可引起肌肉减少、线粒体功能降低、异位脂肪沉积、低度炎症、Rho激酶活性降低[29, 30],也是引起胰岛素抵抗的重要原因。运动不足亦可导致胰岛素抵抗。研究显示,卧床休息1周即可引起肌萎缩和全身胰岛素抵抗[31]。运动不足引起的胰岛素抵抗最先出现在骨骼肌[32],与肌肉糖原合酶活性降低、葡萄糖转运蛋白4(glucose transporter type 4,GLUT4)表达减少、二酰基甘油积聚有关[32]。
一些激素有拮抗胰岛素的作用,称为反调节激素,包括糖皮质激素、生长激素、肾上腺素等。体内这些激素过多可造成胰岛素抵抗,这是形成应激性高血糖的主要原因。甲状腺激素亦与胰岛素抵抗有关,甲亢主要引起肝胰岛素抵抗,甲减则引起外周胰岛素抵抗[33]。一些胎盘激素也有拮抗胰岛素的作用,可引起妊娠期胰岛素抵抗。
胰岛素抗体可和胰岛素结合。与抗体结合的胰岛素不能与受体结合,因此胰岛素抗体可引起胰岛素抵抗。胰岛素受体抗体可与胰岛素竞争而起到拮抗胰岛素的作用,亦能引起胰岛素抵抗。
高胰岛素血症可诱发胰岛素抵抗。有些学者甚至认为高胰岛素血症先于胰岛素抵抗出现,β细胞对营养素的高反应导致了高胰岛素血症,进而引起胰岛素抵抗[34, 35]。高胰岛素血症可通过受体降调节等机制降低胰岛素敏感性。高胰岛素血症还通过促进脂质合成、增加脂肪量而引起胰岛素抵抗。为克服胰岛素抵抗,β细胞需要分泌更多的胰岛素,形成代偿性高胰岛素血症。可见,胰岛素抵抗引起高胰岛素血症,而高胰岛素血症反过来又加重胰岛素抵抗,形成恶性循环[34, 35, 36]。如果β细胞代偿功能足够,胰岛素抵抗不会引起高血糖。但随着β细胞代偿功能的减退,逐渐出现高血糖。高血糖反过来又损害细胞对葡萄糖的摄取,诱发胰岛素抵抗[37, 38],形成另一个恶性循环。
胰岛素抵抗的治疗策略包括3个方面:生活方式管理、药物治疗和手术治疗。
1.膳食:控制总热卡可有效改善胰岛素抵抗[39]。热卡限制和心脏代谢风险(calorie restriction and cardiometabolic risk,CALERIE)研究显示,每日热卡减少11.9%可显著改善胰岛素抵抗[40]。最近张惠杰等在中国人群的研究也显示,控制热卡不论是否联合限时进食都可改善胰岛素抵抗[41]。
膳食宏量营养素也可影响胰岛素敏感性。膳食脂肪显著影响胰岛素敏感性,且不同脂肪的影响有很大差异。高脂饮食是建立动物肥胖、胰岛素抵抗最常用的方法,降低饱和脂肪和反式脂肪的摄入、增加多不饱和脂肪的相对量可改善胰岛素抵抗。膳食碳水化合物是影响机体胰岛素敏感性的另一重要因素,高碳水化合物(尤其是果糖)可诱发胰岛素抵抗,低碳水化合物膳食可改善胰岛素抵抗。但是,长期低碳水化合物膳食对健康的影响仍有争议。生酮膳食是一种极低碳水化合物膳食,可降低体重,改善胰岛素抵抗,但长期生酮膳食因蛋白和脂肪含量过高对健康亦有不利影响。不仅碳水化合物的量可影响胰岛素敏感性,碳水化合物的质也非常重要。目前认为低升糖指数碳水化合物优于高升糖指数碳水化合物[42]。膳食纤维是一种特殊的碳水化合物,不能在肠道消化吸收。全谷类含有丰富的膳食纤维。研究显示,膳食纤维和全谷类可改善胰岛素抵抗。目前一般人群存在较大的膳食纤维缺口。Reynolds等[43]基于系统综述和荟萃分析的结果,建议成人每日补充15 g膳食纤维或将膳食纤维摄入量增加到35 g/d。膳食蛋白与胰岛素敏感性也有一定关系。Tettamanzi等[27]发现,高蛋白膳食可改善胰岛素抵抗。也有研究显示,动物蛋白摄入增加可诱发胰岛素抵抗。此外,长期高蛋白摄入还会促进细胞衰老及肾损害。因此,蛋白摄入应控制在合理的范围。
某些膳食模式有助于改善胰岛素敏感性。研究显示,地中海膳食、终止高血压膳食(dietary approaches to stop hypertension,DASH)也能改善胰岛素抵抗。地中海膳食强调多摄入水果、蔬菜、豆类、坚果类食物、鱼、海鲜,烹饪时用植物油代替动物油,尤其提倡使用橄榄油。DASH提倡多摄入水果、蔬菜、全谷物、低脂奶,减少甜食、油脂类(特别是富含饱和脂肪酸的动物性油脂)、红肉及加工肉制品、限钠。各种间歇性禁食也能改善胰岛素抵抗。
2.运动:运动可显著改善胰岛素敏感性[44]。运动的效应与运动量及运动强度有关。高强度运动的效果更好,但需要注意潜在的风险。一般认为,每周坚持150 min以上的中等强度运动即可改善胰岛素抵抗[44]。
3.其他:精神应激、吸烟、睡眠不足及昼夜颠倒皆与胰岛素抵抗有关,消除精神应激、戒烟、保持正常的睡眠、避免昼夜颠倒、补充矿物质和微量元素均有助于改善胰岛素抵抗。
1.降糖药:主要包括以下5类。
(1)二甲双胍:基础和临床研究都显示,二甲双胍具有改善胰岛素抵抗的作用[45, 46]。二甲双胍具有良好的药物可及性,价格低廉,不良反应小,可作为糖尿病患者胰岛素抵抗的一线治疗药物。
(2)噻唑烷二酮(thiazolidinedione,TZD):TZD类也称为格列酮类,通过激活过氧化物酶体增殖物激活的受体γ(peroxisome proliferators-activated receptor γ,PPARγ)发挥作用。TZD类具有显著增强胰岛素敏感性的作用,被视为胰岛素增敏剂。TZD类促进脂肪组织对游离脂肪酸的摄取和储存,减少肝脏的葡萄糖输出,改善外周组织的胰岛素抵抗和对葡萄糖的摄取利用,减少脂肪的异位沉积。目前临床上使用的TZD类有吡格列酮和罗格列酮两种。TZD类有水钠潴留、增加容量负荷等不良反应,使用时应注意相关不良反应。虽然目前TZD类使用较少,但如掌握好适应证和禁忌证,其仍然是一类具有重要临床价值的药物[46, 47]。
TZD类和二甲双胍的固定复方制剂兼有TZD和二甲双胍的作用,可增加患者依从性。目前国内常用的TZD类和二甲双胍固定复方制剂为吡格列酮二甲双胍片。
(3)过氧化物酶体增殖物激活的受体泛激动剂:PPAR有α、β/δ、γ 3种亚型。TZD类为选择性PPARγ全激动剂。有学者研发出对PPARα、PPARβ/δ和PPARγ都有激动作用的激动剂,即PPAR泛激动剂[48, 49]。PPAR泛激动剂除激活PPARγ外,还能激活PPARα和PPARβ/δ。PPAR泛激动剂激活PPARα可促进肝脏、肌肉等组织氧化分解脂肪酸,降低血浆中的甘油三酯水平并减少组织中的脂质蓄积,同时促进肝脏合成载脂蛋白AI、AII并升高血浆高密度脂蛋白水平;激活PPARβ/δ可促进热量产生和能量转化。PPAR泛激动剂发挥不同亚型激活作用的重叠或拮抗,可避免或降低特定亚型带来的安全性影响。
属于PPAR泛激动剂的药物有西格列他钠(chiglitazar)、Sodelglitazar、lanifibranor等,其中西格列他钠为全球首个获批的PPAR泛激动剂[50]。西格列他钠对PPARα、PPARβ/δ和PPARγ的EC50分别为1.20、1.50、0.08 μmol/L,其对PPARγ的EC50介于吡格列酮和罗格列酮之间[51]。西格列他钠与吡格列酮的头对头临床研究显示,西格列他钠32 mg/d和吡格列酮30 mg/d对稳态模型评估胰岛素抵抗指数的改善差异无统计学意义,糖化血红蛋白降幅也相当[52]。
(4)胰高糖素样肽-1受体激动剂(glucagon-like peptide-1 receptor agonist,GLP-1RA):目前常用的GLP-1RA类药物利拉鲁肽、度拉糖肽、司美格鲁肽皆可改善胰岛素敏感性。GLP-1RA改善胰岛素敏感的作用主要是通过减重实现的。临床研究显示,度拉糖肽改善胰岛素敏感性的作用弱于二甲双胍[53]。
(5)钠-葡萄糖共转运蛋白2抑制剂(sodium-glucose co-transporter 2 inhibitor,SGLT2i):SGLT2i可改善胰岛素抵抗。研究显示,恩格列净还能改善脑胰岛素抵抗[54]。
2.减重药治疗:减重药通过降低体重对胰岛素抵抗有一定的改善作用。
3.严重胰岛素抵抗的治疗:一些病因明确的胰岛素抵抗综合征可用某些特殊药物治疗[55]。胰岛素受体基因突变的胰岛素抵抗综合征可用重组人胰岛素样生长因子(Mecasermin)治疗[56],不仅可控制血糖,还能延长Donohue综合征患者寿命。瘦素制剂Metreleptin可用于治疗脂肪组织发育不良,不仅能改善胰岛素抵抗、高甘油三酯血症、心脏肥大等异常,还可降低死亡率[57]。最近,Okawa等[58]将Metreleptin用于治疗胰岛素受体基因突变引起的Rabson-Mendenhall综合征,发现其可改善患者的血糖。B型胰岛素抵抗综合征为自身免疫病,可用糖皮质激素等免疫抑制剂治疗[58]。近年有人联合应用利妥昔单抗、大剂量皮质激素和环磷酰胺治疗B型胰岛素抵抗综合征,获得较好效果[59]。
代谢手术可以改善胰岛素抵抗,这一效应主要由减重介导[60],胰高糖素样肽-1分泌增加也起一定作用。代谢手术有一定的并发症风险,因此术前应充分评估手术的风险和获益。对于有重度肥胖的胰岛素抵抗患者,如生活方式干预联合减重药物不能控制体重可在充分评估风险和获益的情况下行减重手术。
综上所述,胰岛素抵抗的实质是胰岛素敏感性的降低和(或)胰岛素反应的下降。绝大多数胰岛素抵抗主要由获得性因素引起,是肥胖、糖尿病、高血压、动脉粥样硬化性心血管疾病、非酒精性脂肪性肝病、多囊卵巢综合征等代谢性疾病的共同病理生理基础。胰岛素受体等基因突变也可引起胰岛素抵抗,所引起的疾病称为遗传性胰岛素抵抗综合征。生活方式干预是胰岛素抵抗管理的基础,应贯穿于管理的始终。伴糖尿病的胰岛素抵抗患者在生活方式干预的基础上,可根据患者临床特点使用TZD类、PPAR泛激动剂等药物治疗。部分伴重度肥胖的患者在生活方式干预和药物治疗不能获得满意效果的情况下可选择代谢手术。
苏青, 臧丽. 胰岛素抵抗的历史、机制和管理[J]. 中华糖尿病杂志, 2023, 15(1): 6-13. DOI: 10.3760/cma.j.cn115791-20220905-00447.
所有作者声明无利益冲突



























