
诱导多能干细胞(induced pluripotent stem cell, iPSC)技术通过基因重编程和去分化的方法,逆向诱导分化成熟的体细胞成为具有多向分化潜能的干细胞。本文概述iPSC的研究沿革及生物学优势,归纳并展望iPSC在糖尿病及其并发症中的应用研究。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
干细胞转化医学研究在生物医学领域一直备受关注,而近年来诱导多能干细胞(induced pluripotent stem cell, iP-SC)的发现进一步将干细胞的研究和治疗带入了一个全新领域。该技术通过基因重编程和去分化的方法,逆向诱导分化成熟的体细胞成为具有多向分化潜能的iPSC,并根据需要将这种体细胞源性iPSC进一步通过定向选择、分化诱导成不同胚层内的终末体细胞。在短短几年时间,各国学者在iPSC基础研究领域内不断突破和进展,特别是来自患者自身的iPSC给发育生物学、表观遗传学、再生医学、肿瘤学及药理毒理学的研究提供了理想的工具。当前,iPSC已被用于血液病、心血管疾病、神经系统疾病和代谢性疾病的临床治疗研究。
在内分泌疾病领域,iPSC也被引入到糖尿病治疗研究。尽管其仍处于早期阶段,但相关基础和临床研究已渗透至糖尿病治疗的诸多方向,本文对其进行总结归纳和研究展望。
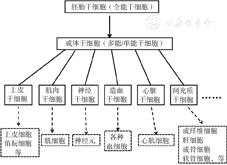
干细胞多向分化潜能使其可分化成多种功能细胞。按其所处发育阶段,干细胞分为全能性胚胎干细胞(embryonic stem cell, ESC)和多能/单能性成体干细胞(ESC可向几乎全部组织和器官分化);成体干细胞位于成体组织或器官内,由于具有组织特异性,其定向分化为特定的终末体细胞或组织(图1)。随着基因技术、细胞生物学、组织工程学等多学科的渗透,干细胞技术得到迅猛发展和广泛应用。尽管应用干细胞构建各种组织和器官用于疾病的移植治疗已成为该领域研究和应用的主要方向,但诸多限制依然存在:①成体干细胞虽有组织分化特异性,亦可横向分化为其他类型的细胞和组织,但对分化条件要求高,且诱导手段和功效存在较大争议;②传统观点认为干细胞向特定体细胞分化成熟,而体细胞不能向干细胞方向转化,加之成体干细胞横向分化存在限制,迫使干细胞研究更多依赖全能性ESC;③ ESC研究涉及诸多法律和伦理道德问题。鉴于此,人们意图寻找一种可替代ESC的新型干细胞。

2006年,日本学者Takahashi等首次用腺病毒载体将4个转录因子:Oct3/4、Sox2、c-Myc和Klf4成功地转入小鼠尾部皮肤成纤维细胞,诱导成具有类似ESC生物学特性的干细胞(图2),并命名为iPSC[1]。该细胞表达ESC特异性细胞标志物,注入裸鼠皮下,可形成向3个胚层器官分化的畸胎瘤组织。此后,陆续有学者将Oct4、Sox2、c-Myc、Klf4和Oct4、Sox2、Nanog、Lin28两套基因转入人成纤维母细胞和胃上皮细胞中,也诱导出类似ESC的iPSC[2,3,4]。继之,Okita等用Nanog代替Fbx15进行筛选,最终得到了Nanog阳性的iP-SC细胞系,该细胞系不仅在细胞形态、生长状况、标志物表达、移植到小鼠皮下可形成畸胎瘤等方面,与小鼠ESC极为相似,且在DNA甲基化方式、基因表达谱、形成嵌合体动物等方面也与小鼠ESC具有相似特性[5]。
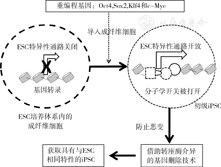

2009年,为避免c-Myc等原癌基因和逆转录病毒载体导致的致癌风险,研究者建立了个体特异的、疾病特异的或患者特异的人iPSC,借助转座子介导的转基因方法,制备了高效非病毒载体iPSC,成功从所获得iPSC中移除先前导入的基因[6]。同年,我国学者利用iPSC通过四倍体囊胚注射,小鼠囊胚存活并发育成具有繁殖能力的小鼠,进一步验证了iPSC的全能性[7]。2010年,Lian等描述了iPSC具有分化成间充质干细胞(mesenchymal stem cell,MSC)的潜能[8],并有研究进一步证实iPSC可无限制的分化为MSCs[9]。随后iPSC在体细胞选择、安全性及诱导效率等研究方面都有进展。从最初的病毒载体系统永久性地插入受体细胞基因组的方法,到避免使用致癌性因子c-Myc和Klf4而使用非整合性腺病毒载体、脂质体等方法,而后又将已整合的外源因子从基因组中清除Cre/LoxP、piggyBac转座子及直接用蛋白质介导的方法[10],iPSC技术得到进一步的完善。
继小鼠之后,研究人员又建立了大鼠,恒河猴,小型猪和人体细胞的iPSC细胞系,不但表明iPSC可来源于更多其他哺乳动物,且证明:难以建立胚胎干细胞系的物种可通过iPSC技术建立干细胞系。近年来有报道通过核移植、细胞融合和特定转录因子导入等方法,实现体细胞重编程后回溯多潜能状态,在这方面,有学者直接从志愿者身上提取皮肤细胞重编程为iPSC[11];此外,胃上皮细胞,肝细胞,神经细胞,B淋巴细胞、胰岛β细胞等,同样可诱导产生iPSC,反之,iPSC可选择性分化成皮肤,肌肉,胃肠,神经细胞,软骨,视网膜,耳蜗神经及同步搏动的心肌细胞。
不同类型的体细胞对生成iPSC的生物安全性和效率有重要影响。小鼠肝脏细胞和胃表皮细胞获得的iPSC比胎鼠成纤维细胞获得的iPSC表现出成瘤性。人角朊细胞用逆转录病毒来携载和介导表达Oct4、Sox2、Klf4和c-Myc,可使约1%的角朊细胞重编程获得iPSC,诱导过程只需10 d。孕妇产前诊断的羊水细胞采用同样方法,可更高效、快速地诱导产生iPSC(效率最高达1.525%;重编程时间缩短至6 d)。也有研究发现人脂肪干细胞比皮肤成纤维细胞更容易被诱导为iPSC(前者效率是后者20倍)[11]。
在细胞水平,iPSC具有其他干细胞无法比拟的优势:其在形态学、生长特性、表观遗传学、全基因表达谱,及细胞类型特异的分化潜能方面与ESC极其相似[12],具有强大自我更新能力及全能性分化的潜力;iPSC的获取无需损毁胚胎,不受法律与伦理道德的束缚;iPSC来源充足可靠,容易获得,已有研究小组完成人外周血细胞重编程获得iPSC的工作,该研究将为临床应用提供最便利获取高效能种子细胞的途径[13,14,15];iPSC可由患者体细胞诱导获得,具有与其自身相同的基因型,避免了受体移植免疫排斥反应,可为患者提供个体化的自体干细胞。因具有ESC功能,又避免ESC的潜在不足,iPSC被认为是最"人性化"的再生医学材料。
在基础研究方面,iPSC的出现颠覆了"分化成熟的体细胞不能向干细胞转化"这一观点,此外:①iPSC为干细胞多能性调控机制研究提供了理想的细胞模型;②补充了对细胞重编程的认识,也提示人们细胞内外因子均参与了细胞调控;③方便人们在原始干细胞水平对单一转录因子的功能进行研究;④可人为操控基因和蛋白表达,加速对干细胞多能性调控机理的深入研究。
临床研究方面,iPSC已被分化为神经元和神经胶质细胞、心血管细胞及原始生殖细胞等,并成功应用于神经系统和心血管系统疾病的前期治疗。由于其获取简单,操作方便、与ESC性状极为相似、分化潜能和多能性明显,经诱导后可向多种多能/单能干细胞和体细胞分化,iPSC在生物医学各分支领域应用前景广阔。Shinya Ya-manaka与英国学者John B. Gurdon也因此获得2012年诺贝尔生理学和医学奖。
干细胞技术在研究胰腺的胚胎发育、糖尿病的发病机制、降糖药物筛选、基因治疗等方面均具有不可低估的应用价值,是糖尿病治疗学研究的有力工具。目前干细胞技术治疗糖尿病有2种思路:一是在实验室条件下将干细胞诱导分化为胰岛样细胞后再移植至体内;二是直接移植干细胞或干细胞巢居组织。
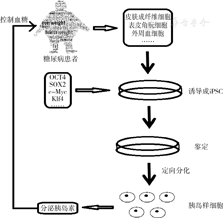
胰岛β细胞功能丧失的替代治疗包括胰岛素的应用及胰岛移植,而后者宿主抗移植物的免疫排斥问题一直没有得到很好解决。人们曾尝试制备胰岛微球,或用人参等植物细胞包裹胰岛等,但都没有最终应用到临床。iPSC的出现一方面克服了免疫排斥,另一方面,将iPSC诱导成胰岛β细胞样细胞簇即可具备分泌胰岛素的功能(不须形成完整的胰腺器官),从而使诱导过程简化,较iPSC诱导成其他器官相对容易(图3)。

由于NOD小鼠与人类1型糖尿病具有相似发病特征,因此NOD鼠源性iPSC成为研究1型糖尿病的理想细胞系。有研究人员从NOD模型鼠中分离诱导出iPSC,再回输移植给糖尿病小鼠,将iPSC移植到糖尿病小鼠左侧肾脏被膜下,这些iPSC在特定微环境下分化成β细胞;此外,亦可通过增强调节胰岛微环境血供促进体内自身胰岛β细胞增殖,在高糖和氯化钾刺激下分泌释放胰岛素,而当将移植的iPSC去除后,血糖又再次迅速升高[16]。Ratajczak等继而将iPSC通过门静脉注射移植到2型糖尿病小鼠肝脏,发现iPSC也可定向分化为胰岛样细胞,能同时改善胰岛素抵抗和胰岛功能不足,增加胰岛素释放,改善高血糖及糖化血红蛋白,分析其机制为,iPSC治疗组的血糖波动小,减轻体内氧化应激反应,从而在一定程度上保护胰岛β细胞的功能,这可能是治疗作用之一[17]。
我国学者观察胰岛素转录关键调控因子,包括胰腺十二指肠同源异型盒-1(PDX-1)、神经源性分化因子1(NeuroDl)及肌腱膜纤维肉瘤癌基因同系物A(MafA)对小鼠iPSC分化为胰岛素分泌细胞的作用。上述3个基因通过结合胰岛素基因上游启动子调控区域A3、C1、E1顺式元件共同调节胰腺发育及胰岛素基因的转录。糖尿病小鼠空腹血糖及糖耐量试验均显示:移植的iPSC能在糖尿病小鼠体内发挥良好治疗作用[18,19]。Zhu等证实从恒河猴体内分离的iPSC也可分化为有胰岛素分泌功能的细胞[20],进一步证明多种哺乳动物的iPSC都可诱导成胰岛素分泌细胞。这些为临床应用研究奠定了坚实基础。、
2008年,Xu等[21]用成纤维细胞诱导而成的iPSC选择性分化诱导成分泌胰岛素的胰岛细胞。同时Park等利用iPSC技术率先从1型糖尿病患者的皮肤成纤维细胞诱导出iPSC,并进一步定向分化为胰岛素分泌细胞[22,23]。随后有报道从老年T2DM患者皮肤角朊细胞分离出iPSC,并能诱导产生胰岛素分泌的胰岛样组织[24]。Tateishi等[25]采用人ESC诱导胰岛β细胞的方法,将iPSC分化出胰岛素分泌型胰岛细胞。这种细胞还有分泌C肽和胰高血糖素的功能,且能通过感受葡萄糖的刺激来调节C肽分泌,另有学者也用不同方法将人iPSC分化成胰岛样细胞簇,在葡萄糖刺激作用下分泌胰岛素[26]。这种血糖依赖性胰岛素分泌可避免低血糖的发生,较之前单纯分泌胰岛素又更具生物学优势。
Kudva等[27]从1型糖尿病和T2DM患者分离出非转基因iPSC,其中包括1名85岁的老年T2DM患者,为糖尿病的精准治疗和安全治疗提供实验数据。至此,iPSC在糖尿病的2个主要分型中的治疗作用已得到初步肯定。还有其他类型糖尿病,如青少年发病的成人型糖尿病(maturity onset diabe-tes of the young,MODY)是一种自体多基因突变的糖尿病,从明确诊断的各亚型MODY患者分离的iPSC,经诱导后移植给小鼠,作为特殊基因型的糖尿病β细胞功能的研究工具已在实验室中完成[28,29],故iPSC在糖尿病临床研究中的价值是多方面的。
Yan等[30]报道将iPSC移植到糖尿病小鼠心肌梗死灶周围区,14 d后用组织染色及超声检查梗死后心脏,发现可生成血管神经结构,包括血管平滑肌和内皮细胞,且心脏功能得到提高。不仅如此,Kikuchi等[31]还从健康人和糖尿病患者体内分别分离iPSC,然后诱导成心肌细胞,其形成心肌细胞的能力相似,在糖酵解和氧化磷酸化途径均能很好地利用葡萄糖,且不依赖细胞外葡萄糖浓度自动转换代谢途径。进一步研究证实,一些对心肌细胞产生作用的药物也可对iPSC源性心肌细胞产生相同效应,这为iPSC移植后的药物治疗奠定基础[32]。
糖尿病周围神经病变常伴有外周血管的硬化缺血等病理改变,这也是糖尿病伤口包括糖尿病足溃疡不易愈合的病理生理机制之一。大量关于iPSC在神经系统疾病中的研究已取得阶段性进展,但由于中枢神经系统的解剖结构局限,血脑屏障隔离iPSC以致不能达到病变部位,因此将iPSC用于人体中枢神经再生的临床治疗存在很多障碍。但糖尿病周围神经病变不存在上述约束,故Himeno等[33]将iPSC移植入链脲佐菌素诱导的糖尿病小鼠下肢肌肉及周围神经,移植后小鼠感觉阈值、神经传导速度、毛细血管密度、血运等均有所改善。从干细胞发育实验结果看出,老年小鼠分离的iPSC仍然可分化为神经嵴细胞,神经嵴细胞是脊椎动物神经发育的结构部分,能分化成周围神经元,雪旺氏细胞及血管平滑肌细胞等,再回体移植给糖尿病小鼠,仍能改善糖尿病周围神经及血管病变[34],故未受年龄的影响。
糖尿病慢性伤口愈合,尤其是糖尿病足的治疗,一直是本课题组感兴趣的研究方向[35,36],我们曾描述动物皮肤中表皮干细胞的生物发育学特征[37],及其在糖尿病皮肤中的表达特点。而iPSC技术为我们的深入研究提供新思路,在前期伤口局部表皮干细胞作用研究的基础上,iPSC通过改善机体血糖水平,改善伤口部位的血液循环及神经营养,促进伤口收缩,对糖尿病伤口愈合起到综合治疗作用。
目前iPSC可分化为包括视网膜色素上皮细胞、感光细胞及视神经节细胞在内的各种视网膜细胞[38]。故将iPSC移植到视网膜细胞中的技术日趋完善,为糖尿病视网膜病变致盲的患者带来福音。
iPSC也是一种治疗1型糖尿病合并糖尿病肾病的可选择方法,但这方面的研究很少,需进一步研究肾脏发育学机制,及由人iPSC直接分化成肾脏细胞系的方法,才能完成iPSC技术在糖尿病肾病中的治疗[39]。
iPSC分化诱导胰腺β细胞的基础和临床研究进一步丰富和补充了干细胞技术治疗糖尿病的策略。尽管如此,在其真正步入临床治疗之前,研究人员仍需探索和解决该领域内的相关课题,包括:①为避免基因转染带来的潜在风险,如能通过某些药物或细胞因子激活体细胞中业已存在的转录因子,诱导出高效安全的iPSC,用于临床个体化治疗,将是以后的研究方向。当前,在细胞培养液中加入Oct4、Sox2、Klf4、c-Myc 4种基因对应的4种重组蛋白也能将小鼠和人的体细胞在体外重编程为iPSC,从而获得了近似"治疗型"的iPSC[40]。若能借助分子遗传学技术进一步提高诱导iPSC的效能,或快速诱导出高效安全的iPSC,这将进一步推进iPSC的临床实际应用;②虽建立了个体特异的、疾病特异的及患者特异的人iPSC,并在机体特定微环境的诱导下分化成β细胞,但确切的多信号调控通路和分子学机制仍不清楚,这也是目前全世界科学家研究的难点和热点之一;③抑制诱导成功后的iPSC在生长中出现的衰老趋势问题。在这方面,体细胞基因经过一系列重组后,细胞内某些蛋白水平会下降,因此要获得长期稳定的细胞体系,并使细胞永久性生长是个难题。尽管当前有学者提出采用抑制Rb和P53通路或下调端粒酶活性来克服成纤维细胞衰老,但"分化诱导出的iPSC是否仍具有延缓细胞衰老的特性" ,是否需直接对分化诱导出的iPSC进行抗衰老处理等,仍需进一步探索;④1型糖尿病是一种自身免疫性疾病,用患者自身的体细胞诱导iPSC所产生的胰岛样细胞与患者有一致的遗传基因,故该胰岛样细胞同样存在着被自身免疫系统攻击的可能,由于其遗传易感性一致,可能还有复发的危险,这将影响iPSC移植后的长期疗效。
成熟的生物医学技术要有近乎100%的把握才能最终从实验室走向病床旁,从而实现转化医学的顺利过渡。当前,基础医学和临床前期研究已证实:iPSC作为治疗糖尿病的一个新的种子细胞,其分化诱导胰腺β细胞用于治疗糖尿病已经展现出令人欣喜的效果。随着新技术的不断发展和综合技术的联合运用,包括纳米医学技术、药物基因组学、表观遗传学、蛋白质组学等,iPSC用于糖尿病的治疗也会百尺竿头,更进一步。



























