
传统视网膜脑图技术通过采用行波法研究视网膜与视皮层之间的拓扑映射关系,实现了无创地对人类视皮层功能区的划分。功能磁共振成像群感受野(population receptive field,pRF)技术的出现,使得人类视皮层的分区更加精确,更重要的是实现了对pRF特性分析。目前该技术已在视觉注意及临床疾病的视觉障碍研究中得到了应用。但在国内,该技术仍鲜有深入报道,本文就基于血氧水平依赖的功能磁共振成像(blood oxygen level dependent-functional magnetic resonance imaging ,BOLD-fMRI)在视觉领域最新进展pRF技术作一综述。

本刊刊出的所有论文不代表本刊编委会的观点,除非特别声明
血氧水平依赖的功能磁共振成像(blood oxygen level dependent-functional magnetic resonance imaging,BOLD-fMRI)可以毫米分辨率非侵入性地测量人脑活动,其优势已被视觉研究者们充分挖掘利用。1992年,Ogawa等[1]首次利用fMRI研究了视觉皮层上BOLD信号激活,发现视觉刺激和大脑皮层呈现一定的拓扑对应关系。1994年,Engel等[2]采用行波技术研究视网膜与视皮层之间的拓扑映射关系,即视网膜脑图。基于视网膜脑图技术,研究者实现了有效且无创地对人类视皮层进行分区,该技术在视觉生理及临床疾病的研究中产生了深远影响。2008年,Dumoulin等[3]根据感受野(receptive field ,RF)模型和在传统行波技术的基础上建立了基于fMRI时间序列的群感受野(population receptive field,pRF)模型,以更精确分析视觉皮层对视觉刺激的反应,该模型除可以更加精确地对视皮层分区外,更进一步实现了对视皮层的pRF特性的分析,并且证明了基于BOLD-fMRI的pRF与基于电生理技术的RF基本一致(如图1所示),该模型的出现显著拓展了人类视觉皮层研究的视野。
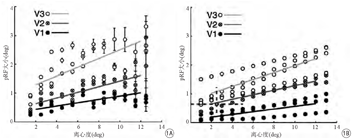
视野由若干RF组成,来自RF的视觉刺激可以引起视觉皮层各功能区相应位置的响应,并且临近RF具有相邻的皮层功能代表区,把视野局部区域与大脑视皮层功能代表区之间这种一一对应的关系,称为拓扑映射关系。以BOLD-fMRI为主要成像手段,研究视网膜与视皮层之间的拓扑映射关系,对大脑视皮层进行功能分区的技术称为fMRI视网膜脑图技术,由此获得的视皮层功能分区图称为视网膜脑图。
传统的fMRI视网膜脑图技术使用行波分析法,其测量的是引起每个皮层最大反应的刺激位置,常用的刺激是扩张的环形和旋转的楔形[4,5]。尽管该技术已经在很大程度上推动了视觉认知的研究,但仍存在一些局限性,比如:难于对中央凹融合区进行很好地测量;以圆环为刺激,行波分析方法估算的离心率映射图会在分析中被非线性地扭曲而导致图像失真,尤其表现在中央凹视野映射区;当神经元感受野非常大的时候,相位编码的方法无效等。更重要的是,一个体素的神经元群实际上反映的是一个空间范围的刺激定位,而行波法针对的仅仅是最大反应的视野位置,这会带来一定的误差。
视觉RF是处理视觉信息的基本结构和单元,它是指视野(视网膜)中可以引起或调制神经细胞响应的范围[6]。当RF中的视觉刺激发生变化时,与其对应视皮层的神经元的激活就会发生改变。电生理研究表明相邻的神经元具有相似的RF,研究中学者们量度相邻几个或者一群神经元的集中反应,这些神经元所对应的空间范围被称为pRF。
针对传统视网膜脑图技术的缺陷,Dumoulin等[3]建立了基于fMRI时间序列的pRF模型,以更精确地分析视觉皮层对视觉刺激的反应。该模型描绘的是相邻几个或者一群神经元所对应的空间范围,可以在微米尺度反映神经元的性质。相比于以行波法为代表的传统视网膜脑图方法,pRF模型获得的视网膜脑图更加准确,大大缩小了fMRI技术与电生理方法在空间分辨率的差距。此外,该技术实现了对pRF特性的定量分析,成为了研究者们深入了解视觉认知的突破口。
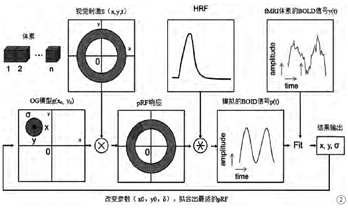
BOLD-fMRI的pRF模型包括3个部分:刺激、pRF以及基于二者预测fMRI响应的计算。刺激通过呈现高对比度图案来实现,包括离心放大或向心缩小的圆环,顺时针或逆时针方向旋转的楔形,由相同的棋盘图案组成的移动,或者放置在不同视野位置的一系列刺激图案,需要明确的是模型考虑的是刺激的位置,并不是刺激模式;pRF形状在视野中被建模为二维各向同性高斯圆形,可以用3个参数来表示,位置(x,y)和大小(σ);将刺激表示与感受野相结合的计算,是二进制刺激图像和高斯感受野的逐点乘积,在每个体素处调节pRF参数以使预测和测量的fMRI时间序列一致。BOLD-fMRI的pRF模型具体分析步骤如图2所示。首先,pRF模型在刺激所涵盖的视野内生成许多可能的pRF中心和大小的数据库;然后假设图案的所有刺激部分与fMRI反应相匹配,这些刺激形状和大小可以使用一个二进制的指数函数公式有效地进行描述;接着计算一个体素中有效刺激和模型pRF的重叠,与血液动力学函数(hemodynamic response function,HRF)进行卷积得到模拟的BOLD信号;最后,将模拟的BOLD信号与真实的BOLD信号进行拟合,计算预期之间的残差和,并通过最小二乘法,得到最优化的pRF参数,pRF模型的3个参数分别是:(x,y)代表pRF的位置,σ代表pRF的大小。

pRF模型有以下3个属性:一是大小、位置等关键的pRF参数在同一刺激框架中是确定的,研究者们可以直接比较使用不同仪器估计的模型参数;二是pRF是在个体水平下估计的,这就使得比较同一实验条件下两名受试者、不同实验条件下的同一受试者的模型参数是有意义的;三是pRF模型在时间上具有高度稳定性[7],这些属性为pRF模型在科学研究及临床应用中奠定了坚实基础[8]。
为了准确捕捉各种刺激的皮层反应模式,pRF模型向着更复杂的模型改进。首先表现在pRF分析方法上。传统模型使用圆对称高斯函数来描述pRF,没有考虑到pRF的中心-周围结构,2010年,Zuiderbaan等[9]提出使用圆对称高斯差分(difference-of-gaussians,DoG)函数添加环绕抑制来扩展pRF模型;2013年,Lee等[10]采用基于拓扑结构的高斯函数(topography-based gaussian,TBG)的pRF分析方法模拟了pRF的各向异性,同时对pRF的位置、大小、激活区-抑制区、各向异性等4项特性进行模拟分析;2018年,Merkel等[11]通过反投射预处理的fMRI时间序列来直接测量pRF分布图,获得有关pRF形状特征的信息。其次是在计算方面。2011年,Nishimoto等[12,13]开发了用来解释时空图像的pRF模型,该模型可在体素反应的模式下重建刺激(自然电影);2013年,Kay等[14]通过分析压缩空间求扩展线性pRF模型,大大增加了模型准确预测刺激范围的准确性,同年开发了对含有大量二阶对比度(对比度的空间变化)的图像数据进行操作的模型[15]。新一代的模型获得的视觉皮层的pRF更加接近于电生理研究结果,为探索视觉认知奠定了基础。
自2008年Dumoulin等[3]建立pRF模型后,陆续有一些关于视皮层pRF特性的研究,逐步加深了人们对于视觉系统感受野特性的认识。Dumoulin等[3]首先采用该模型实现了对背侧枕叶(lateral occipital ,LO)和腹侧枕叶(ventral occipital,VO)中的pRF大小的估算,发现LO和VO中的pRF大小比V1~V3大5倍,并且印证了之前电生理的研究结果:pRF的大小随着偏心率增加而增加[3,16],并且从初级视皮层到高级视皮层,其pRF也逐渐变大;同时通过获取表征视野不同区域有效引起皮质扩展区的响应的覆盖图,量化来自同侧和对侧视野的输入量,进一步发现V1~V3的pRF被侧向化,LO和VO中pRF则没有。Harvey等[17]使用功能磁共振pRF模型揭示了各pRF和皮层放大率(cortical magnification factor,CMF)之间存在负相关性,其中,V1的pRF最小,对应的CMF最大,提示了V1区在视觉信息处理过程中承担更多的功能。
Desimone等[18]使用pRF模型估计丘脑网状核和黑质中的视网膜图,并且测量了这些细胞核和外侧膝状核、上丘等pRF的大小,弥补了传统的行波技术无法精确测量皮质下核视网膜脑图的缺陷,加深了人们对视觉皮质下区的认识。
fMRI的pRF模型已被应用于注意调节视觉认知的脑机制研究中,研究者利用pRF特性评估了空间注意对视觉认知的调节作用。Fang等[19]和Rijpkema等[20]通过研究表明空间注意能够改变视皮层激活的拓扑特性,间接证明注意对视皮层pRF的调节作用;Sprague等[21]发现空间注意可以增强视皮层的激活强度,但不会改变刺激在皮层上的映射面积,同时认为高级视皮层在注意调制方面有更加重要的地位;Klein等[22]的实验结果显示空间注意在整个视野范围内改变pRF的位置,pRF中心会向注意位置移动,移位的效果在V1、V2中较小,而在高级视觉皮层(例如hV4、LO和IPS映射)较大,进一步证实了高级视皮层在注意调制方面的重要地位。过去学者们认为视觉系统腹侧通路只编码刺激是什么,而不编码位置和大小的认知,然而Kay等[23]发现受试者注意刺激时选择性地调节腹侧颞叶皮层的反应,颠覆了人们对腹侧通路在注意调节脑机制方面的认知。2017年,Vo等[24]在Neurosci上发表的最新关于注意对视皮层体素感受野(voxel receptive field,vRF)影响的报道,认为vRF位置变化引起视觉信息增强的贡献大于vRF大小或增益的变化,并表明vRF位置变动是空间注意力增强相关视觉信息编码的主要机制。
阿尔茨海默病(Alzheimer disease,AD)是临床上常见的严重影响老年人生活质量的进行性的神经退行性疾病,视觉缺陷被报道为AD的首要症状之一[25],Brewer等[26]对轻度AD患者进行pRF测量发现,一位受试者有无序的视野图(V1、V2、V3和hV4),而第2位则有典型的视野图,这两位受试者作为偏心率函数的pRF尺寸的模式都不同于对照组,表明这种变化可能是疾病早期出现视觉症状的基础;Schwarzkopf等[27]测量了自闭症和对照人群之间的差异,发现自闭症组的纹外区域的pRF尺寸大于对照组,V1或V3A中没有pRF大小差异,解释纹外区域pRF大小异常可能为自闭症障碍患者的局部视觉处理增强的原因。精神分裂症(schizophrenia,SZ)患者在视觉任务时表现为异常的视觉感知,Anderson等[28]使用DOG模型获得pRF的中心-周围结构并分析表明,SZ与早期视网膜视皮层pRF大小减少相关,主要是抑制性周围区域减少,认为抑制作用减弱导致了SZ报道的多种视觉缺陷。对精神及神经类疾病患者视觉pRF特性的研究,加深了人们对临床疾病视觉障碍机制的认知。
BOLD-fMRI的pRF技术可以同时分析整个视觉皮层的pRF,并且被证明和电生理研究结果一致,加之可靠的参数估计,大大扩展了视网膜脑图技术在人类视觉系统研究中的应用。
目前的研究集中于对视觉功能区的pRF特性分析。视觉皮层包括多个功能区,这些功能区相互作用完成视觉信息处理。利用pRF技术分析整个视觉皮层的作用关系以及受注意、情绪、疾病等因素的影响是将来研究的新方向。



























