
探讨磁共振成像在非哺乳期乳腺炎性病变中的诊断价值。
回顾性分析经手术及穿刺病理证实且有完整MRI资料的非哺乳期乳腺炎性病变共83例,分别对病灶形态学、信号强度、表观扩散系数(apparent diffusion coefficient,ADC)值、强化特点及时间信号强度曲线(time intensity curve,TIC)类型进行评价及测量。
54例表现为肿块,包括单灶(29/54,53.7%)和多灶(25/54,46.3%),形态以不规则形为主(27/54,50.0%),边缘多不规则(27/54,50.0%)或清楚(21/54,38.9%),增强扫描呈不均匀强化(27/54,50.0%)或环形强化(27/54,50.0%)。29例表现为非肿块强化,分布方式以节段样强化为主(16/29,55.2%),增强扫描多呈不均匀强化(20/29,69.0%)。T2WI/IDEAL WATER (T2 weighted image/iteration decomposition of water with echo asymmetry and least-squares estimation)序列多表现为等信号(31/83,37.3%)或稍高信号(31/83,37.3%),扩散加权成像(diffusion weighted imaging,DWI)序列以稍高信号(33/83,39.8%)或高信号(46/83,55.4%)为主,平均ADC值为(1.15±0.30)×10-3 mm2/s。TIC类型以平台型为主(52/83,62.7%)。病灶内常伴有囊变及坏死区(54/83,65.1%)、灶周水肿(35/83,42.2%)、部分病灶伴出血(9/83,10.8%)。伴随征象包括邻近皮肤异常改变(30/83,36.1%)、胸壁异常改变(11/83,13.3%)、同侧腋窝淋巴结肿大(23/83,27.7%)。
非哺乳期乳腺炎性病变在MR影像上具有一定特征性,与乳腺癌的鉴别诊断价值较大。

本刊刊出的所有论文不代表本刊编委会的观点,除非特别声明
乳腺炎性病变主要包括急慢性乳腺炎、乳腺脓肿、浆细胞性乳腺炎、肉芽肿性乳腺炎、脂肪坏死等[1]。急性乳腺炎多发生于产褥期及哺乳期妇女,症状及体征典型临床易于诊断。非哺乳期乳腺炎性病变常起病隐匿,临床症状不典型,尤其触诊有明确肿物时,常与乳腺癌鉴别困难。由于非哺乳期乳腺炎性病变的病理过程各不相同,一般在乳腺X线摄影及超声上无特征性,MR影像上亦表现各异[2]。本研究通过对病灶的形态学、信号强度、表观扩散系数(apparent diffusion coefficient,ADC)值、强化特点及时间信号强度曲线(time intensity curve,TIC)类型等进行评价及测量,探讨MRI在非哺乳期乳腺炎性病变诊断中的应用价值。
回顾性分析2010年3月至2017年7月我院经手术或穿刺病理证实的83例非哺乳期乳腺炎性病变患者的乳腺MRI资料。其中急慢性乳腺炎44例(伴脓肿形成13例),脂肪坏死21例,肉芽肿性乳腺炎8例(包括2例可疑乳腺结核),浆细胞性乳腺炎1例,囊肿伴感染3例,导管扩张伴感染2例,导管周围炎4例。既往乳腺癌家族史1例,对侧乳腺癌手术史2例,假体植入手术史1例,自体脂肪植入史1例,肺癌手术史1例。均为女性,年龄26~77岁,中位年龄43岁。本组病例均以发现乳腺肿块来诊,部分伴有疼痛、红肿表现,均无发热症状。
采用GE Signa Excite HDx 3.0 T超导型MR扫描仪,乳腺表面相控阵专用线圈。患者取俯卧位,扫描序列包括T2WI/IDEAL WATER (T2 weighted image/iteration decomposition of water with echo asymmetry and least-squares estimation)、扩散加权成像(diffusion weighted imaging,DWI)及VIBRANT (volume imaging for BReast AssessmeNT)多期动态增强扫描。具体扫描参数,IDEAL WATER序列:TR 3840 ms,TE 102 ms,回波链长度14,带宽62.5,矩阵384×224,激励次数2,层厚5 mm,层间隔0.5 mm,扫描视野30 cm。DWI扫描使用单次激发自旋回波平面成像(single-shot spin-echo echo-planar imaging,ss-EPI)序列:扩散敏感系数b值采用1000 s/mm2、0,取层面选择、频率编码、相位编码3个方向,TR 4275 ms,TE 66.6 ms,矩阵96×96,激励次数2,层厚5 mm,层间隔0.5 mm,扫描视野30 cm。VIBRANT 3D多期动态增强扫描共10期(蒙片+动态增强9期),矢状位扫描,翻转角10° ,TE 1.9 ms,层厚3.6 mm,带宽41.67,矩阵288×192,激励次数1,层厚3.6 mm,层间隔0,扫描视野22 cm×22 cm。对比剂采用Gd-DTPA,高压注射器经手背静脉注射,剂量0.1 mmol/kg体质量,注射速率2.0 ml/s。
扫描数据传输至GE AW 4.6工作站,依据2013年第五版美国放射学会乳腺影像与数据报告系统MRI[3] (ACR BI-RADS magnetic resonance imaging)标准,由2名经验丰富的影像诊断医师共同阅片,分别对病灶的形态学、信号强度、ADC值、强化特点及TIC类型进行评价及测量。将病变分为肿块及非肿块强化,评价肿块的数量(单灶、多灶)、形态(圆形、卵圆形及不规则形)、边缘(清楚、不规则及毛刺)、内部强化特点(均匀、不均匀、环形)及非肿块强化的分布方式(线样、局灶样、节段样、区域样、多区域样、弥漫样)和内部强化模式(均匀、不均匀、集簇样、簇环样)。同时评价病灶的T2WI/IDEAL WATER、DWI信号强度,在DWI图像上选取病灶信号最高处作为感兴趣区(region of interest,ROI),ROI面积应小于高信号区范围,避开囊变及坏死区,在ADC图上测得病灶的ADC值,测量3次取平均值作为病灶的ADC值。在多期动态增强图像上,选取病灶强化最显著、最均匀处作为ROI,避开囊变及坏死区,绘制病灶的TIC曲线类型,共分为3型[3]:Ⅰ型为流入型、Ⅱ型为平台型、Ⅲ型为流出型。
同时评价病灶周围伴随征象及是否伴腋窝淋巴结肿大(短径≥1.0cm)。
入组病例共83例,其中MRI评估分类BI-RADS 3类12例(12/83,14.4%)、BI-RADS 4类59例(59/83,71.1%)、BI-RADS 5类12例(12/83,14.4%)。
MRI表现为肿块54例(54/83,65.1%),非肿块强化29例(29/83,34.9%)。54例肿块病变中,单灶29例(29/54,53.7%),多灶25例(25/54,46.3%)。多灶病变以主要病灶进行形态学和强化特点分析,病灶的平均大小为1.8 cm (0.5~4.2 cm)。肿块和非肿块强化病灶的MR影像表现分别见表1、表2。
54例肿块病变的MR影像表现
54例肿块病变的MR影像表现
| MRI征象 | 例数 | 比例(%) | |
|---|---|---|---|
| 数量(54例) | |||
| 单灶 | 29 | 53.7 | |
| 多灶 | 25 | 46.3 | |
| 形态(54例) | |||
| 卵圆形 | 16 | 29.6 | |
| 圆形 | 11 | 20.4 | |
| 不规则形 | 27 | 50.0 | |
| 边缘(54例) | |||
| 清楚 | 21 | 38.9 | |
| 不规则 | 27 | 50.0 | |
| 毛刺 | 6 | 11.1 | |
| 强化特点(54例) | |||
| 均匀强化 | 0 | 0 | |
| 不均匀强化 | 27 | 50.0 | |
| 环形强化 | 27 | 50.0 | |
29例非肿块强化病变的MR影像表现
29例非肿块强化病变的MR影像表现
| MR征象 | 例数 | 比例(%) | |
|---|---|---|---|
| 分布方式(29例) | |||
| 线样强化 | 1 | 3.4 | |
| 局灶样强化 | 3 | 10.3 | |
| 节段样强化 | 16 | 55.2 | |
| 区域样强化 | 3 | 10.3 | |
| 多区域样强化 | 6 | 20.7 | |
| 弥漫样强化 | 0 | 0 | |
| 强化特点(29例) | |||
| 均匀强化 | 2 | 6.9 | |
| 不均匀强化 | 20 | 69.0 | |
| 集簇样强化 | 2 | 6.9 | |
| 簇环样强化 | 5 | 17.2 | |
本研究83例炎性病变中在T2WI/IDEAL WATER序列上表现为等信号31例(31/83,37.3%)或稍高信号31例(31/83,37.3%),另见高信号21例(21/83,25.3%);DWI序列上表现为稍高信号33例(33/83, 39.8%)或高信号46例(46/83,55.4%),另见等信号4例(4/83,4.8%)(图1,图2)。
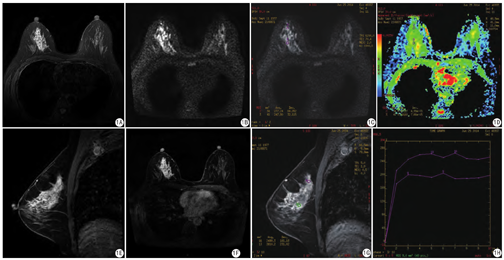

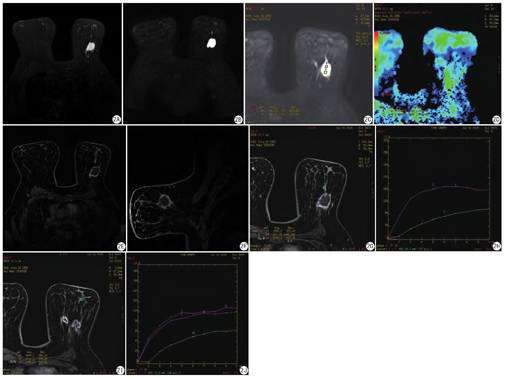

由于4例DWI显示不清,1例病变太小,ADC值无法测量,共测得78例ADC值,范围为(0.55~2.15)× 10-3 mm2/s,平均ADC值为(1.15±0.30)×10-3 mm2/s。78例乳腺炎性病变各病种的ADC值详见表3。此外,13例乳腺炎伴有脓肿形成的ROI选取DWI高信号的中心部位,ADC值的范围为(1.06~1.55)×10-3 mm2/s,平均ADC值为(1.27±0.16)×10-3 mm2/s。
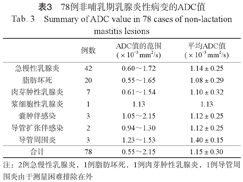
78例非哺乳期乳腺炎性病变的ADC值
78例非哺乳期乳腺炎性病变的ADC值
| 例数 | ADC值的范围(×10-3 mm2/s) | 平均ADC值(×10-3 mm2/s) | |
|---|---|---|---|
| 急慢性乳腺炎 | 42 | 0.60~1.72 | 1.14±0.25 |
| 脂肪坏死 | 20 | 0.55~1.65 | 1.08±0.29 |
| 肉芽肿性乳腺炎 | 7 | 0.61~1.54 | 1.10±0.32 |
| 浆细胞性乳腺炎 | 1 | 1.13 | 1.13 |
| 囊肿伴感染 | 3 | 1.05~2.15 | 1.12±0.25 |
| 导管扩张伴感染 | 2 | 0.94~1.30 | 1.12±0.25 |
| 导管周围炎 | 3 | 1.23~1.53 | 1.40±0.15 |
| 合计 | 78 | 0.55~2.15 | 1.15±0.30 |
注:2例急慢性乳腺炎,1例脂肪坏死,1例肉芽肿性乳腺炎,1例导管周围炎由于测量困难排除在外
病灶内部伴有囊变及坏死区54例(54/83,65.1%) ;病灶周围伴有纤维索条影35例(35/83,42.2%);病灶内部伴有出血9例(9/83,10.8%)。
TIC类型以平台型为主,共52例(52/83,62.7%);流入型17例(17/83,20.5%)和流出型14例(14/83,16.9%)。肿块组与非肿块强化组的TIC类型详见表4。
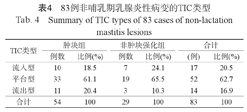
83例非哺乳期乳腺炎性病变的TIC类型
83例非哺乳期乳腺炎性病变的TIC类型
| TIC类型 | 肿块组 | 非肿块强化组 | 合计 | |||
|---|---|---|---|---|---|---|
| 例数 | 比例(%) | 例数 | 比例(%) | (例) | 比例(%) | |
| 流入型 | 10 | 18.5 | 7 | 24.1 | 17 | 20.5 |
| 平台型 | 33 | 61.1 | 19 | 65.5 | 52 | 62.7 |
| 流出型 | 11 | 20.4 | 3 | 10.3 | 14 | 16.9 |
| 合计 | 54 | 100 | 29 | 100 | 83 | 100 |
皮肤异常改变:主要表现为邻近皮肤增厚、模糊,共30例(30/83,36.1%);胸壁异常改变:主要表现为邻近胸肌前水肿或胸壁肌肉边缘模糊,共11例(11/83,13.3%);此外,伴有同侧腋窝淋巴结肿大23例(23/83,27.7%)。
非哺乳期乳腺炎性病变常起病隐匿,一般无典型的红、肿、热、痛等临床表现,可表现为无痛性肿块或肿块伴有触痛,常与乳腺癌鉴别困难。
本组病例患者年龄分布较为广泛,中位年龄43岁,与文献报道非哺乳期乳腺炎性病变患者年龄一般低于乳腺癌的结论相一致[4,5]。提示在临床工作中,如遇到明显低于乳腺癌发病年龄的患者,尤其是育龄期的妇女应考虑到乳腺炎性病变的可能。
临床查体多触及肿块,炎症表现不突出,本组结果中71.1%的病变BI-RADS分类为4类,影像上表现为肿块或非肿块强化,需与浸润性乳腺癌、炎性乳腺癌及导管原位癌(ductal carcinoma in situ,DCIS)相鉴别,提示临床行穿刺活检明确病变性质。
非哺乳期乳腺炎性病变MRI可表现为肿块强化和非肿块强化。本研究结果显示,表现为肿块强化(65.1%)者高于非肿块强化(34.9%),与部分文献报道一致[6]。本研究中表现为肿块的乳腺炎性病变近一半呈多灶,这一比例远远超过乳腺癌多灶分布的概率。这可能与乳腺炎性病变的病理过程及肿块周围含有非肿块样强化病灶有关,在同一病变中炎症反应的各个阶段均可同时发生,相互重叠,并在乳腺内沿导管播散。因此,乳腺炎性病变易呈多灶分布的特点可作为与一般乳腺癌相鉴别的影像特征之一。
表现为肿块的乳腺炎性病变在形态学上无明显特征性,增强扫描呈不均匀强化或环形强化,其中环形强化的比例(50.0%)较高,环壁一般较薄,内壁较为光整,且环内无强化区范围较大,这可能与炎性反应过程中脂肪坏死及脓肿形成有关。Dursun等[7]报道环形强化是乳腺炎性病变最常见、最有价值的征象。王丽君等[6]报道70.5%的非哺乳期乳腺炎性患者MRI表现为环形强化。本组数据中环形强化比例偏低可能与急慢性炎症所占比例较高有关。
表现为非肿块强化的乳腺炎性病变在MR增强扫描常呈节段样强化(55.2%),部分呈区域样和多区域样强化(共31.0%),以不均匀强化为主(69.0%)。节段性强化是DCIS的一个标志性的诊断征象,二者影像上具有一定重叠性,不易鉴别。陈敏等[8]报道,乳腺炎性病变的非肿块强化表现为不均匀强化伴内部多发小环形强化,环中心无强化;而DCIS多呈不均匀簇状强化,环形强化少见。笔者也发现,表现为非肿块强化的乳腺炎性病变中,病变内部多伴有小环形强化,有的甚至呈"蜂窝样",范围一般较为广泛,可跨多个象限及小叶系统,环壁一般较薄,内壁较为光整,且多呈大小不等的环,病理上主要为不同时期的炎性细胞浸润、化脓或积脓改变。DCIS可出现簇环样强化,一般环很小且大小均一,以节段样分布为主,结合强化特点及分布方式,二者有一定鉴别意义。但当病灶不典型时,二者的鉴别仍存在很大难度,有待于积累大量病例深入研究。
本研究中,非哺乳期乳腺炎性病变的T2WI/IDEAL WATER和DWI信号强度无明显特征性,ADC值的范围较大(0.55~2.15)×10-3 mm2/s,平均值为(1.15±0.30)× 10-3 mm2/s。笔者认为,炎性病变的ADC值波动较大,主要与炎症反应的不同时期、脓肿内容物成分的不同相关。由于乳腺炎性病变内部成分较为混杂,ROI选取的成分不一导致ADC值变化较大。13例伴有脓肿形成病变的ROI选取DWI高信号的中心部位,主要考虑到相对于肿瘤的坏死区一般位于病变边缘,脓肿的坏死区多位于病变中心位置。本组数据可见,炎性病变的ADC值参考价值有限,可重复性较差,不能作为鉴别诊断的主要手段。
本组病例显示,65.1%的病灶内部伴有囊变及坏死区,可能与炎性反应引起的组织内部坏死、修复有关,在炎症基础上产生多发脓肿,多为薄壁脓腔,大小不一,可聚集呈"蜂窝样"表现。42.2%的病灶伴有灶周水肿,表现为病灶周围纤维索条影增多,可能与炎性反应引起周围组织水肿、反应性增生有关。通常脓肿形成、脂肪坏死及纤维化是炎性反应后期的病理特征。乳腺炎性病变发生囊变、坏死及灶周水肿的比例较高,有助于与乳腺癌进行鉴别。
本组数据中,非哺乳期乳腺炎性病变的TIC类型以平台型为主(62.7%),与部分文献的描述不尽相同。王丽君等[6]报道,TIC曲线为流出型者多于流入型。谭红娜等[9]报道,58例乳腺炎中98.3%的TIC曲线呈流入型或平台型,可提示良性病变的诊断。在乳腺炎性病变中,不同病灶的TIC类型不同,即使同一病灶,不同区域的TIC类型也有所不同,病灶的TIC类型可能与其处于炎性反应的不同时期有关[10]。当病变处于炎性反应急性期,如脓肿形成,病灶周围新生肉芽组织内含大量新生毛细血管,血管扩张,渗透性较高,TIC可表现为流出型;然而在一些慢性炎性病变中,血管较成熟,渗透性较低,TIC可表现为流入型或平台型[6]。
本组病例中,36.1%的病变伴有邻近皮肤异常改变,13.3%的病变伴有胸壁异常改变。乳腺炎性病变皮肤或胸壁受累一般较为广泛,T2WI/IDEAL WATER信号可增高,但增强扫描一般无明显强化,且无皮肤纠集、乳头凹陷等征象,临床上伴有相应的炎性症状,再结合病变是否存在囊变、坏死及灶周水肿等征象,可能与乳腺癌有一定的鉴别意义。其病理基础为随着炎症进展,乳腺内脓肿会逐渐形成,脓腔可融合扩大,病变范围广泛,易于扩散及蔓延,病情严重者乳房皮肤及胸壁可出现明显的炎性改变。
本组病例中,病理类型较为混杂,以急慢性乳腺炎和脂肪坏死为主,由于各类型病例数量差异较大,没有深入分析各类型的MRI影像特点。另外,非肿块强化病例数相对较少,部分病灶体积较小,对图像的评价及分析存在一定影响。
非哺乳期乳腺炎性病变的MRI影像表现为肿块或非肿块强化。肿块病变易呈多灶分布、不均匀或环形强化,环壁一般较薄,内壁较为光整;非肿块强化病变多呈节段样强化,部分呈区域样或多区域样分布,内部可伴小环形强化,大小不一,内壁较光整;病变常伴有囊变、坏死及灶周水肿,部分伴有邻近皮肤、胸壁异常改变,以上征象具有一定特征性,与乳腺癌的鉴别诊断价值较大。
无。



























