
通过探讨增强T2 FLAIR序列上脑膜瘤周边弧线状强化的特点及其病理改变,明确肿瘤与脑实质交界面的血供情况,给临床提供术前指导。
回顾性分析2017年6月至2018年6月在我院手术证实的89例脑膜瘤MRI资料。所有患者均接受3.0 T MR扫描,包括矢状面和横断面T1WI,横断面T2WI、T2 FLAIR,增强后矢状面和横断面T1WI,以及最后加扫T2 FLAIR。
89例病例中所有脑膜瘤都显示明显强化。在增强T2 FLAIR上,54例(60.7%)脑膜瘤显示出周边弧线状强化,其中25例(28.1%)在平扫T2 FLAIR序列或增强的T1加权像上都未见该征象。数字减影血管造影显示颅内外双重血供,病理证实该征象阳性的脑膜瘤表面具有更高的微血管密度,可能为软脑膜动脉血供区。52例(58.4%)显示脑膜尾征,该征象显示在35例患者的增强T2 FLAIR比T1增强序列更明显。
脑膜瘤增强T2 FLAIR上可显示周边弧线形强化特征,可有效判断肿瘤与脑实质交界面的病理特征,从而判断脑膜瘤的软脑膜动脉供血。

本刊刊出的所有论文不代表本刊编委会的观点,除非特别声明
脑膜瘤占原发性中枢神经系统肿瘤的36.6%,是最常见的中枢系统肿瘤[1]。治疗方式主要为手术切除和硬脑膜修补术[2]。脑膜瘤经常有脑外和脑内的双重血供,脑外血供来源于脑膜动脉,脑内血供来源于穿行于脑实质的软脑膜动脉,并且以前者占主要。但是如果术中发现它有丰富的脑内动脉供血(幕上脑膜瘤由颈内动脉供血多见),手术前结扎颈内动脉才能避免术中大出血的风险。但金标准诊断方法数字减影血管造影(digital subtraction angiography,DSA)为有创检查,并非每个患者都有条件采用,因此无创用MRI技术判断术前对脑膜瘤血供的来源有重要的临床意义。快速液体衰减翻转恢复(fast fluid-attenuated inversion-recovery,FLAIR)序列能抑制长T2信号的脑脊液和等T2信号的脑组织的信号,因此理论上增强T2 FLAIR会比传统增强T1加权成像(T1 weighted image after contrast,T1WI+C)更易显示脑膜上的病灶实际情况。而因为FLAIR序列对低剂量的钆剂更敏感[2],只需在常规T1WI增强扫描后补充T2 FLAIR序列扫描,仅增加了患者的扫描时间(约3 min),而不增加对比剂用量和经济负担。
近年来有相关研究[3]指出,脑膜瘤边缘在MRI上的不同表现能对应结缔组织、血管或脑脊液,将有效揭示术中肿瘤与脑实质表面的粘连情况、指导手术方案的确定,但尚未有研究将脑膜瘤周边的血供情况和特定的MRI表现对应起来。本研究回顾性分析的89例脑膜瘤病例均是在常规T1WI增强扫描后增加T2 FLAIR序列,通过影像-病理对照研究、结合组织病理学表现和定量微血管(microvessels density,MVD)计数,以阐明增强T2 FLAIR上脑膜瘤周边弧线形强化产生机制。
回顾性分析2017年6月至2018年6月在我院手术证实的89例脑膜瘤MRI资料。89例患者均使用GE 3.0 T扫描仪,8通道头部线圈,进行磁共振检查。进行T1WI、T2WI和T2 FLAIR序列扫描后,静脉注射剂量为0.1 mmol/kg的钆对比剂(马根维显,北陆药业,中国北京)后进行T1WI增强扫描,最后加扫T2 FLIAR。图像从矢状位、轴位获取,截面厚度=5 mm,层面间距= 1 mm。所有病例肿瘤术后均进行组织病理学检查、行HE染色和CD34免疫组织化学方法。
由两名分别有5年和4年经验的放射科医师评估。肿瘤直径测量于肿瘤在各方位上图像中的最大截面。若肿瘤存在脑膜尾征,则增强后"脑膜尾征"的T1和T2强化程度分3种类型统计:增强后T1WI显示更佳,增强后T1WI和增强后T2 FLAIR显示效果相差不大,增强后T2 FLAIR显示更佳,统计这3种类型的病例数。
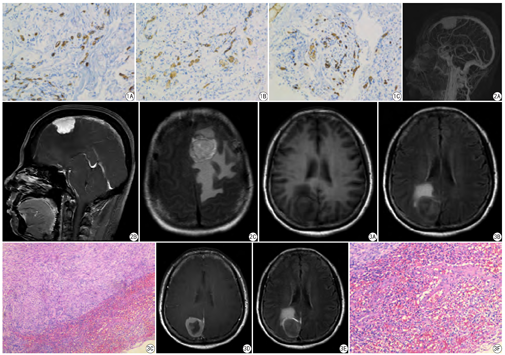
免疫组织化学染色检测标本中CD34的表达,一抗为兔抗人CD34单克隆抗体(1∶200)。CD34主要在细胞膜和细胞质,染色呈棕黄色颗粒者为阳性。先在低倍镜(×40)下确定脑膜瘤边缘部分,200倍显微镜下计算3个视野下的微血管数(见图1),求平均值。微血管数的具体判定方法:任何被染色为棕黄色的内皮细胞团或者单个内皮细胞都统计为一条独立的血管,是否形成管腔或有无红细胞存在不能成为判断标准,只要它们与邻近的肿瘤细胞、微血管以及其他结缔组织形成清楚的分隔,即是1个可计数的微血管。

应用SPSS 22.0统计软件分析,采用单样本非参数检验计算数据是否为正态分布。非正态分布数据用Mann-Whitney非参数检验。正态分布数据之间的比较采用t检验,P<0.05为差异有统计学意义。
本研究中89例病例包括56名女性,33名男性。年龄17~83岁,平均年龄(57.14±13.98)岁,其中<40岁10例,40~60岁33例,>60岁46例。位于大脑半球凸面最多(65例,73.03%),小脑凸面9例(10.11%),侧脑室后角7例(7.86%),大脑镰旁4例(4.49%),颅底(鞍结节、桥小脑脚、蝶骨嵴、嗅沟)4例(4.49%)。
常规MRI所见脑膜瘤表现为以硬脑膜为基底生长的脑外肿瘤,平扫T1WI序列表现为等或略低信号,瘤周水肿比肿瘤实质信号更低;平扫T2 FLAIR序列表现为等或稍高信号,瘤内囊性成分和瘤周水肿为高信号。增强扫描后,89例中所有脑膜瘤都显示强化,T1、T2 FLAIR表现为不均匀强化较多(64.7%、71.8%);肿瘤T1强化方式:均匀强化34例,不均匀强化55例;肿瘤T2强化方式:均匀强化24例,不均匀强化65例。肿瘤直径大小为9.85~91.84 mm,平均(35.29±17.59) mm,其中<20 mm 20例,20~40 mm 37例,>40 mm 32例。
在增强后T2 FLAIR上,62例(69.7%)脑膜瘤显示出周边弧线状强化,其中12例DSA证实为颅内外动脉双重血供(见图2)。25例患者术中肿瘤与脑实质的交界面表现为更多的粘连和出血倾向,术中可见颅内动脉血供为多。
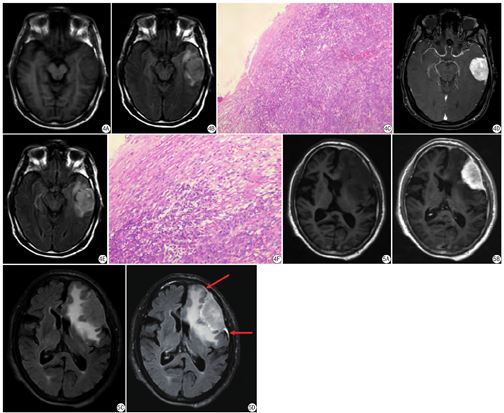
在增强后T2 FLAIR上,62例(69.7%)脑膜瘤显示出周边弧线状高信号,其中25例病例仅在增强T2 FLAIR后显示该征象(在平扫T2 FLAIR序列或增强T1加权像上都未见该征象),该25例肿瘤术后HE染色可见肿瘤边缘部分、肿瘤与肿瘤表面的脑膜含有丰富微血管腔(见图3)。27例未显示出周边弧线形强化征的脑膜瘤中,肿瘤表面仅见少量血管和受压的蛛网膜(见图4)。

按照有无周边弧线形强化征分为4组(表1):①增强T1WI、增强T2 FLAIR可见;②仅增强T1 FLAIR可见;③仅增强T2 FLAIR可见;④增强T1WI、增强T2 FLAIR均不可见。每组MVD平均值先用用单样本非参数检验方法进行正态性检验。组②、组③、组④MVD数值都符合正态分布,用平均值±标准差表示;组①不符合正态分布,用中位数(四分位数间距)表示。组②、组④分别与组③两两采用两独立样本t检验统计方法;组①与组3进行Mann-Whitney非参数检验。统计结果如表1,表示4种不同类型的影像学表现均表现出脑膜瘤边缘MVD的不同情况。而且分组③仅增强后T2 FLAIR显示周边弧线形强化征的肿瘤边缘MVD计数明显大于分组④周边弧线形征阴性肿瘤边缘MVD。

脑膜瘤周边弧线形强化征与MVD的统计
脑膜瘤周边弧线形强化征与MVD的统计
| 分组 | 周边弧线形强化征(+) | 肿瘤边缘MVD/(个/200×) | 与组③的t检验比较/P值 |
|---|---|---|---|
| ①增强T1WI、增强T2 FLAIR可见 | 29 | 35.33(33.00,37.833) | <0.05 |
| ②仅增强T1WI可见 | 8 | 36.75±13.11 | <0.05 |
| ③仅增强T2 FLAIR可见 | 25 | 42.34±6.43 | N/A |
| ④增强T1WI、增强T2 FLAIR均不可见 | 27 | 21.52±6.71 | <0.05 |
52例脑膜瘤患者的MR图像中增强T1WI或增强T2 FLAIR上可见脑膜尾征,该征象多数在增强T2 FLAIR比T1WI增强序列更明显(图5)。由两名分别有5年和4年工作经验的放射科医师评估该52例脑膜瘤患者MR图像上"脑膜尾征"在不同序列的表现(结果见表2),可见该部分脑膜瘤患者增强T2 FLAIR的图像比增强T1WI更能清晰地显示脑膜瘤的"脑膜尾征"。

"脑膜尾征"在增强T1WI和T2 FLAIR强化表现比较(例)
"脑膜尾征"在增强T1WI和T2 FLAIR强化表现比较(例)
| 类别 | 增强后T1WI显示更佳 | 增强后T1WI和增强T2 FLAIR差别不大 | 增强后T2 FLAIR显示更佳 |
|---|---|---|---|
| 放射科医师1 | 7 | 9 | 36 |
| 放射科医师2 | 8 | 11 | 33 |
临床上通常对肿瘤的诊断来源于对增强后T1WI图像识别,但脑皮层上的病灶常因高亮血管影或血管流空效应的影响而被掩盖。而FLAIR序列反转时间较长、具有轻微T1效应,能抑制脑脊液伪影和背景脑组织的信号,从而突出显示具有皮层表面、脑室周围长T2特性病灶组织[4],即T2 FLAIR作为一个T2加权序列却可用于钆剂的增强扫描,凸显病灶。SE类序列对高浓度的钆对比剂量更敏感,而IR类序列对低浓度的对比剂显影更灵敏,3D-T2 FLAIR序列在常规和低剂量的对比剂扫描中会有更大的临床应用价值[5]。
当注射对比剂钆剂后行T2 FLAIR扫描,肿瘤的富血供部分钆剂浓度比周围组织高,所以该富血供部分会迅速恢复到较大的纵向向量,而正常脑组织因为血脑屏障,弛豫速度保持不变,实现富血供肿瘤的成像。因此,脑膜瘤中血管密度较低、血流相对缓慢的的软脑膜动脉或其他脑内动脉供血的部分因对比剂含量少,在常规的增强T1 SE序列中难以与脑外动脉供血部分区分,但若加扫T2 FLAIR序列,则存留于软脑膜动脉中对比剂会因轻微的T1效应而显示出来。因此,FLAIR序列容易区分软脑膜、皮质血管,在常规增强检查后增加T2 FLAIR序列应用于脑原发肿瘤的诊断可以增加更多的信息,有助于鉴别诊断。
本研究观察到增强T2 FLAIR序列上约69.7%的脑膜瘤可显示肿瘤周边弧线形强化征象,部分病例亦有DSA证实软脑膜动脉供血,病理染色见此区域的微血管密度明显高于此征象阴性的脑膜瘤,可见T2 FLAIR周边弧线形强化征能够反映肿瘤的软脑膜供血情况,从而指导临床医生采取相关术前准备。
尽管脑膜尾征不是脑膜瘤的唯一特征,可能在转移灶或血管外皮细胞瘤中看到,通常用于脑膜瘤和神经鞘瘤[6]的鉴别诊断。但Qi等[7]指出脑膜尾征的显示对脑膜瘤切除范围的手术方案制订密切相关,若脑膜尾征表现为光滑型,则切除范围距肿瘤2.5 cm的脑膜;若为结节型或平滑-结节状混合型,则至少应切除更大范围的脑膜甚至视肿瘤位置酌情广泛切除;若有肿瘤多个不同方向的"尾征",术前骨瓣设计也要相应调整。而本研究通过放射学医师评分,发现对脑膜瘤的"尾征"在增强T2 FLAIR比增强T1对脑膜瘤的"尾征"。瘤周水肿在增强T2 FLAIR中更容易被辨认,该部分肿瘤可能为分泌性脑膜瘤的亚型或侵及脑实质的肿瘤[6],瘤周水肿与高水平的胶原蛋白XVIII和血管内皮生长因子(vascular endothlial growth factor,VEGF)表达呈相关关系[8]。
增强T2 FLAIR序列的研究目前主要应用于脑膜炎[12]、脑转移瘤[13,14,15]、多发性硬化[16],以及内耳系统疾病(如梅尼埃病[17]、听神经炎[18]等),其他方面的应用并没有引起重视。除了原发性神经元疾病外,脑内的其他器官如正中隆起和松果体,也被证实在增强后T2 FLAIR中有更显著的强化[19]。
增强T2 FLAIR序列也有其局限性,T2 FLAIR上观察到浓度相关的变化图像不太突出,因此更小的脑膜瘤可能看起来是均匀的。但是,若能更改参数配置还能进一步提供其精确度,张德生等[20]发现0.35 T场强的FLAIR序列T2WI上,当TR超过5000 ms时,采用的TE越长,能检出脑脊液中的钆剂浓度越低。增强后T2 FLAIR在脑膜瘤诊断中的临床应用仍待更大样本量、更深入的研究。
本文通过对增强T2 FLAIR在脑膜瘤的临床应用进行归纳,发现增强T2 FLAIR序列上脑膜瘤表现出的周边弧线形强化特征能预测双重血供和更多表面微血管的可能性,阐述在常规增强MRI的基础上增加T2 FLAIR序列的必要性。随着增强T2 FLAIR的进一步推广应用,将会发现其更多的临床应用价值。
无。



























