
探讨微囊型脑膜瘤的MRI分型,提高对本病的认识。
回顾性分析20例经手术病理证实的微囊型脑膜瘤的影像学资料,20例均行MRI平扫,MRI增强扫描16例。
20例中1型9例(40.9%),2型5例(22.7%),3例6例(27.2%);9例1型均为实性肿块,T1WI呈低信号,T2WI呈高信号,MRI增强扫描肿瘤显著均匀强化;5例2型均似囊性肿块,T1WI呈显著低信号,T2WI呈显著高信号,MRI增强扫描肿瘤呈网格、片絮、辐射状轻度强化,其中2例肿瘤边缘可见囊状无强化区;6例3型均为囊实性肿块,实性部分T1WI呈稍低信号,T2WI呈稍高信号,囊性部分T1WI呈低信号,T2WI呈高信号,增强扫描肿瘤实性部分显著强化,囊性部分无强化,囊壁轻度强化。
微囊型脑膜瘤MRI分型均有其各自特点,其中以2型MRI表现最具特征。

本刊刊出的所有论文不代表本刊编委会的观点,除非特别声明
微囊型脑膜瘤作为脑膜瘤的特殊病理亚型,属WHO Ⅰ级,其影像学与病理表现均有一定特征[1],且其MRI表现与病理显著相关[2]。由于本病少见,且多为个案报道,目前国内尚无对本病MRI分型的报道,笔者收集20例病理证实的微囊型脑膜瘤的临床以及影像学资料,总结其MRI表现,以提高对本病影像学特征的认识。
收集2015年4月至2019年5月西安高新医院经手术病理证实的微囊型脑膜瘤20例。患者男8例,女性12例。年龄32~66岁,中位年龄49岁。20例患者病程1个月至4年不等;20例患者临床以头痛头昏为主要症状;其中头痛伴有恶心、呕吐者13例,伴有肢体运动障碍6例;伴抽搐3例。
20例患者Philips Achieva 1.5 T磁共振扫描仪,4通道头线圈,横轴面T2WI:TR 4500 ms,TE 87 ms;T1WI: TR 250 ms,TE 2.5 ms;矢状面T1WI:TR 440 ms,TE 2.5 ms;矩阵256×256;层厚5 mm,视野220 mm×220 mm,翻转角150° ,NSA为2次。16例行MR增强扫描,对比剂采用Gd-DTPA,剂量为0.2 mmol/kg。
术后20例标本经4%中性甲醛固定,石蜡包埋,常规切片,行HE染色。16例经免疫组化染色采用Envision法,标记物为EMA、VIM、GFAP、CK、S-100,所有抗体及试剂盒均购自Dako公司。
20例肿瘤发生于大脑半球凸面者9例,大脑镰旁7例,上矢状窦旁3例,蝶骨嵴1例。17例肿瘤与相邻硬脑膜呈宽基底改变;3例肿瘤与相邻硬脑膜无宽基底改变。20例肿瘤相邻颅内板骨质增生12例,相邻颅内板骨质无异常改变8例。10例肿瘤周围水肿显著,8例瘤周水肿轻微,2例瘤周无水肿。20例肿瘤无分叶15例,分叶5例。20例中1型9例(40.9%),2型5例(22.7%) ,3型6例(27.2%) ;9例1型均为实性肿块,T1WI呈低信号,T2WI呈高信号,MRI增强扫描肿瘤显著均匀强化(图1,图2,图3,图4);5例2型均似囊性肿块,T1WI呈显著低信号,T2WI呈显著高信号,MRI增强扫描肿瘤呈网格、片絮、辐射状轻度强化,其中2例肿瘤边缘可见囊状无强化区(图5,图6,图7,图8);6例3型均为囊实性肿块,实性部分T1WI呈稍低信号,T2WI呈稍高信号,囊性部分T1WI呈低信号,T2WI呈高信号,增强扫描肿瘤实性部分显著强化,囊性部分无强化,囊壁轻度强化(图9,图10,图11,图12)。
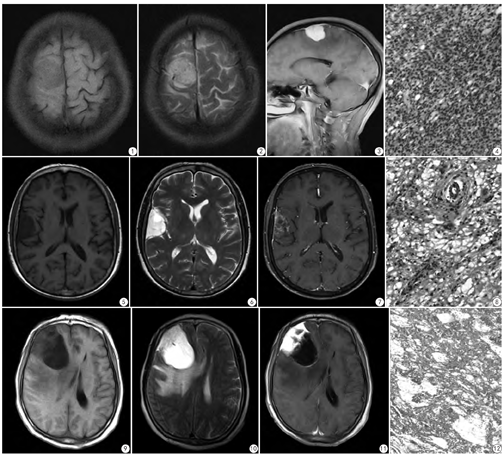

20例肿瘤组织切面呈灰白色,9例瘤体质中,11例瘤体质软。1型以实性细胞为主,显微镜下瘤细胞呈实性片状为主,大小一致,排列整齐,核圆形,染色均匀,其间可见瘤细胞空泡融合成微囊结构,间质血管增生(图4)。2型以微囊型为主,显微镜下瘤细胞大小一致,核圆形,染色均匀,形态温和,细胞间呈空泡状,多个空泡融合成微囊,个别囊腔内见嗜酸性黏液滴,间质血管增生(图8)。3型以囊实性为主,镜下见瘤细胞间空泡融合成微囊,部分囊腔扩张,囊内可见黏液样物质。微囊之间瘤细胞增生,呈实片状,大小一致,核圆形,染色均匀,形态温和,间质血管增生(图12)。16例免疫组化上皮膜抗原EMA及波形蛋白VIM均(+),GFAP、CK、S-100蛋白均(-)。ki67<1%。
根据WHO中枢神经系统分类,将脑膜瘤分为3级,15个病理类型[3]。微囊型脑膜瘤占颅内脑膜瘤的0.3%,是所有病理类型中发生率最低的[4]。其大多数发生于硬膜下,发生于硬膜外或颅骨罕见[5]。本病的临床表现无特殊性,可无症状或以头痛头晕为主要症状。其发病年龄及性别与其他类型脑膜瘤无差异。微囊型脑膜瘤显微镜下瘤细胞呈圆形或梭形旋涡状排列,瘤细胞突起相互交织构成大量细胞外间隙,其细胞外液体聚集可能与肿瘤将脑脊液局限性包裹、肿瘤瘤体变性、瘤体内低蛋白液体渗出有关。在微囊构成的疏松网状结构之间常可见上皮细胞型或过度细胞型脑膜细胞,局部可见钙化小体,部分囊内可见淡红色蛋白性液体,部分微囊可相互融合成小囊[6]。
既往文献报道,微囊型脑膜瘤的CT表现可呈等、低、稍高密度[7],目前尚未见国内外文献对本病钙化的报道。钙化发生的原因主要是肿瘤组织中碱性磷酸酶含量增高,发生钙化多见于良性脑膜瘤血供不太丰富或病程缓慢者[8]。本组病例MRI信号符合多数文献报道,即长T1、长T2信号特征[2,9]。其形成与肿瘤细胞排列疏松、微囊内嗜酸黏液聚集导致瘤体质地柔软,瘤体内含水丰富相关[2]。本组瘤周水肿的高发生率亦与文献报道相符[9]。既往研究认为水肿指数可作为WHO Ⅰ级的罕见类型,广泛的瘤周水肿表明存在WHO Ⅰ级的罕见类型[10],近年研究认为瘤周水肿主要为瘤周脑组织静脉回流受阻所致[11]。结合本组病例,与既往文献对比[2, 9,12],笔者认为微囊型脑膜瘤强化方式主要包括显著均匀强化和不均匀强化,其中不均匀强化包括辐射状条絮样强化及片絮样轻度强化。尽管显著均匀强化所占比例较高,但与其他类型脑膜瘤相比无显著差异,而不均匀强化所包含辐射状条絮样强化及片絮样轻度强化与其他类型脑膜瘤相比具有一定特征,笔者发现,本组病例的这一强化特征在其他的文献报道中亦得到印证[13],只是这一强化特征发生的比例较少。在最近大宗病例的研究中[7],将微囊型脑膜瘤的MRI分为3型,其中1型指肿瘤显著均匀强化,本组9例属1型;2型指瘤体内网格或片絮状、辐射状轻度强化,肿瘤边缘强化,本组5例属2型;3型指肿瘤大部囊变,其位于宽基底部实性部分显著强化,囊壁轻度环形强化,本组6例属3型。除1型以外,2、3型均可发生囊变,其中3型囊变程度及范围最显著。需要指出的是,微囊是显微镜下特征,尽管呈长T1、长T2信号,在未发生囊变的病例中,其内部会强化。微囊型脑膜瘤并非囊性脑膜瘤,但部分病例可发展成囊性脑膜瘤。本组病例囊变主要发生在肿瘤周边,根据囊性脑膜瘤分类[14],属Nauta Ⅱ型。
本病主要与非典型性脑膜瘤、血管外皮细胞瘤等相鉴别。非典型性脑膜瘤在瘤周水肿及肿瘤分叶、瘤脑界面模糊所占比例高于微囊型脑膜瘤,而微囊型脑膜瘤囊变高于非典型性脑膜瘤,两者强化无明显差异[15]。血管外皮细胞瘤肿瘤分叶较微囊型脑膜瘤显著,其肿瘤信号亦常不均匀,内多见丰富血管流空影,邻近颅骨可呈溶骨性破坏,两者鉴别不难。
本文微囊型脑膜瘤MRI分型其强化、囊变特征可作为其影像学表现的补充,对充分认识微囊型脑膜瘤的影像学特征具有重要意义。此外,近年的研究认为,低ADC值对本病囊变与其他病理类型脑膜瘤囊变鉴别具有重要价值[15]。本病首选手术治疗,其预后良好。
无。



























